Содержание
- 2. Свидетельства сложности строения атома Электролиз (1800 г.) Фотоэффект ( Герц, Столетов, 1887-1888г.) Теория электролитической диссоциации (
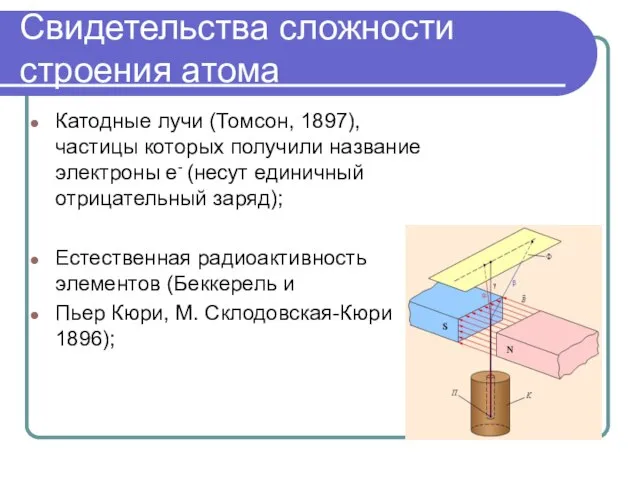
- 3. Свидетельства сложности строения атома Катодные лучи (Томсон, 1897), частицы которых получили название электроны е- (несут единичный
- 4. Основные понятия и определения Атом это наименьшая частица химического элемента, способная к самостоятельному существованию, подчиняющаяся квантовым
- 5. Основные понятия и определения Электрон – стабильная элементарная частица, имеющая массу покоя 9,109 · 10-31 кг
- 6. Основные понятия и определения Протон – ядро атома легкого изотопа водорода 1, элементарная частица, несущая положительный
- 7. Основные понятия и определения Нейтрон – электрически нейтральная элементарная частица с массой покоя 1,675 · 10-27
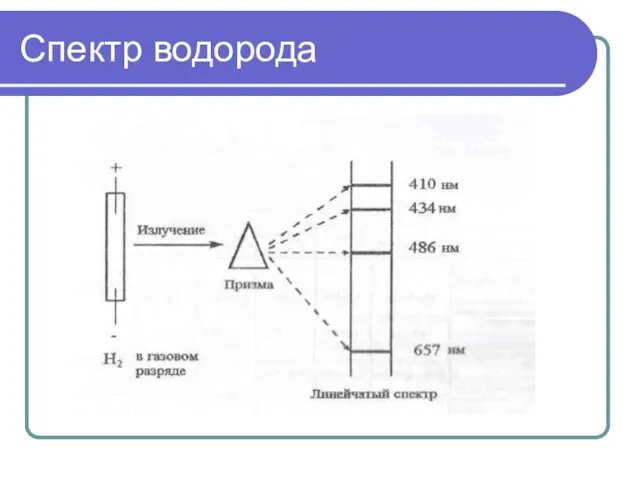
- 8. Атомные спектры Данные о спектрах химических элементов - экспериментальное основание теории строения атома. Спектры, получаемые разложением
- 9. Спектр водорода
- 10. Атомный спектр водорода в видимой и ближней УФ-области (серия Бальмера) R – постоянная Ридберга; R =
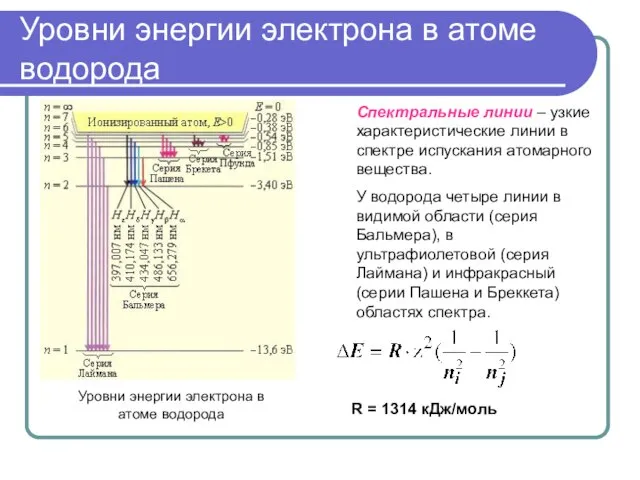
- 11. Уровни энергии электрона в атоме водорода Уровни энергии электрона в атоме водорода Спектральные линии – узкие
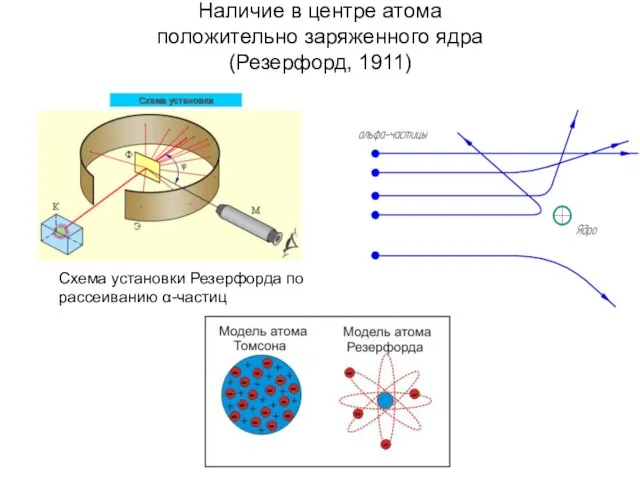
- 12. Наличие в центре атома положительно заряженного ядра (Резерфорд, 1911) Схема установки Резерфорда по рассеиванию α-частиц
- 13. Планетарная модель строения атома.(Бор,1910г.) Постулаты Бора. 1. Электрон вращается по строго определенным стационарным орбитам. При этом
- 14. Планетарная модель строения атома.(Бор,1910г.) Постулаты Бора Для атома водорода разрешены состояния, для которых радиус орбиты и
- 15. Постулаты Бора 2. Поглощение и излучением атомом энергии имеет место при переходе с одной орбиты на
- 16. Основные понятия и определения Так как связь длины волны и массы покоя фотона: ∆Е = Е2
- 17. Теория ЗОММЕРФЕЛЬДА Стационарные орбиты в атомах могут быть не только круговыми, но эллиптоидными и могут различным
- 18. Недостатки теории Бора-Зоммерфельда 1. При расчете ряда спектральных характеристик теория дает результаты, не совпадающие с опытом.
- 19. Квантово-механическая модель строения атома Двойственная природа электрона. Электрон обладает корпускулярно-волновым дуализмом, т.е. может вести себя и
- 20. Квантово-механическая модель строения атома Принцип неопределенности Гейзенберга (1927 г.): невозможно в любой момент времени определить и
- 21. Уравнение Шредингера Э. Шредингер предложил описывать движение микрочастиц с помощью уравнения, которое связывает энергию, координаты и
- 22. Квантовые числа Для описания орбитали (электрона) используют квантовые числа (параметры в уравнении Шредингера) 1. Главное квантовое
- 23. n характеризует: а) номер энергетического уровня; б) интервал энергии электронов, находящихся на этом уровне; в) размеры
- 24. Энергия связи электрона с ядром определяется формулой: E = -Rz2/n2 R -постоянная Ридберга Z- заряд ядра
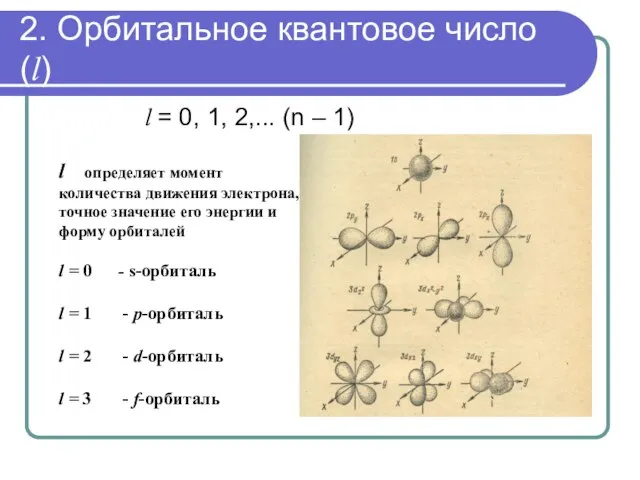
- 25. 2. Орбитальное квантовое число (l) l = 0, 1, 2,... (n – 1) l определяет момент
- 26. 2. Орбитальное квантовое число (l) r=a0 Среднее расстояние от электрона до ядра. Для электрона в атоме
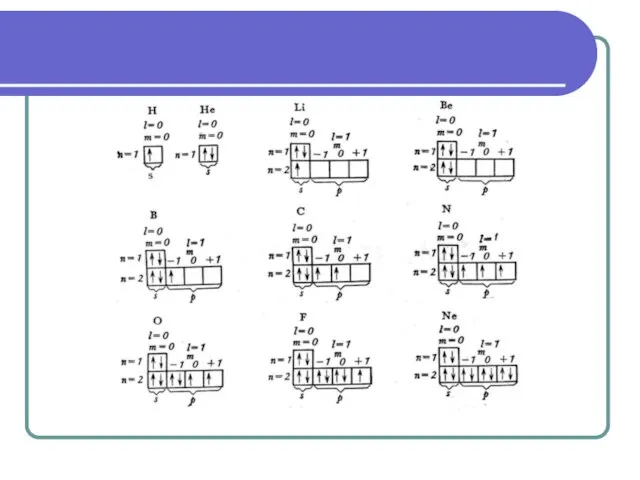
- 27. 3. Магнитное квантовое число (m) m = -l…0…+ l определяет возможные ориентации электронного облака в пространстве.
- 28. Спиновое квантовое число S s = ± 1/2 отражает у электрона наличие собственного момента движения В
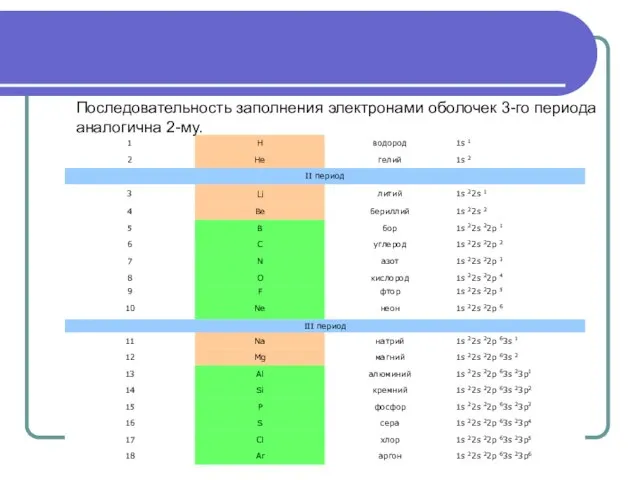
- 31. Последовательность заполнения электронами оболочек 3-го периода аналогична 2-му.
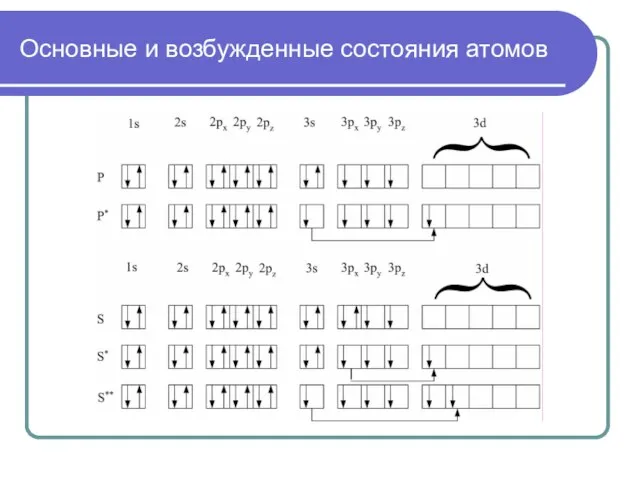
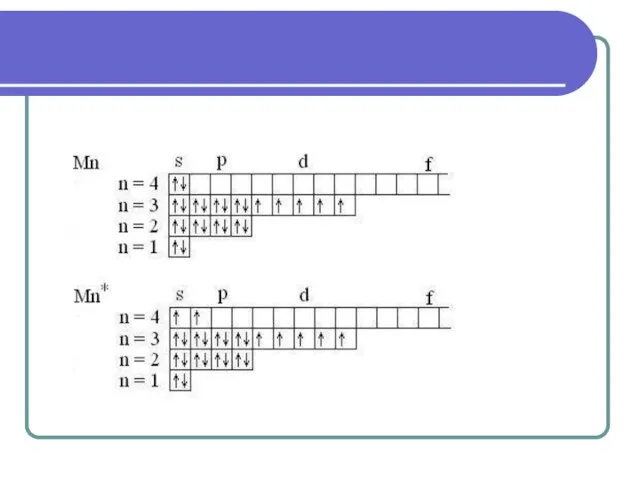
- 32. Возбужденные состояния атомов
- 34. Основные и возбужденные состояния атомов
- 35. Третий период заканчивается Ar+18 1S22S22p63S23p6 3d-подуровень не заполняется, т.к. n+l=5, а для 4S n+l=4, уровень энергии
- 37. Аналогичным образом идет заполнение электронных оболочек у элементов 5-го периода. Шестой период содержит 32 элемента ,
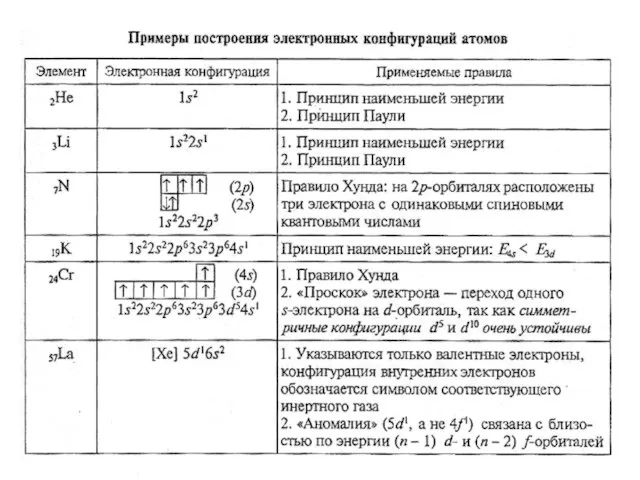
- 38. Принцип Паули и правило Хунда Принцип Паули. В атоме не может быть двух электронов, состояние которых
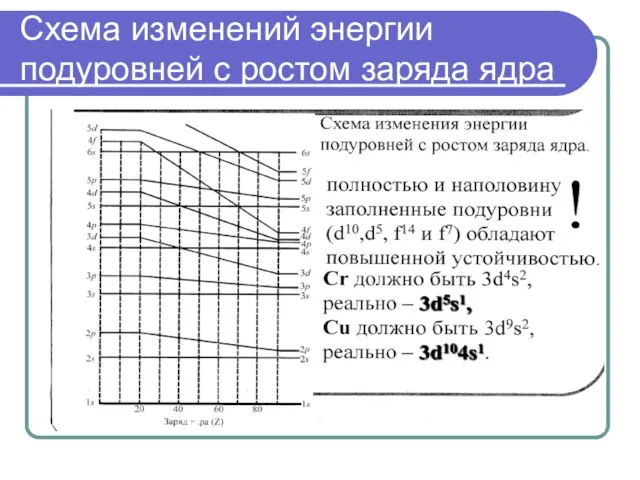
- 39. Многоэлектронные атомы 1. Принцип минимума энергии В атоме каждый электрон занимает тот подуровень на котором его
- 40. Схема изменений энергии подуровней с ростом заряда ядра
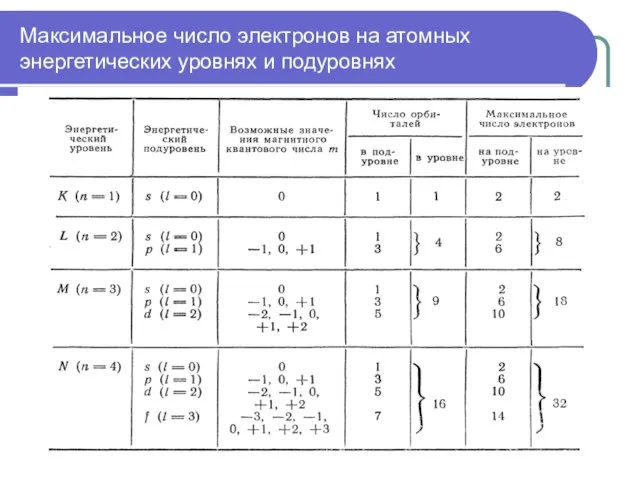
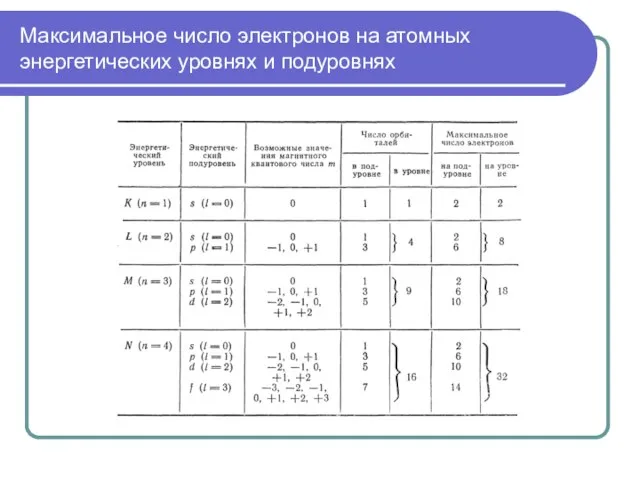
- 43. Максимальное число электронов на атомных энергетических уровнях и подуровнях
- 44. Максимальное число электронов на атомных энергетических уровнях и подуровнях
- 47. Скачать презентацию






























 Периодическая система химических элементов Д.И. Менделеева. Урок 32
Периодическая система химических элементов Д.И. Менделеева. Урок 32 Введение в термические процессы вторичной переработки нефти
Введение в термические процессы вторичной переработки нефти Моющие и чистящие средства
Моющие и чистящие средства Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound
Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound Глюкоза Презентацію виконали учениці 11-Б класу Христинівської спеціалізованої школи І – ІІІ ступенів № 1 ім. О. Є. Корнійчука В
Глюкоза Презентацію виконали учениці 11-Б класу Христинівської спеціалізованої школи І – ІІІ ступенів № 1 ім. О. Є. Корнійчука В Виды коррозии
Виды коррозии Ахрамович Наталья Михайловна учитель химии ГБОУ СОШ № 450 Курортного района Санкт – Петербурга
Ахрамович Наталья Михайловна учитель химии ГБОУ СОШ № 450 Курортного района Санкт – Петербурга Коллигативные свойства растворов
Коллигативные свойства растворов Вторая главная подгруппа ПС
Вторая главная подгруппа ПС Презентация по Химии "Презентация Химия вокруг нас" - скачать смотреть
Презентация по Химии "Презентация Химия вокруг нас" - скачать смотреть  Минералы и горные породы Крыма
Минералы и горные породы Крыма Кристаллы. Выращивание кристаллов в домашних условиях
Кристаллы. Выращивание кристаллов в домашних условиях Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Агрегатные состояния вещества Д.З.§ 12.
Агрегатные состояния вещества Д.З.§ 12. Розрахунок електронної структури та фізичних властивостей певних структур на основі методів квантової хімії
Розрахунок електронної структури та фізичних властивостей певних структур на основі методів квантової хімії Межлабораторные сравнительные испытания качественных параметров нефтепродуктов
Межлабораторные сравнительные испытания качественных параметров нефтепродуктов Класифікація неорганічних сполук
Класифікація неорганічних сполук Химияны оқыту әдістері
Химияны оқыту әдістері Условия движения кусков по поверхности. Грохоты
Условия движения кусков по поверхности. Грохоты Продукты - рекордсмены по содержанию различных минеральных компонентов
Продукты - рекордсмены по содержанию различных минеральных компонентов Кислоты
Кислоты Описание и сравнение признаков 2-3 тел и веществ
Описание и сравнение признаков 2-3 тел и веществ Глюкоза (C6H12O6)
Глюкоза (C6H12O6) Синтетические каучуки
Синтетические каучуки Биомакромолекулы. Нуклеиновые кислоты
Биомакромолекулы. Нуклеиновые кислоты Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Серная кислота и её свойства
Серная кислота и её свойства Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов
Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов