Содержание
- 3. 1. Порядковый номер химического элемента соответствует положительному заряду атомного ядра. Порядковый (атомный) номер (Z)
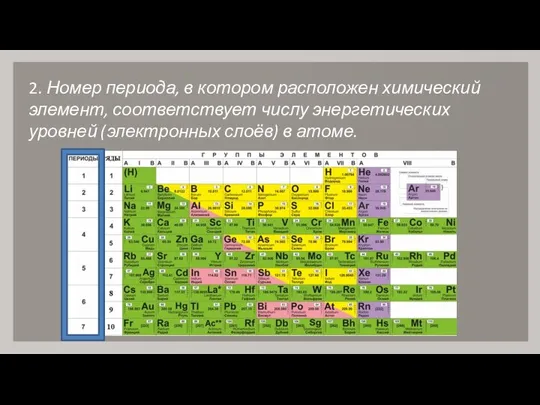
- 4. 2. Номер периода, в котором расположен химический элемент, соответствует числу энергетических уровней (электронных слоёв) в атоме.
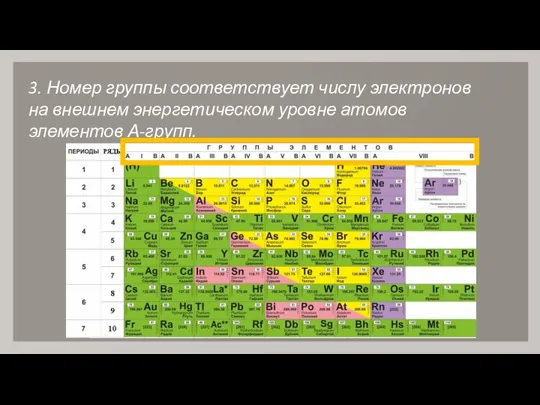
- 5. 3. Номер группы соответствует числу электронов на внешнем энергетическом уровне атомов элементов А-групп.
- 6. Атомы всех химических элементов стремятся заполнить свой внешний электронный слой, подобно атомам благородных газов. присоединить электроны,
- 7. С увеличением числа электронов на внешнем энергетическом уровне ато- мов металлические свойства химических элементов ослабевают, а
- 8. С увеличением радиуса атомов металлические свойства химических эле- ментов усиливаются, а неметаллические — ослабевают. Чем больше
- 9. В пределах одного периода с увеличением порядкового номера химических элементов металлические свойства ослабевают, а неметаллические -
- 10. Si, P, S — неметаллические свойства усиливаются (так как атомы этих химических элементов имеют одинаковое число
- 11. Si, Al, Mg — металлические свойства уси- ливаются, неметаллические ослабевают (так как атомы этих химических элементов
- 12. B, Al, Ga — металлические свойства усили- ваются, а неметаллические ослабевают, так как атомы этих химических
- 14. Скачать презентацию









 Свойства растворов ВМС: особенности растворения, реологические свойства, осмос. Устойчивость растворов ВМС
Свойства растворов ВМС: особенности растворения, реологические свойства, осмос. Устойчивость растворов ВМС Великие русские химики
Великие русские химики Строение атома. Атомные орбитали. Типы связей. Основные органогенные элементы, их роль
Строение атома. Атомные орбитали. Типы связей. Основные органогенные элементы, их роль Хімічні властивості алкенів і алкінів
Хімічні властивості алкенів і алкінів Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Водород, его общая характеристика, нахождение в природе и его свойства Урок химии 8 класс
Водород, его общая характеристика, нахождение в природе и его свойства Урок химии 8 класс  Понятие о валентности и химической связи. Ковалентная химическая связь.(Учитель химии и биологии Алексеева А.К. МОУ «Рунгинская СО
Понятие о валентности и химической связи. Ковалентная химическая связь.(Учитель химии и биологии Алексеева А.К. МОУ «Рунгинская СО Презентация по Химии "Водородные соединения неметаллов" - скачать смотреть
Презентация по Химии "Водородные соединения неметаллов" - скачать смотреть  Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Основні види палива та їх роль в енергетиці країни
Основні види палива та їх роль в енергетиці країни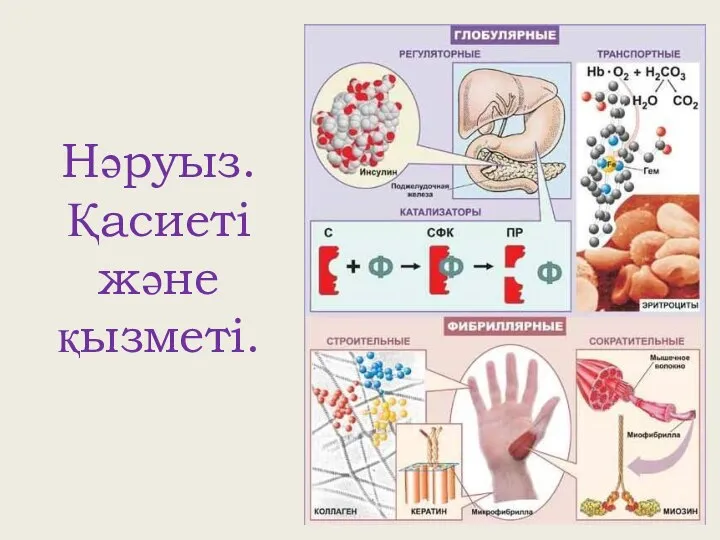 Нәруыз. Қасиеті және қызметі
Нәруыз. Қасиеті және қызметі Дисперсные системы. Лиофобные дисперсные системы (часть 2)
Дисперсные системы. Лиофобные дисперсные системы (часть 2) Соли. Классификация сложных неорганических веществ
Соли. Классификация сложных неорганических веществ Тема: Ионные уравнения реакции Вспомним реакцию нейтрализации.
Тема: Ионные уравнения реакции Вспомним реакцию нейтрализации.  Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества Обзор разных типов химических связей
Обзор разных типов химических связей Скорость химической реакции
Скорость химической реакции Коррозия металлов
Коррозия металлов Классификация моторных масел по стандартам API
Классификация моторных масел по стандартам API Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона Эффект Вавилова — Черенкова
Эффект Вавилова — Черенкова Презентация по Химии "Металлическая связь" - скачать смотреть
Презентация по Химии "Металлическая связь" - скачать смотреть  Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Презентация по Химии "Физические и химические явления" - скачать смотреть
Презентация по Химии "Физические и химические явления" - скачать смотреть  Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Типы изомерии
Типы изомерии Аминокислоты ароматического ряда и их производные
Аминокислоты ароматического ряда и их производные