Содержание
- 2. В 1869 году Д.И.Менделеев обнародовал периоди-ческий закон и его следствие - таблицу элементов. В 1870 году
- 3. "Короткая" форма таблицы, 2000-й год
- 4. Объяснение периодической системы элементов – одна из важнейших задач атомной физики. Сформулируем прежде всего те принципы,
- 5. 2) Принцип Паули: В атоме может существо-вать только один электрон в состоянии, характеризуемом данными значениями четырех
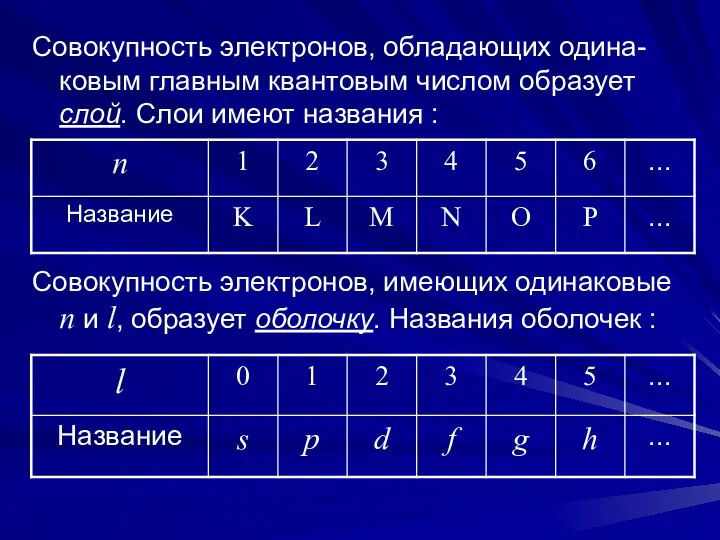
- 6. Совокупность электронов, обладающих одина-ковым главным квантовым числом образует слой. Слои имеют названия : Совокупность электронов, имеющих
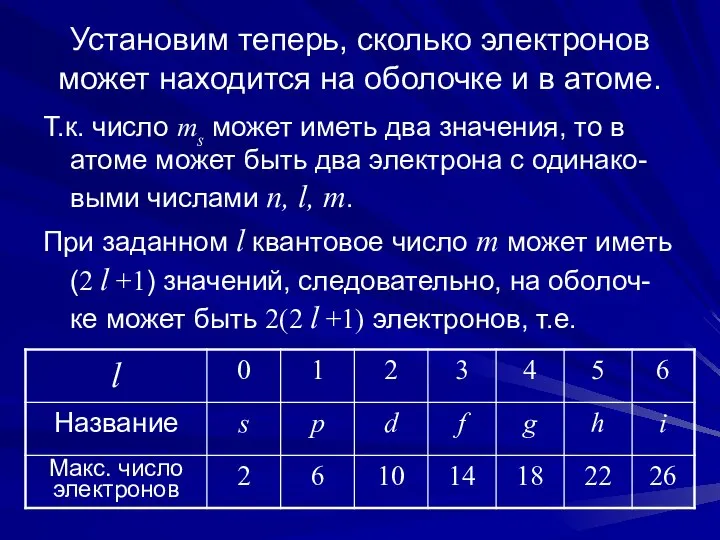
- 7. Принцип Паули ограничивает число электронов на той или иной электронной оболочке. Дейст-вительно, электроны в невозбужденном атоме
- 8. Установим теперь, сколько электронов может находится на оболочке и в атоме. Т.к. число ms может иметь
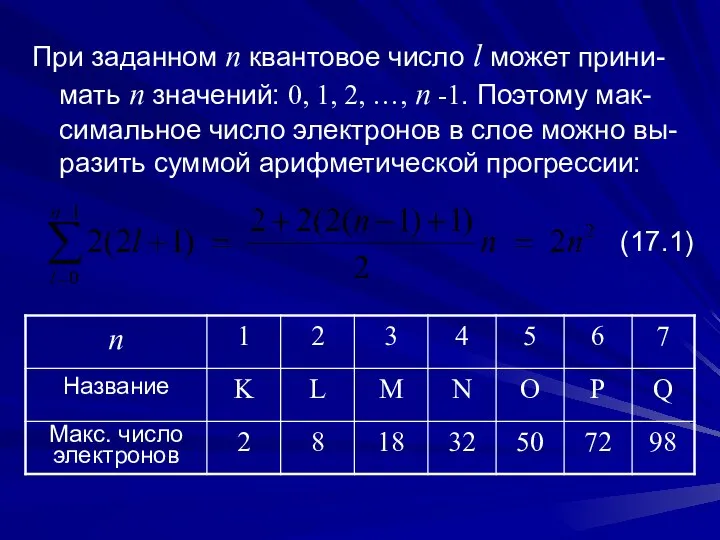
- 9. При заданном n квантовое число l может прини-мать n значений: 0, 1, 2, …, n -1.
- 10. Конфигурация электронных оболочек атомов за-писывается с помощью следующих обозначе-ний. Каждая оболочка обозначается соответст-вующим n и буквой,
- 11. Еще несколько примеров конфигураций электрон-ных оболочек атомов: 19 Калий 1s22s22p63s23p64s1 = [Ar]4s1 20 Кальций [Ar]4s2 36
- 12. Итак, принцип Паули дает следующую картину пост-роения электронной оболочки атомов. Каждый вновь присоединяемый электрон связывается в
- 13. Например, 19-ый электрон калия должен (соглас-но идеальной схеме) находиться в 3d-оболоч-ке. Однако химические и спектроскопические данные
- 14. По этой же причине 20-ый электрон кальция тоже находится в 4s-состоянии, а нормальное заполнение 3d-оболочки начинается
- 15. Таким образом, атомная физика полностью объяс- нила периодическую таблицу элементов. Причем теория не только объяснила, но
- 16. Недостатки короткой формы таблицы Из-за того, что короткая таблица ограничена 8-ю столбцами, приходится подразделять 4-й и
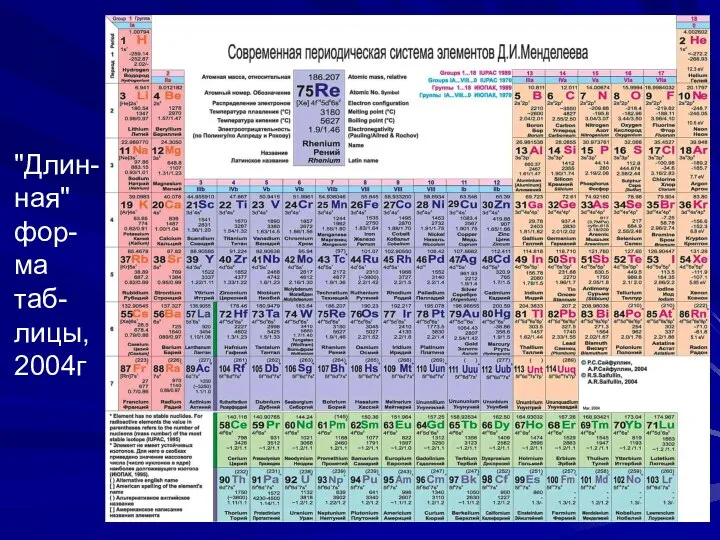
- 17. Длинная форма таблицы В 1989 году Международный союз теоретической и прикладной химии (International Union of Pure
- 18. "Длин-ная" фор-ма таб-лицы, 2004г
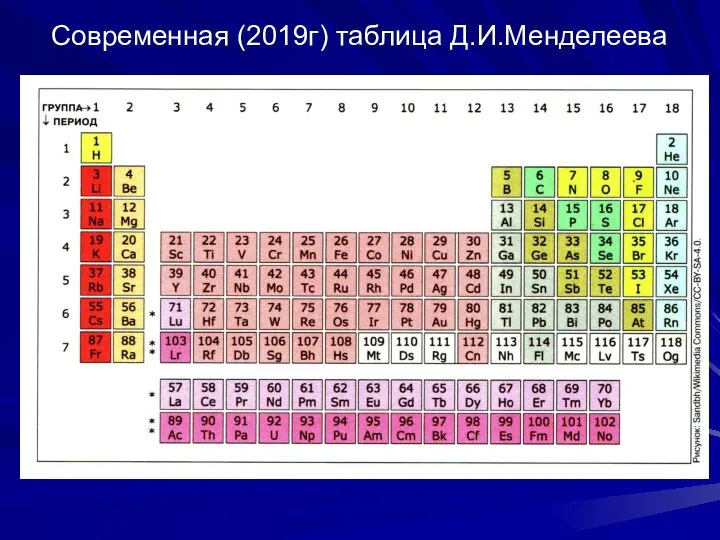
- 19. Современная (2019г) таблица Д.И.Менделеева
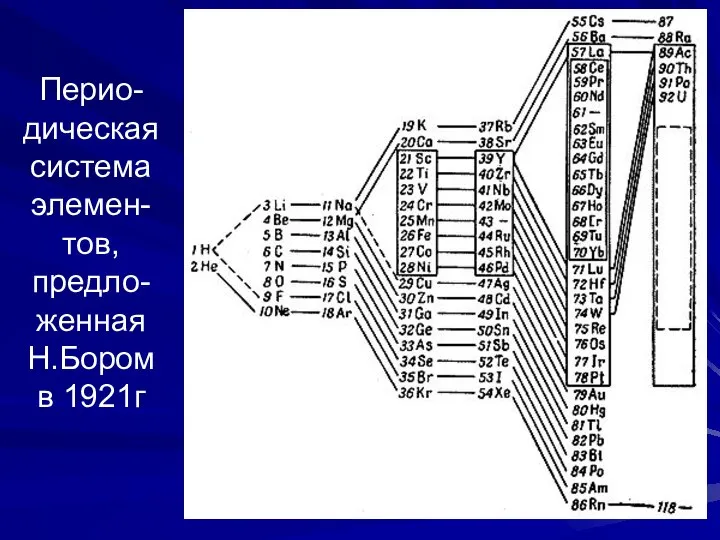
- 20. Перио-дическая система элемен-тов, предло-женная Н.Бором в 1921г
- 22. Скачать презентацию













 Презентация по Химии "Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон" - скачать смотреть
Презентация по Химии "Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон" - скачать смотреть  Вращательная энергия молекул
Вращательная энергия молекул Углеводы
Углеводы Презентация по Химии "Степень окисления. Составление химических формул бинарных соединений" - скачать смотреть
Презентация по Химии "Степень окисления. Составление химических формул бинарных соединений" - скачать смотреть  Вредное воздействие нитратов на организм человека Выполнила: ученица 10 класса «А» Средней школы №1120
Вредное воздействие нитратов на организм человека Выполнила: ученица 10 класса «А» Средней школы №1120  Презентация по Химии "сера" - скачать смотреть
Презентация по Химии "сера" - скачать смотреть  Молочні продукти
Молочні продукти  Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері
Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері Устойчивость дисперсных систем
Устойчивость дисперсных систем Радиогеохимия экзогенных процессов
Радиогеохимия экзогенных процессов Твердофазное восстановление металлов и образование карбидов из хромовых концентратов Аганозерского месторождения
Твердофазное восстановление металлов и образование карбидов из хромовых концентратов Аганозерского месторождения Элементердің құрамына қарай бөлінуі
Элементердің құрамына қарай бөлінуі Индикатор pH
Индикатор pH Классификация магматических пород
Классификация магматических пород Виды горения. Классификация процессов горения
Виды горения. Классификация процессов горения Apa în natură. Resursele de apă
Apa în natură. Resursele de apă Выполнила: ученица 11 класса Э Бахарева Маргарита Руководитель: учитель химии Ефименко О.А.
Выполнила: ученица 11 класса Э Бахарева Маргарита Руководитель: учитель химии Ефименко О.А. Химическая связь. Лекция 2
Химическая связь. Лекция 2 Классификация химических элементов §39
Классификация химических элементов §39 Фенол. Получение и использование, физические и химические свойства. Биологическая роль
Фенол. Получение и использование, физические и химические свойства. Биологическая роль Презентация по Химии "«Углеводы»" - скачать смотреть
Презентация по Химии "«Углеводы»" - скачать смотреть  Сера
Сера Русская живопись 17 века
Русская живопись 17 века  Побочная подгруппа II группы. Цинк, ртуть и их соединения
Побочная подгруппа II группы. Цинк, ртуть и их соединения Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Химическая промышленность
Химическая промышленность Классификация дисперсных систем. Коллигативные свойства растворов. Растворимость газов в воде. Термодинамика
Классификация дисперсных систем. Коллигативные свойства растворов. Растворимость газов в воде. Термодинамика Презентация Воздух, его состав и значение.
Презентация Воздух, его состав и значение.