Классификация дисперсных систем. Коллигативные свойства растворов. Растворимость газов в воде. Термодинамика
Содержание
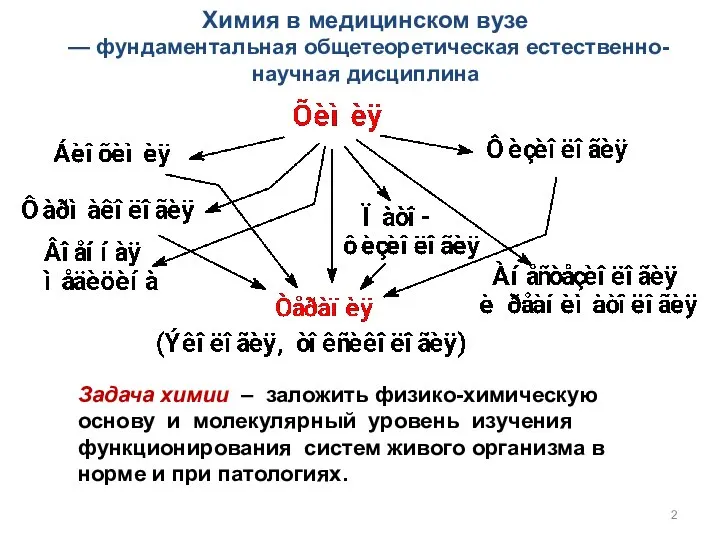
- 2. Химия в медицинском вузе — фундаментальная общетеоретическая естественно-научная дисциплина Задача химии – заложить физико-химическую основу и
- 3. химия РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ им. Н.И.ПИРОГОВА Лекция 1 Классификация дисперсных систем Коллигативные свойства растворов
- 4. 1. Классификация дисперсных систем Дисперсность (раздробленность) — степень измельчения вещества. Дисперсная фаза — часть системы, которая
- 5. Нанодисперсные системы (коллоидные дисперсные системы, ультрамикрогетерогенные системы, золи) — размеры частиц дисперсной фазы от 1 до
- 6. г) По агрегатному состоянию: д) По взаимодействию между дисперсной фазой и дисперсионной средой: Лиофильные (гидрофильные) системы
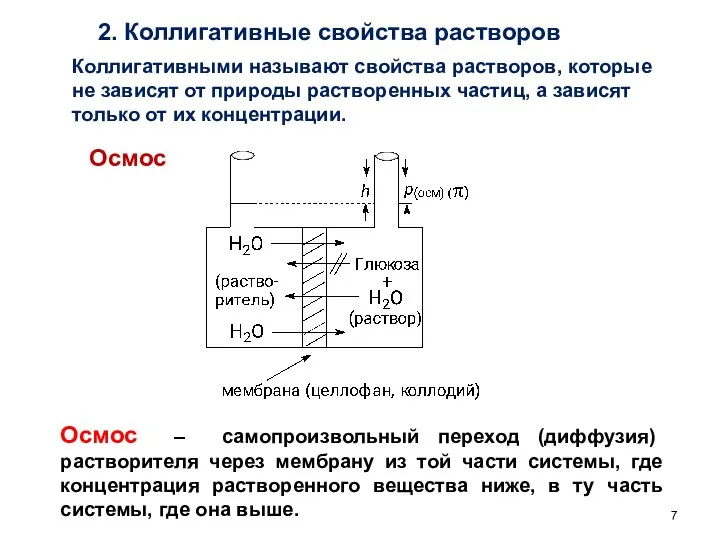
- 7. 2. Коллигативные свойства растворов Коллигативными называют свойства растворов, которые не зависят от природы растворенных частиц, а
- 8. Осмотическое давление раствора (π ) – давление, которое нужно приложить к раствору, чтобы предотвратить проникновение в
- 9. Для раствора, содержащего несколько растворенных веществ: Осмолярность (осмомолярность) — суммарная концентрация кинетически независимых частиц в растворе
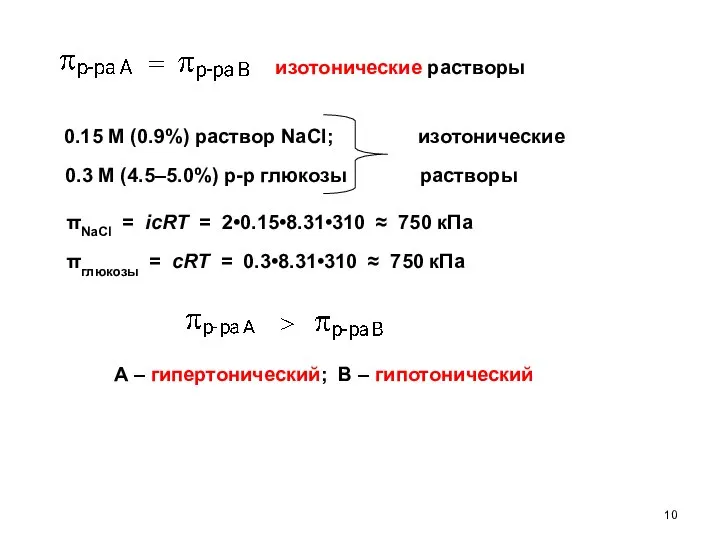
- 10. изотонические растворы 0.15 М (0.9%) раствор NaCl; 0.3 M (4.5–5.0%) р-р глюкозы изотонические растворы πNaCl =
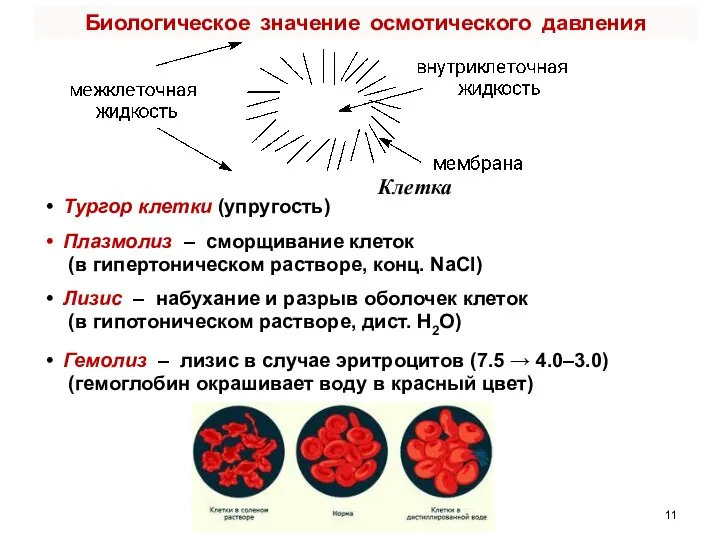
- 11. Клетка Тургор клетки (упругость) Плазмолиз – сморщивание клеток (в гипертоническом растворе, конц. NaCl) Лизис – набухание
- 12. — понижение температуры замерзания растворов по сравнению с чистым растворителем (температура замерзания плазмы крови – 0,55
- 13. 3. Растворимость газов в жидкостях Закон Генри (применим, если отсутствует химическое взаимодействие между газом и растворителем)
- 14. (для раствора газа в растворе электролита) Растворимость газов в жидкостях в присутствии электролитов понижается. c (Х)
- 15. изменение растворимости газов в крови при изменении давления; кессонная болезнь; гипербарическая оксигенация; Биологическое значение законов Генри
- 16. Введение в химическую термодинамику Термодинамика – учение о взаимных переходах различных форм энергии Основные понятия химической
- 17. Изолированная система – система, которая не обменивается со своим окружением ни энергией (теплотой или работой), ни
- 18. Гомогенная система – однородна и не имеет внутри себя поверхностей раздела между частями, отличающимися по физико‑химическим
- 19. Термодинамические параметры (измеряемые величины) подразделяют на: Экстенсивные – прямо пропорциональные количеству вещества системы, т.е. складывающиеся при
- 20. Типы состояния системы: – стационарное (непрерывный обмен веществом и энергией с окружающей средой). Параметры системы не
- 21. Процесс – переход системы из одного состояния в другое, характеризующийся изменением хотя бы одного параметра. Самопроизвольный
- 22. Наиболее важные функции состояния: Внутренняя энергия (U) – общий запас энергии, обусловленный всеми видами движений и
- 23. Энтальпия (Н) – H = U + pV Абсолютное значение энтальпии также определить невозможно. Изменение энтальпии
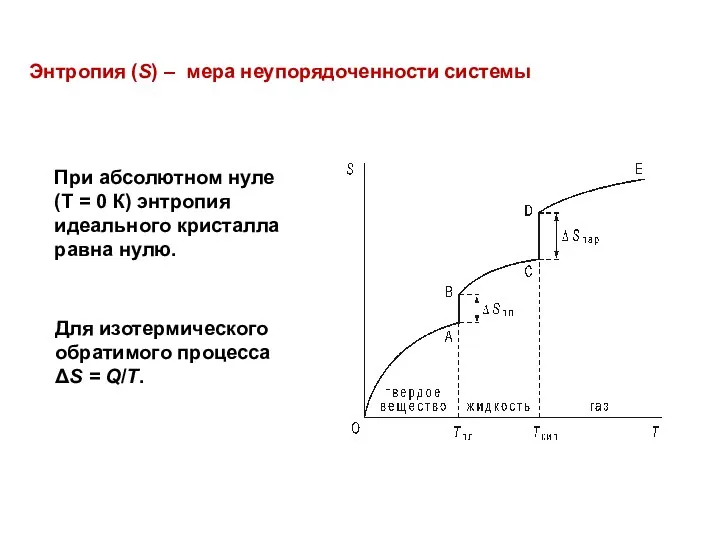
- 24. Энтропия (S) – мера неупорядоченности системы При абсолютном нуле (T = 0 К) энтропия идеального кристалла
- 25. Качественная оценка энтропии С(алмаз) твердое тело При объединении нескольких одинаковых систем их энтропии складываются При объединении
- 26. Энергия Гиббса (свободная энергия) (G) – G = H - TS позволяет судить о возможности самопроизвольного
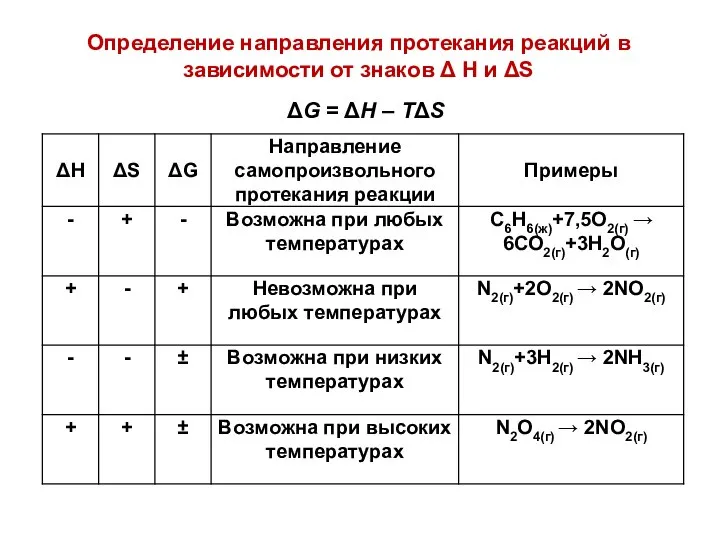
- 27. Определение направления протекания реакций в зависимости от знаков Δ H и ΔS ΔG = ΔH –
- 28. Термодинамические расчеты Стандартные условия: все вещества являются химически чистыми и соответствуют приводимой химической формуле; твердые и
- 29. Таблицы с термодинамическими данными Теплота образования вещества – тепловой эффект реакции образования 1 моль из простых
- 30. ЗАКОН ГЕССА — тепловой эффект реакции зависит только от природы и состояния исходных веществ и конечных
- 31. ΔреакцииH0T = – 2-e следствие: расчет теплового эффекта реакции по теплотам сгорания Ai — исходные вешества,
- 32. Термодинамическое сопряжение — протекание эндэргонической реакции (ΔG > 0) за счет энергии другой (экзэргонической) реакции (ΔG
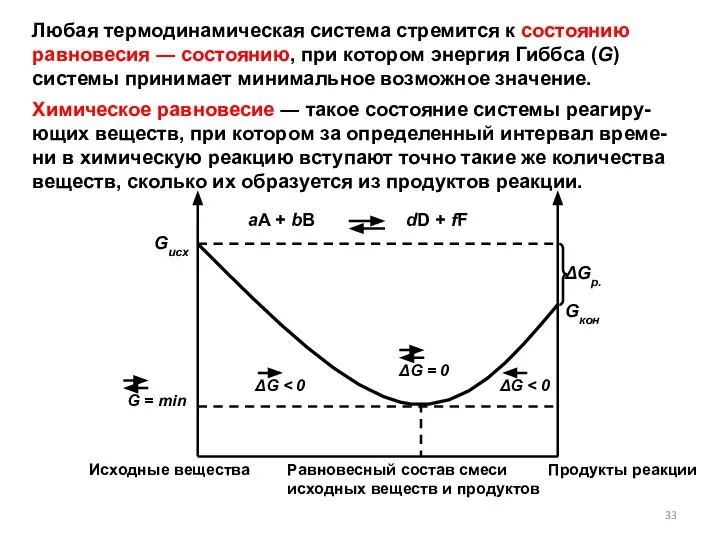
- 33. Любая термодинамическая система стремится к состоянию равновесия ― состоянию, при котором энергия Гиббса (G) системы принимает
- 34. Особенности равновесного состояния 1. Динамический характер: прямая и обратная реакции не прекращаются, а идут с равными
- 35. Константа химического равновесия ― количественная характеристика положения химического равновесия В общем виде для обратимой реакции aA
- 36. Значение константы данного химического равновесия опреде-ляется природой реагирующих веществ, зависит только от тем-пературы и не зависит
- 37. При движении химической системы к равновесию Пс → Кс Качественная оценка направления реакции при заданных концентрациях,
- 38. Уравнение изотермы химической реакции ΔGр-ции = – RT lnКс + RT lnПс или ΔGр-ции = RT
- 40. Скачать презентацию






























 Жири. Жири в природі. Біологічна роль жирів. Жири. Жири в природі. Біологічна роль жирів.
Жири. Жири в природі. Біологічна роль жирів. Жири. Жири в природі. Біологічна роль жирів.  БУДОВА ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ. ЕНЕРГЕТИЧНІ РІВНІ Й ПІДРІВНІ
БУДОВА ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ. ЕНЕРГЕТИЧНІ РІВНІ Й ПІДРІВНІ  Обмен липидов-1
Обмен липидов-1 Гидролиз неорганических веществ - солей
Гидролиз неорганических веществ - солей Презентація на тему “Дмитро Іванович Менделєєв”
Презентація на тему “Дмитро Іванович Менделєєв”  Теории кислот и оснований. Буферные системы крови
Теории кислот и оснований. Буферные системы крови Камни и Рак
Камни и Рак Презентация по Химии "Вода удивительная и удивляющая" - скачать смотреть
Презентация по Химии "Вода удивительная и удивляющая" - скачать смотреть  Алканы. Физические свойства
Алканы. Физические свойства Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Вариации химического состава почек берез дендрария Санкт-Петербургской лесотехнической академии
Вариации химического состава почек берез дендрария Санкт-Петербургской лесотехнической академии Оксокислоти. Номенклатура
Оксокислоти. Номенклатура Расчеты, связанные с понятием доля
Расчеты, связанные с понятием доля Enzymes The classification and nomenclature. Lyases and Transferases
Enzymes The classification and nomenclature. Lyases and Transferases Реакции электрофильного замещения
Реакции электрофильного замещения Капиллярлық құбылыстардың дамуына үлес қосқан ғалымдар
Капиллярлық құбылыстардың дамуына үлес қосқан ғалымдар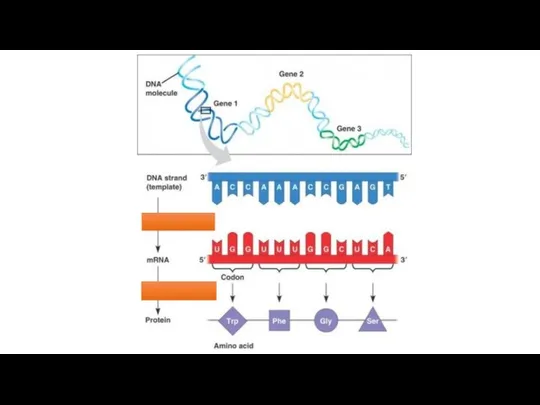 The translation and transcription
The translation and transcription Аммиак. Химические свойства
Аммиак. Химические свойства Общие свойства d-металлов
Общие свойства d-металлов Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Производство серной кислоты H2SO4
Производство серной кислоты H2SO4 “B” (бор) как химический элемент
“B” (бор) как химический элемент Презентация по Химии "Оксиды: получение, свойства, применение" - скачать смотреть
Презентация по Химии "Оксиды: получение, свойства, применение" - скачать смотреть  Кислоты. Состав и классификация кислот. Нахождение кислот в природе
Кислоты. Состав и классификация кислот. Нахождение кислот в природе Кальций
Кальций Регуляция водно-солевого и минерального обмена
Регуляция водно-солевого и минерального обмена Синтез и химические модификации индиго
Синтез и химические модификации индиго Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ