Содержание
- 2. Метод молекулярных орбиталей (ММО) По сравнению с теорией валентных связей метод молекулярных орбиталей является более строгим
- 3. Физическая идея метода: молекула (комплекс) рассматривается как единая система ядер и электронов: каждый отдельный электрон движется
- 4. Ci - постоянные коэффициенты (положительные или отрицательные). N – число атомных орбиталей, участвующих в образовании данной
- 5. Правила построения молекулярных орбиталей: Атомные орбитали, из которых строится молекулярная орбиталь, должны обладать одинаковой симметрией относительно
- 6. Правила заполнения молекулярных орбиталей: Совокупность молекулярных орбиталей молекулы (комплекса) называют электронной конфигурацией молекулы или комплекса. Заполнение
- 7. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Октаэдрические комплексы без π-связывания Рассмотрим простейший случай, когда в комплексе отсутствует π-связывание металл-лиганд,
- 8. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В таблице 1 приведены атомные орбитали центрального атома ψ0 и подходящие к ним
- 9. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Рис. 1. Атомные s-, px-, py-, pz-, dx2-y2- и dz2-орбитали центрального иона октаэдрического
- 10. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Так, в результате комбинирования (сложения и вычитания) s-орбитали центрального атома с подходящей к
- 11. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Орбитали dx2-y2 и dz2перекрываются с групповыми орбиталями ГО(5) и ГО(6) соответственно и образуют
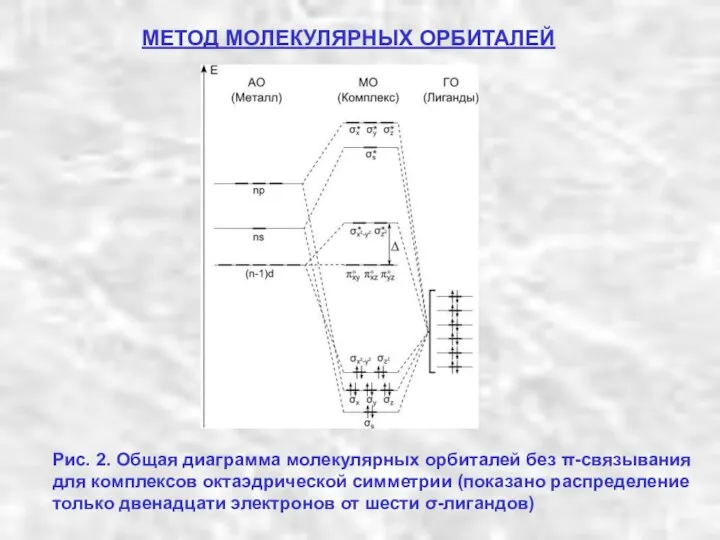
- 12. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Рис. 2. Общая диаграмма молекулярных орбиталей без π-связывания для комплексов октаэдрической симметрии (показано
- 13. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Из диаграммы молекулярных орбиталей октаэдрического комплекса в σ-приближении, приведенной на рис. 2, видно,
- 14. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Спектрохимический ряд лигандов. В этой последовательности слева направо возрастает сила поля лигандов. Иными
- 15. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Обычно вместо полной диаграммы молекулярных орбиталей октаэдрического комплекса, показанной на рисунке 2, используют
- 16. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Распределение электронов на диаграмме МО октаэдрического комплекса, как и в молекулах, осуществляется по
- 17. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Распределение электронов на диаграмме МО октаэдрического комплекса c электронной конфигурацией центрального иона d4
- 18. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Распределение электронов на диаграмме МО октаэдрического комплекса c электронной конфигурацией центрального иона d4
- 19. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Рассмотрим два комплекса [CoF6]3- и [CoF6]3+ . Из справочной таблицы находим: P(Co3+) =
- 20. ОКРАСКА КОМПЛЕКСОВ d-ЭЛЕМЕНТОВ МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Многие комплексы в водных растворах окрашены. Примеры окраски аквакомплексов приведены
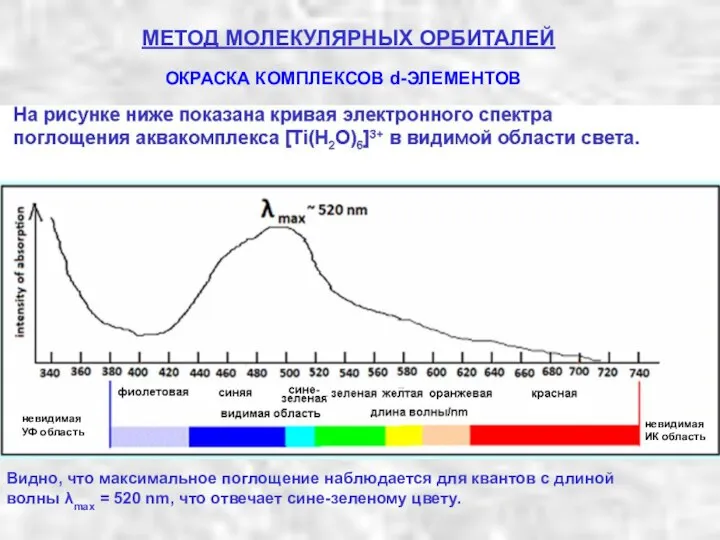
- 21. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Рассмотрим простейший случай иона с одним d-электроном, например [Ti(H2O)6]3+ . Под действием квантов
- 22. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ ОКРАСКА КОМПЛЕКСОВ d-ЭЛЕМЕНТОВ невидимая УФ область невидимая ИК область Видно, что максимальное поглощение
- 23. Часть белого света в диапазоне от ~ 400 нм до ~ 750 нм составляет видимую область
- 24. Белый свет состоит из семи основных цветов радуги: красный, оранжевый, желтый, зеленый, голубой, синий, фиолетовый. Разложение
- 25. Почему раствор сульфата меди имеет голубую окраску ? К поглощаемому красному цвету дополнительным является голубой цвет,
- 26. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ ОКРАСКА КОМПЛЕКСОВ d-ЭЛЕМЕНТОВ По длине волны поглощаемого света можно определить наблюдаемый цвет (см.
- 27. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В случае аквакомплекса [Ti(H2O)6]3+, электронный спектр поглощения которого имеет максимум около 520 нм,
- 28. Окраска комплексов зависит от величины расщепления Δ или . По величине Δ лиганды располагают в спектрохимический
- 29. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ ОКРАСКА КОМПЛЕКСОВ d-ЭЛЕМЕНТОВ Задание: объясните изменение окраски водных растворов шестикоординированных комплексов Ni(II) исходя
- 31. Скачать презентацию
















![МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Рассмотрим два комплекса [CoF6]3- и [CoF6]3+ . Из](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/701651/slide-18.jpg)






![МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В случае аквакомплекса [Ti(H2O)6]3+, электронный спектр поглощения которого](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/701651/slide-26.jpg)


 Липиды 2. Тканевой обмен
Липиды 2. Тканевой обмен Азотная кислота
Азотная кислота Презентация Термодинамические характеристики поверхности в однокомпонентных системах
Презентация Термодинамические характеристики поверхности в однокомпонентных системах  Презентация по Химии "Застосування оцтової кислоти, її згубна дія." - скачать смотреть бесплатно
Презентация по Химии "Застосування оцтової кислоти, її згубна дія." - скачать смотреть бесплатно Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер
Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер Хромопротеиды. Патология пигментного обмена. Взаимосвязь обменов
Хромопротеиды. Патология пигментного обмена. Взаимосвязь обменов Обобщение темы Строение атома и вещества
Обобщение темы Строение атома и вещества Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Тема: «Йод в организме человека . Использование его в медицине» Выполнила: Роппельд В.
Тема: «Йод в организме человека . Использование его в медицине» Выполнила: Роппельд В.  Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) Гормоны и адаптация. (Лекция 15)
Гормоны и адаптация. (Лекция 15) Розрахунок електронної структури та фізичних властивостей певних структур на основі методів квантової хімії
Розрахунок електронної структури та фізичних властивостей певних структур на основі методів квантової хімії Обмен жиров в организме
Обмен жиров в организме ЙОД ( I ) Презентація Учениці 10-В Сухарської Ольги
ЙОД ( I ) Презентація Учениці 10-В Сухарської Ольги  Полимеры органические, неорганические
Полимеры органические, неорганические Закономерности изменения металлических и неметаллических свойств элементов в периодах и группах (8 класс)
Закономерности изменения металлических и неметаллических свойств элементов в периодах и группах (8 класс) Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок Липиды. Строение, свойства, функции. (Лекция 6)
Липиды. Строение, свойства, функции. (Лекция 6) Медьсодержащие соединения
Медьсодержащие соединения КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ
КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ  Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Применение центрифугирования
Применение центрифугирования Evolution of Isoconversional Methods
Evolution of Isoconversional Methods Силикаты ленточного строения
Силикаты ленточного строения Углеводы
Углеводы Качественные реакции (часть 5)
Качественные реакции (часть 5) Ионное уравнения
Ионное уравнения