Содержание
- 2. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Теории растворов: Физическая теория Суть: процесс растворения рассматривается как процесс равномерного распределения частиц
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Теории растворов: 3. Физико-химическая теория Суть: Процесс растворения можно рассматривать как сложный физико-хими-
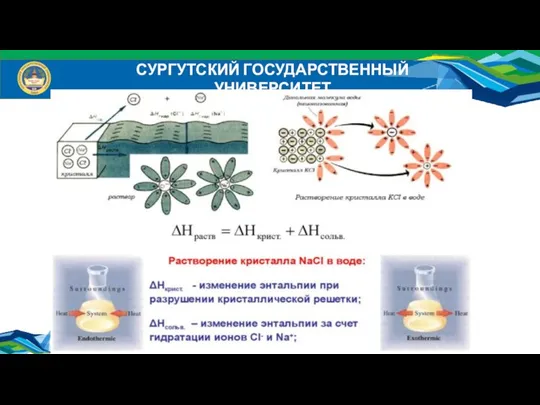
- 4. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Растворы – это гомогенные системы переменного состава, находящиеся в состоянии химического равновесия. Растворы
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Классификации растворов по различным признакам По агрегатному состоянию: 1. Растворы газов в газах
- 6. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Классификации растворов По количеству растворенного вещества: Ненасыщенный – это раствор, в котором еще
- 7. Растворимость компонентов СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 4. Разбавленный – это раствор с низким содержанием растворенного вещества. Отметим, что не
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 11. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Взаимная растворимость жидкостей В зависимости от природы жидкости могут смешиваться друг с другом
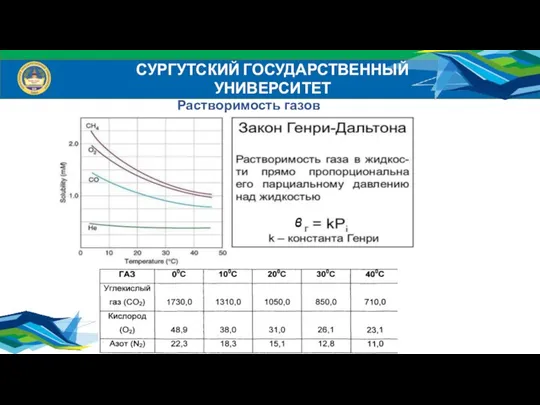
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Растворимость газов
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Истинная масса атомов очень мала, например, масса изотопа атома углерода 12 (С12) составляет
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Моль – это количество вещества (n), содержащее столько структурных единиц (атомов, молекул, ионов,
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Масса одного моля вещества, содержащего 6,02·1023 частиц, называется молярной массой размерностью г/моль. Она
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Концентрация – это масса или количество растворенного вещества в единице массы или объема
- 17. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Массовая доля (ω) – отношение массы растворенного вещества (г), содержащегося в растворе, к
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Мольная доля (χ, хи) – это количество растворенного вещества (nв) или растворителя (ns)
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Молярная концентрация или молярность – это количество молей растворенного вещества в единице объема
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Молярная концентрация эквивалента или эквивалентная концентрация, или нормальность – это отношение количества эквивалентов
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Моляльная концентрация или моляльность – это количество растворенного вещества в единице массы растворителя.
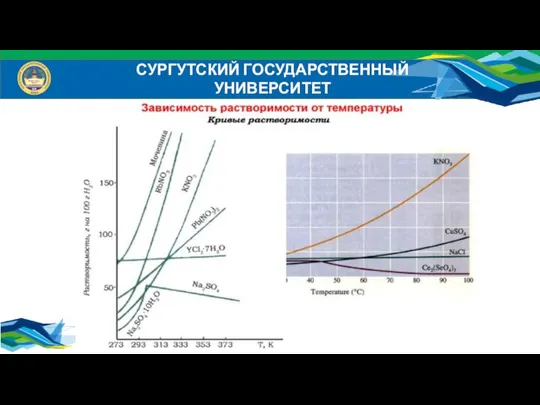
- 22. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Растворимость (коэффициент растворимости) (в) – это масса растворенного вещества в 100 г растворителя
- 23. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Коллигативные свойства растворов - это свойства не зависящие от природы растворенного вещества, а
- 24. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Зависимость осмотического давления от объема раствора, количества растворенного вещества и температуры выражается законом
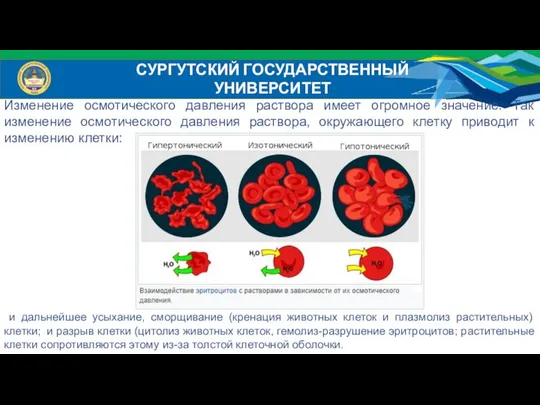
- 25. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Изменение осмотического давления раствора имеет огромное значение. Так изменение осмотического давления раствора, окружающего
- 26. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Понижение давления пара растворителя над раствором
- 27. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Понижение температуры замерзания и повышение температуры кипения растворов Δtкип=tкип р-ра – tкип р-ля;
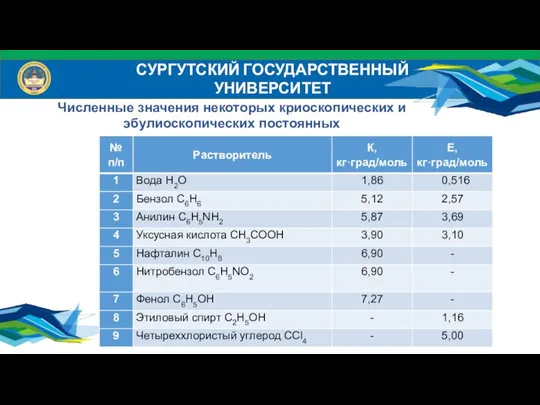
- 28. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Численные значения некоторых криоскопических и эбулиоскопических постоянных
- 29. Теория электролитической ионизации Аррениуса При растворении солей, кислот и оснований вводе происходит диссоциация этих веществ с
- 30. Степень ионизации – это отношение числа ионизированных частиц к общему числу растворенных частиц, которая выражается в
- 31. Другая количественная характеристика электролитической ионизации является константа ионизации: которая зависит от природы электролита и температуры. Чем
- 32. Для слабых электролитов: Из выражения следует, что если разбавить раствор в 100 раз, то степень ионизации
- 33. Представление об образовании ионных пар были введены Бьёррумом и Семенченко. Суть концепции: для каждого растворителя свой
- 34. Например: рассчитать параметр Бьёррума для однозарядного иона в воде при 25 ºС (298 К) Если расстояние
- 35. Очевидно, что для растворов электролитов ; для растворов неэлектролитов . Изотонический коэффициент можно связать со степенью
- 36. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Осмотическое давление раствора электролита Относительное понижение давления насыщенного пара над раствором:
- 37. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Понижение температуры замерзания и повышение температуры кипения растворов электролитов Δtкип=tкип р-ра – tкип
- 39. Скачать презентацию































 Презентация по Химии "Белирий, магний и щелочноземельные металлы" - скачать смотреть
Презентация по Химии "Белирий, магний и щелочноземельные металлы" - скачать смотреть  Жанн Антуан Ватто
Жанн Антуан Ватто  Vodík
Vodík Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Дизельное топливо
Дизельное топливо ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 1 полугодие 8 класс Л.И.Настина, учитель химии
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 1 полугодие 8 класс Л.И.Настина, учитель химии  Элементарный состав живых организмов
Элементарный состав живых организмов Презентация по Химии "Серная кислота" - скачать смотреть бесплатно
Презентация по Химии "Серная кислота" - скачать смотреть бесплатно Нефть и способы ее переработки
Нефть и способы ее переработки Создание оптимального теплового режима в реакторах
Создание оптимального теплового режима в реакторах Метод инверсионной вольтамперометрии
Метод инверсионной вольтамперометрии Менделеевский период
Менделеевский период Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Химические процессы
Химические процессы Класифікація органічних сполук за будовою вуглецевого скелету та природою функціональних груп
Класифікація органічних сполук за будовою вуглецевого скелету та природою функціональних груп Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Сероводород и сульфиды
Сероводород и сульфиды Продолжи предложение Диссимиляция-…
Продолжи предложение Диссимиляция-… Производные пурина
Производные пурина Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Витамины. Общая характеристика. Классификация. Витамины алифатического строения. Витамин С
Витамины. Общая характеристика. Классификация. Витамины алифатического строения. Витамин С Аттестационная работа. Программа элективного курса по химии экологическая химия
Аттестационная работа. Программа элективного курса по химии экологическая химия Химия и живопись
Химия и живопись Рубин и сапфир. Изумруд и аквамарин. Кварц
Рубин и сапфир. Изумруд и аквамарин. Кварц Химическая связь
Химическая связь Свойства серной кислоты и солей
Свойства серной кислоты и солей Ферум /Залізо
Ферум /Залізо