Теория растворов. Механизм растворения газов, жидкостей и твердых тел. Способы выражения концентраций растворов
Содержание
- 2. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 4. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
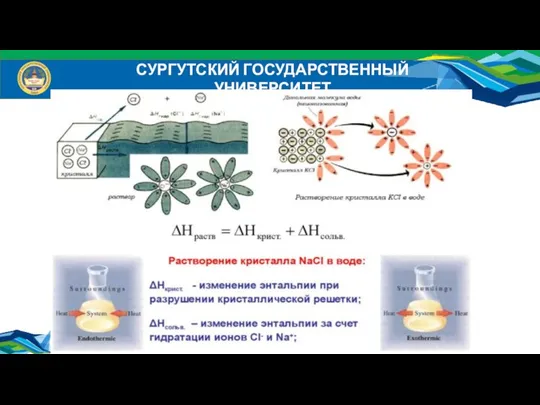
- 6. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 7. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
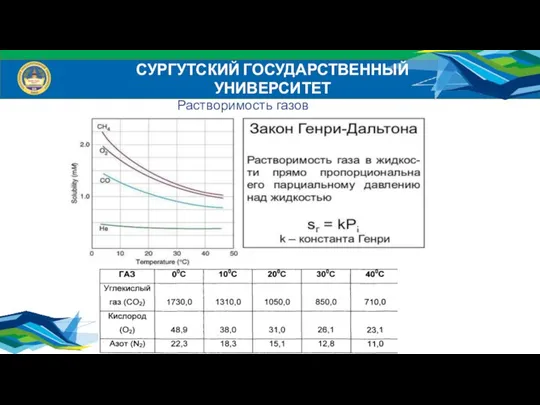
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Растворимость газов
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Истинная масса атомов очень мала, например, масса изотопа атома углерода 12 (С12) составляет
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Моль – это количество вещества (n), содержащее столько структурных единиц (атомов, молекул, ионов,
- 11. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Масса одного моля вещества, содержащего 6,02·1023 частиц, называется молярной массой размерностью г/моль. Она
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Концентрация – это масса или количество растворенного вещества в единице массы или объема
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Массовая доля (ω) – отношение массы растворенного вещества (г), содержащегося в растворе, к
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 17. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
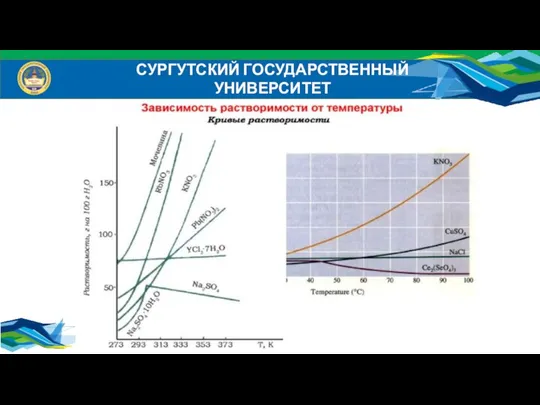
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Растворимость (коэффициент растворимости) в – это масса растворенного вещества в 100 г растворителя
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Коллигативные свойства растворов - это свойства не зависящие от природы растворенного вещества, а
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Понижение температуры замерзания и повышение температуры кипения растворов Δtкип=tкип р-ра – tкип р-ля;
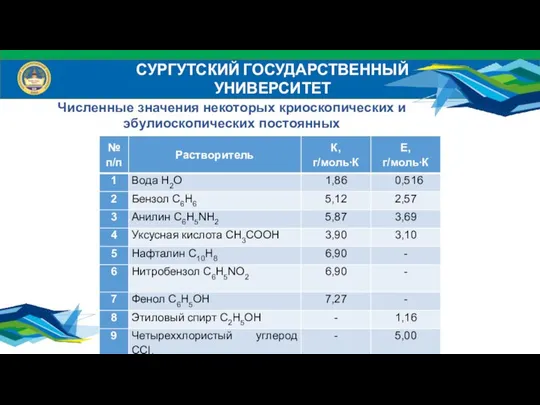
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Численные значения некоторых криоскопических и эбулиоскопических постоянных
- 22. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Осмотическое давление раствора Осмотическое давление (Росм) прямо пропорционально молярной концентрации раствора (СВ) и
- 24. Скачать презентацию

















 Выполнение упражнений по теме Галогены
Выполнение упражнений по теме Галогены Интегрированный урок «История+Химия»
Интегрированный урок «История+Химия» Аттестационная работа. Образовательная программа кружка «Химия и жизнь»
Аттестационная работа. Образовательная программа кружка «Химия и жизнь» «Основные соединения серы»
«Основные соединения серы» Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Технология поликристаллического кремния. Его применение
Технология поликристаллического кремния. Его применение Органическая химия. Установочная лекция
Органическая химия. Установочная лекция Геохимия редкоземельных элементов
Геохимия редкоземельных элементов Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Синтетическое масло
Синтетическое масло Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2)
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2) Платина (исп. Platina)
Платина (исп. Platina) Химия, как наука. Основные понятия и законы
Химия, как наука. Основные понятия и законы Кристалы и их свойства
Кристалы и их свойства Химические свойства и получение алканов
Химические свойства и получение алканов Минералы. Лекция 02
Минералы. Лекция 02 Читаем формулы, определяем класс неорганических веществ. Называем вещества
Читаем формулы, определяем класс неорганических веществ. Называем вещества Органическая химия
Органическая химия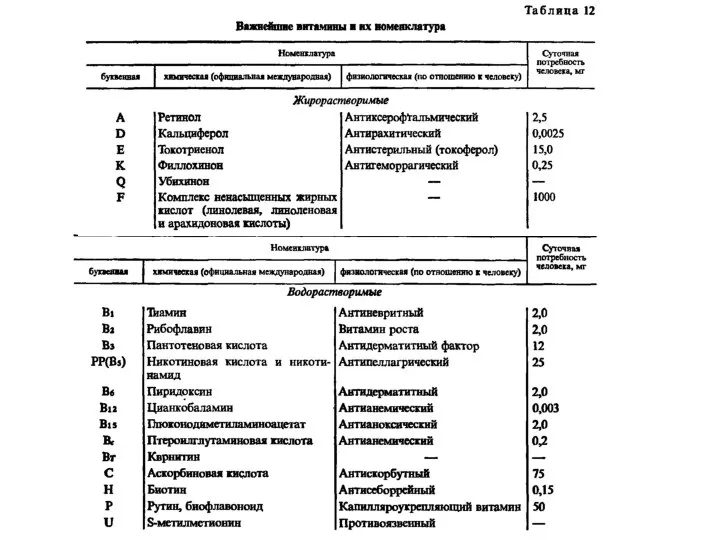 Важнейшие витамины и их номенклатура
Важнейшие витамины и их номенклатура Теория растворов (лекция 1)
Теория растворов (лекция 1) Основні принципи мас-спектрометрії
Основні принципи мас-спектрометрії Спирты и их влияние на здоровье человека
Спирты и их влияние на здоровье человека МИР МЫЛА Выполнили: Ученица 9 «В» кл. Селиванова С. Ученица 9 «В» кл. Кайрова М.
МИР МЫЛА Выполнили: Ученица 9 «В» кл. Селиванова С. Ученица 9 «В» кл. Кайрова М. Получение фосфорной кислоты
Получение фосфорной кислоты Хімічні добавки. Е-числа Підготували учні 7-В(г) класу Лучечко Анна Ванівська Галина Вчитель: Глуховецька Оксана Вікторівна
Хімічні добавки. Е-числа Підготували учні 7-В(г) класу Лучечко Анна Ванівська Галина Вчитель: Глуховецька Оксана Вікторівна  Перетворення карбонатів та гідрокарбонатів у природі,утворення сталактитів і сталагмітів. Кальцій карбонат у складі черепашо
Перетворення карбонатів та гідрокарбонатів у природі,утворення сталактитів і сталагмітів. Кальцій карбонат у складі черепашо Предмет органической химии. Основные понятия. Лекция 1
Предмет органической химии. Основные понятия. Лекция 1 Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.
Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.