Содержание
- 2. Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых
- 3. Назад
- 4. Гомологический ряд – ряд веществ, расположеных в пордке возрастания молекулярной массы, имеющих сходно строение, свойства и
- 5. Предмет органической химии Органическая химия — химия соединений углерода. Элементы С, Н, О, N (S, галогены)
- 6. Причины выделения органической химии в отдельную науку 1. Четырехвалентность атома углерода метан этилен ацетилен формальдегид
- 7. Причины выделения органической химии в отдельную науку 2. Способность образовывать длинные цепи и кольца (т.н. циклы)
- 8. Причины выделения органической химии в отдельную науку 2. Способность образовывать длинные цепи и кольца (т.н. циклы)
- 9. Причины выделения органической химии в отдельную науку 2. Способность образовывать длинные цепи и кольца (т.н. циклы)
- 10. Причины выделения органической химии в отдельную науку 3. Способность образовывать устойчивые или очень устойчивые связи с
- 11. Причины выделения органической химии в отдельную науку 3. Способность образовывать устойчивые или очень устойчивые связи с
- 12. Причины выделения органической химии в отдельную науку 4. Из всех элементов периодической системы именно углерод играет
- 13. Особенности органических соединений
- 14. Источники органических соединений
- 15. Предельные углеводороды. Алканы
- 16. Алифатические углеводороды
- 17. Алканы Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой
- 18. Алканы метан
- 19. Алканы
- 20. Электронная структура атома углерода в органических соединениях основное состояние возбужденное состояние
- 21. Электронная структура атома углерода в органических соединениях
- 22. Алканы Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг от друга по количеству
- 23. Алканы. Номенклатура. Названия нормальных алканов по заместительной номенклатуре
- 24. Алканы. Номенклатура 2,2,4-триметилпентан Первичный Вторичный Третичный Четвертичный
- 25. Алканы. Номенклатура
- 26. Алканы. Номенклатура 1) определяют самую длинную цепь атомов углерода. Число атомов углерода в этой цепи служит
- 27. Алканы. Номенклатура 4) при наличии двух и более заместителей нумерацию цепи производят так, чтобы заместители получили
- 28. Алканы. Номенклатура 3,5-диметил-3-этилоктан
- 29. Алканы. Номенклатура 2,3,4-триметилпентан
- 30. Алканы. Изомерия Изомеры — это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение, а
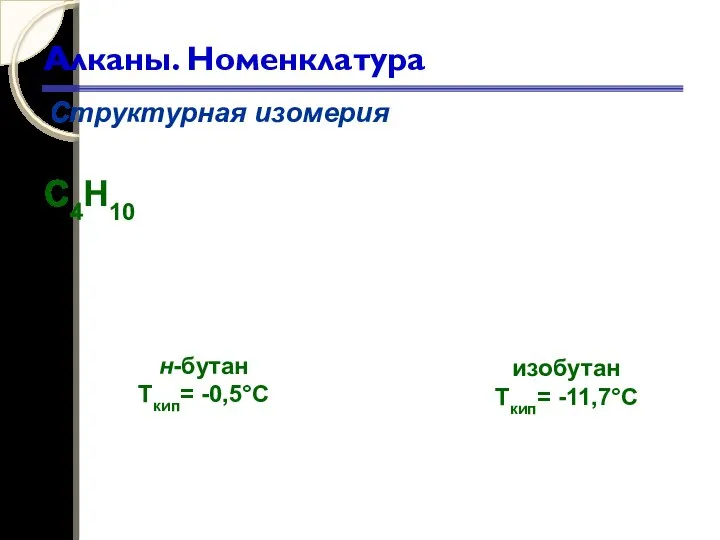
- 31. Алканы. Номенклатура Структурная изомерия С4Н10 н-бутан Ткип= -0,5°С изобутан Ткип= -11,7°С
- 32. Алканы. Номенклатура Структурная изомерия С5Н12 пентан Ткип= 36.2°С 2-метилбутан Ткип= 28°С 2,2-диметилпропан Ткип= 9.5°С
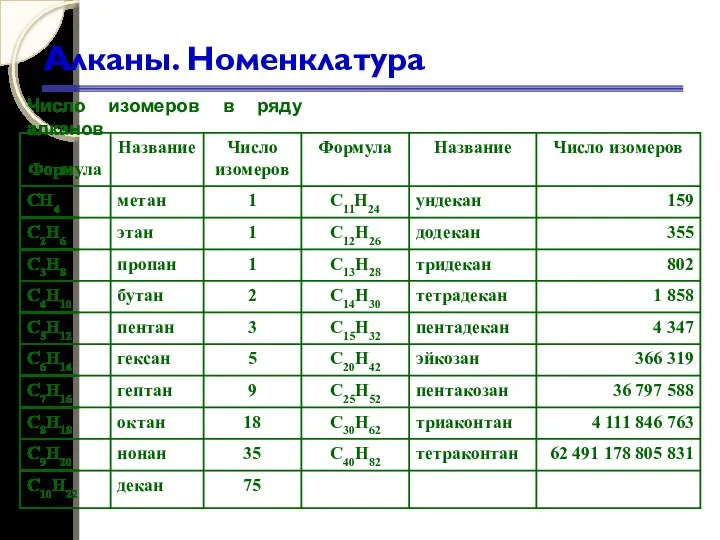
- 33. Алканы. Номенклатура Число изомеров в ряду алканов
- 34. Алканы. Природные источники
- 35. Алканы. Химические свойства Галогенирование
- 36. Алканы. Химические свойства Галогенирование (Механизм реакции) Обрыв цепи
- 37. Алканы. Химические свойства Галогенирование (Механизм реакции) 4. Реакционная способность водорода у третичного атома углерода выше, чем
- 38. Алканы. Химические свойства Галогенирование (Механизм реакции)
- 39. Алканы. Химические свойства Окисление CH4 + H2O → CO + 3H2 CH4 + ½O2 → CO
- 40. Алканы. Химические свойства Изомеризация
- 41. НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ
- 42. Классификация
- 43. Гибридизация
- 44. Строение кумулированный пропадиен (аллен) сопряженный бутадиен-1,3 (дивинил) изолированный пентадиен-1,4
- 45. Строение Сопряжение — это образование единого электронного облака в результате взаимодействия негибридизованных pz-орбиталей в молекуле с
- 46. Строение Делокализация электронной плотности — это ее распределение по всей сопряженной системе, по всем связям и
- 47. Строение
- 48. Строение
- 49. Строение
- 50. Реакции алкенов, алкинов и сопряженных диенов с раскрытием π-связи Присоединение молекул типа H-X МАРКОВНИКОВ Владимир Васильевич
- 51. Реакции алкенов, алкинов и сопряженных диенов с раскрытием π-связи Присоединение молекул типа H-X
- 52. Реакции алкенов, алкинов и сопряженных диенов с раскрытием π-связи Присоединение молекул типа H-X
- 53. Реакции гидрирования и окисления алкенов и алкинов
- 54. Реакции полимеризации ненасыщенных углеводородов
- 55. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
- 56. Арены Ароматические соединения, или арены, — большая группа соединений карбоциклического ряда, молекулы которых содержат устойчивую циклическую
- 57. Арены Строение молекулы бензола 6 электронов в делокализованной π связи
- 58. Арены Строение молекулы бензола
- 59. Арены Химические свойства. Реакции замещения Алкилирование Алкилирование — введение алкильной группы в молекулу органического соединения (например,
- 60. Арены Химические свойства. Реакции замещения Алкилирование
- 61. Арены Химические свойства. Реакции замещения
- 62. Арены Химические свойства. Реакции замещения Эффекты заместителей при электрофильном замещении 1. Заместители (ориентанты) первого рода: —ОН,
- 63. Арены Химические свойства. Реакции замещения Эффекты заместителей при электрофильном замещении 2. Заместители (ориентанты) второго рода: —CN,
- 64. Арены Химические свойства. Реакции замещения Эффекты заместителей при электрофильном замещении фенол
- 65. Арены Химические свойства. Реакции замещения Эффекты заместителей при электрофильном замещении толуол
- 66. Арены Химические свойства. Реакции замещения Эффекты заместителей при электрофильном замещении хлорбензол
- 67. Арены Химические свойства. Реакции замещения Эффекты заместителей при электрофильном замещении нитробензол
- 68. Арены Химические свойства. Реакции замещения Эффекты заместителей при электрофильном замещении бензальдегид
- 69. Арены Химические свойства. Реакции замещения Влияние заместителей на реакционную способность
- 70. Арены Химические свойства. Реакции присоединения
- 71. Арены Химические свойства. Реакции присоединения
- 72. Арены Химические свойства. Окисление
- 73. Арены Химические свойства. Окисление
- 74. Арены Химические свойства. Окисление
- 75. Арены Многоядерные ароматические соединения Ароматические соединения, содержащие в своих молекулах несколько бензольных ядер, называют многоядерными. Соединения
- 76. Арены Многоядерные ароматические соединения Соединения с неконденсированными бензольными ядрами
- 77. Арены Многоядерные ароматические соединения Соединения с неконденсированными бензольными ядрами дифенилметан
- 78. Арены Многоядерные ароматические соединения Соединения с неконденсированными бензольными ядрами бензофенон
- 79. Арены Многоядерные ароматические соединения Соединения с неконденсированными бензольными ядрами Трифенилметан
- 80. Арены Многоядерные ароматические соединения Соединения с конденсированными бензольными ядрами нафталин
- 81. Арены Многоядерные ароматические соединения Соединения с конденсированными бензольными ядрами
- 82. Арены Многоядерные ароматические соединения Соединения с конденсированными бензольными ядрами а) Ангулярно конденсированные циклы: перилен коронен
- 83. Арены Многоядерные ароматические соединения Соединения с конденсированными бензольными ядрами а) Ангулярно конденсированные циклы:
- 84. КАРБОНИЛСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
- 85. Карбонилсодержащие соединения Органические соединения, в молекуле которых имеется карбонильная группа С=O, называются карбонильными соединениями, или оксосоединениями.
- 86. Карбонилсодержащие соединения. Классификация
- 87. Карбонилсодержащие соединения. Номенклатура и изомерия метаналь (формальдегид) этаналь (ацетальдегид) пропаналь (пропионовый альдегид)
- 88. Карбонилсодержащие соединения. Номенклатура и изомерия 2-хлорциклогексан карбальдегид бензальдегид 3-бромбензальдегид Может ли атом углерода кетонной группы получить
- 89. Карбонилсодержащие соединения. Номенклатура и изомерия бутанон метилэтилкетон пропанон, диметилкетон (ацетон)
- 90. Карбонилсодержащие соединения. Номенклатура и изомерия дифенилкетон (бензофенон) пропилфенилкетон
- 91. Карбонилсодержащие соединения. Химические свойства
- 92. Карбонилсодержащие соединения. Химические свойства Реакции нуклеофильного присоединения
- 93. Карбонилсодержащие соединения. Химические свойства Взаимодействие со спиртами
- 94. Карбонилсодержащие соединения. Химические свойства Кето-енольная таутомерия Процесс в котором осуществляется переход кетоформы в енольную, называется енолизацией.
- 95. Изомерия – явление существования разных веществ с одинаковым качественным и количественным составом, но имеющих разное строение
- 96. Нарисовать и назвать по другой номенклатуре: винилбензол, бензилхлорид, трифенилметан, дипропиламин, дифениламин, бутаналь, бензальдегид, бутанон-2, метилэтилкетон, вторичный
- 98. Скачать презентацию




























































































 Классификация карбоновых кислот. (Лекция 12)
Классификация карбоновых кислот. (Лекция 12) Гормоны. Фенилэтиламин
Гормоны. Фенилэтиламин Химия в кастрюле
Химия в кастрюле Жёсткость воды
Жёсткость воды α-Аминокислоты. Белки
α-Аминокислоты. Белки Аттестационная работа. Программа кружка по химии «Юный химик»
Аттестационная работа. Программа кружка по химии «Юный химик» L-3-Biomolecules (1) (1) (1)
L-3-Biomolecules (1) (1) (1) Союз химии и медицины
Союз химии и медицины Химия элементов VI группы главной подгруппы. Сера и ее соединения
Химия элементов VI группы главной подгруппы. Сера и ее соединения Аминокислоты. Классификация. Реакционная способность
Аминокислоты. Классификация. Реакционная способность Соли азотной кислоты, применение Девиз урока «Au, Na, Ar, Ne, It, Eu – Os, Ra,U, Db, In, Er, As Ni, Es C, Eu La Ь» Л. Н. Толстой
Соли азотной кислоты, применение Девиз урока «Au, Na, Ar, Ne, It, Eu – Os, Ra,U, Db, In, Er, As Ni, Es C, Eu La Ь» Л. Н. Толстой Углероды: их роль и значение в жизни человека
Углероды: их роль и значение в жизни человека Презентация по Химии "Алкины. Ацетилен" - скачать смотреть
Презентация по Химии "Алкины. Ацетилен" - скачать смотреть  Периодическая таблица Д.И. Менделеева Элемент № 24 ХРОМ
Периодическая таблица Д.И. Менделеева Элемент № 24 ХРОМ Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Химия p-элементов (лекция 12)
Химия p-элементов (лекция 12) Чугуны. Структура и свойства. Классификация и применение
Чугуны. Структура и свойства. Классификация и применение Обменные реакции в растворах электролитов
Обменные реакции в растворах электролитов Ионная связь
Ионная связь Продолжение лекции «Химическая связь»
Продолжение лекции «Химическая связь» Обмен веществ и энергии
Обмен веществ и энергии Нефть и способы ее переработки
Нефть и способы ее переработки Презентация по химии ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Презентация по химии ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Производные карбоновых кислот
Производные карбоновых кислот Спирты: свойства, получение, применение
Спирты: свойства, получение, применение Закономерности протекания химических процессов
Закономерности протекания химических процессов Минералы. Свойства минералов
Минералы. Свойства минералов