Содержание
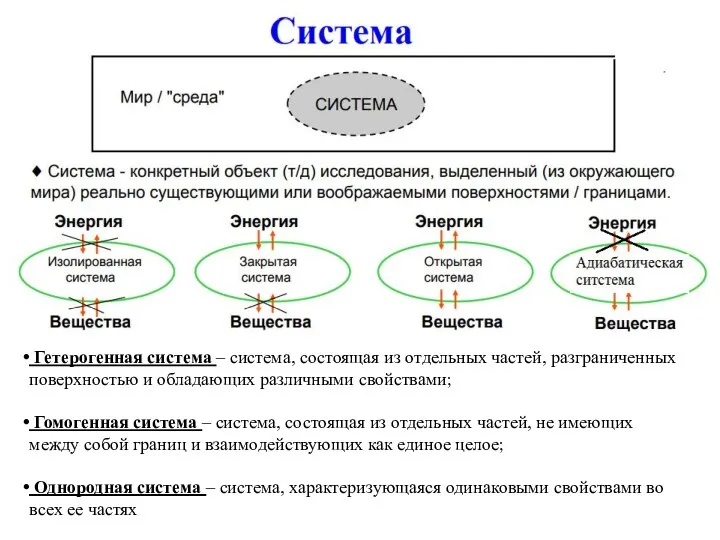
- 2. Гетерогенная система – система, состоящая из отдельных частей, разграниченных поверхностью и обладающих различными свойствами; Гомогенная система
- 3. Фаза – часть гетерогенной системы, разграниченная от других частей поверхностью раздела и имеющая во всех точках
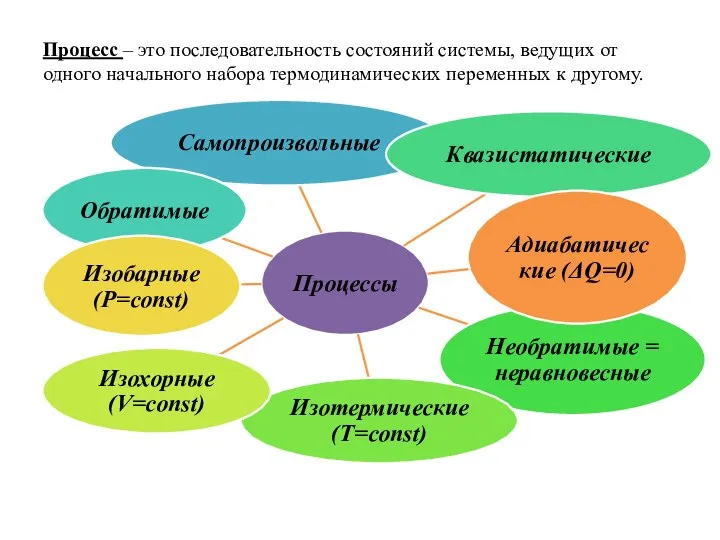
- 4. Процесс – это последовательность состояний системы, ведущих от одного начального набора термодинамических переменных к другому.
- 5. Основное положение термодинамики: Любая изолированная термодинамическая система с течением времени приходит в равновесие и не может
- 7. Запись Первого закона: Q = A + ΔU Если система совершает работу без дополнительного сообщения энергии,
- 8. Закон Гесса: изменение энтальпии не зависит от пути реакции, а определяется только свойствами реагентов и продуктов.
- 9. Следствия закона Гесса: 1. Тепловой эффект прямой реакции равен по величине, но обратен по знаку тепловому
- 10. 3. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и теплот сгорания продуктов,
- 12. Скачать презентацию







 Ионная химическая связь
Ионная химическая связь Ароматические углеводороды
Ароматические углеводороды Комплексные соединения
Комплексные соединения Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Урок по химии в 10 классе по теме Каучуки
Урок по химии в 10 классе по теме Каучуки Углеводы. Глюкоза
Углеводы. Глюкоза Алюминий и его свойства
Алюминий и его свойства Массовая и объемная доля компонентов смеси
Массовая и объемная доля компонентов смеси Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Гликозилирование, эффективная синтетическая стратегия для повышения биодоступности терапевтических пептидов
Гликозилирование, эффективная синтетическая стратегия для повышения биодоступности терапевтических пептидов Интересные факты о нефти
Интересные факты о нефти Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Бальзам-ополаскиватель для волос
Бальзам-ополаскиватель для волос Углеводы. Структура
Углеводы. Структура Внеурочная работа по химии. Краеведение
Внеурочная работа по химии. Краеведение Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Обмен белков - 1
Обмен белков - 1 Мембранные липиды: строение и функции
Мембранные липиды: строение и функции Cтроение и спектры молекул
Cтроение и спектры молекул L’introduction a la biochimie. La structure et les proprietes des proteines
L’introduction a la biochimie. La structure et les proprietes des proteines Углерод. Нахождение в природе
Углерод. Нахождение в природе Интернет-тренажеры
Интернет-тренажеры Исследование химических моделей (11 класс)
Исследование химических моделей (11 класс) Окислительные методы получения органических соединений
Окислительные методы получения органических соединений Презентация по Химии "Вода - найдивовижніша речовина в світі" - скачать смотреть бесплатно
Презентация по Химии "Вода - найдивовижніша речовина в світі" - скачать смотреть бесплатно Фотосинтез. Суммарное уравнение, общий вид
Фотосинтез. Суммарное уравнение, общий вид