Содержание
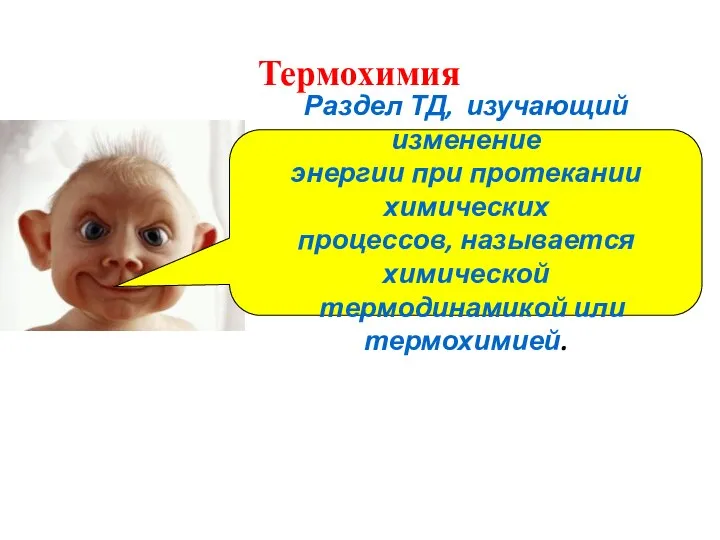
- 2. Раздел ТД, изучающий изменение энергии при протекании химических процессов, называется химической термодинамикой или термохимией. Термохимия
- 3. Особенности термохимических уравнений: 1. Уравнения записываются с учетом ТД функций состояния системы (ΔH, Δ S). 2.
- 4. Частным выражением 1-го начала термодинамики применительно к химическим процессам является закон Гесса (1840 г): Приращение энтальпии
- 5. Первое следствие закона Гесса ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реагент), ΔН0проц.[кДж ·моль-1]. Тепловой эффект процесса равен алгебраической
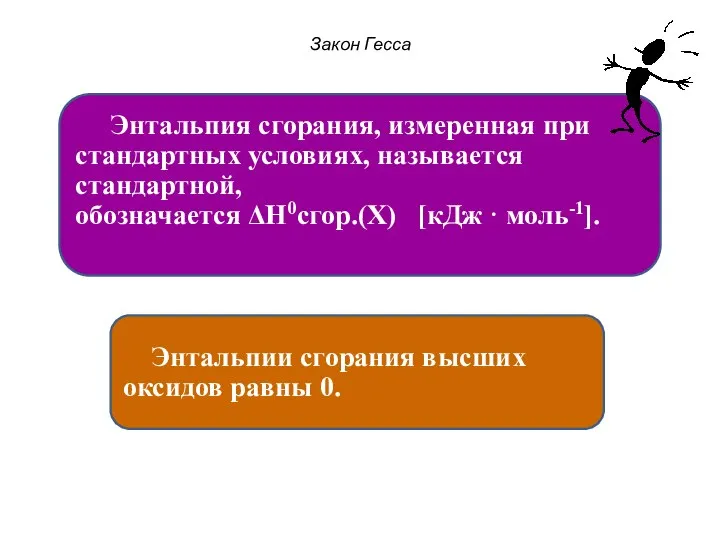
- 6. Закон Гесса Энтальпия сгорания, измеренная при стандартных условиях, называется стандартной, обозначается ΔН0сгор.(Х) [кДж · моль-1]. Энтальпии
- 7. ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1] Второе следствие закона Гесса: Тепловой эффект химического процесса равен
- 8. Закон Гесса Задача 2. Рассчитать тепловой эффект реакции спиртового брожения глюкозы, исходя из стандартных энтальпий сгорания:
- 9. Пищевая калорийность 1000 кал = 1 ккал Так... Пончик с калорийностью в 500 ккал на самом
- 10. Закон Гесса Коэффициенты калорийности основных компонентов пищи равны: К (белков и углеводов) = 16,5 – 17,2
- 11. Закон Гесса Задача . Рассчитайте калорийность 300 граммов порции рыбы, если известно, что в 100 г
- 13. Скачать презентацию


![Первое следствие закона Гесса ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реагент), ΔН0проц.[кДж ·моль-1].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/686890/slide-4.jpg)
![ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1] Второе следствие закона Гесса:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/686890/slide-6.jpg)



 Презентация по Химии "Ток в электролитах" - скачать смотреть
Презентация по Химии "Ток в электролитах" - скачать смотреть  Растворы. Концентрации растворов
Растворы. Концентрации растворов Геохимия урана и тория в осадочном процессе
Геохимия урана и тория в осадочном процессе Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2 Общая характеристика углерода
Общая характеристика углерода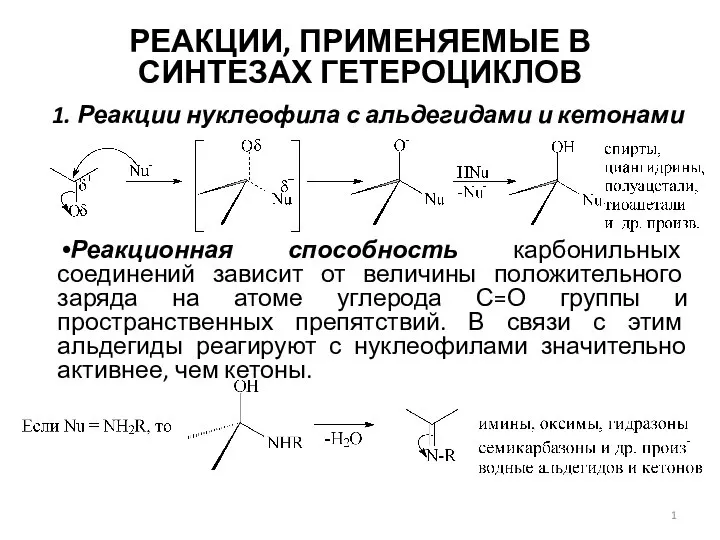 Реакции, применяемые в синтезах гетероциклов
Реакции, применяемые в синтезах гетероциклов Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Сероводоро́д, сернистый водород (H2S) (физические свойства)
Сероводоро́д, сернистый водород (H2S) (физические свойства) Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно
Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно Кислотные дожди
Кислотные дожди Человек и отходы «Человечество не погибнет в атомном кошмаре, оно захлебнется в собственных отходах» Нильс Бор. Автор: Георги
Человек и отходы «Человечество не погибнет в атомном кошмаре, оно захлебнется в собственных отходах» Нильс Бор. Автор: Георги Опасные химикаты
Опасные химикаты Физические свойства металлов
Физические свойства металлов Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов
Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов Углерод и его соединения
Углерод и его соединения Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Тест
Тест Исследовательская работа: «Химические индикаторы»
Исследовательская работа: «Химические индикаторы» Кислород. Горение сложных веществ на воздухе или в кислороде
Кислород. Горение сложных веществ на воздухе или в кислороде Производственно-торговая компания ООО «СОЖ Синтез-Набережные Челны»
Производственно-торговая компания ООО «СОЖ Синтез-Набережные Челны» Амінокислоти. Класифікація та номенклатура
Амінокислоти. Класифікація та номенклатура Химический состав фракций нефти
Химический состав фракций нефти Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Строение газообразных, жидких и твердых тел
Строение газообразных, жидких и твердых тел Программа CHEM3D
Программа CHEM3D Обмен липидов
Обмен липидов Влияние Этанола на организм человека
Влияние Этанола на организм человека Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра