Содержание
- 4. - знание законов химии, понимание химической сущности явлений и реакций, свойств веществ, характера их взаимодействия и
- 5. Задание 39 1. Инструкции по оцениванию
- 7. Углекислый газ объёмом 5,6 л (н.у.) пропустили через 164 мл 20%-ного раствора гидроксида натрия (ρ =
- 8. Элементы ответа: 1) рассчитаны количества веществ реагентов: 2) составлены уравнения возможных реакций между оксидом углерода (IV)
- 9. Элементы ответа: 1) рассчитаны количества веществ реагентов: 2) составлены уравнения возможных реакций между оксидом углерода (IV)
- 13. Медь, выделившаяся в результате взаимодействия 2,6 г цинка с 160 г 5% р-ра сульфата меди, полностью
- 14. Медь, выделившаяся в результате взаимодействия 2,6 г цинка с 160 г 5% р-ра сульфата меди, полностью
- 17. Если смесь хлоридов калия и кальция добавить к раствору карбоната натрия, то образуется 10 г осадка.
- 18. Элементы ответа: 1) записаны уравнения реакций: 2) рассчитано количество вещества реагентов: 3) вычислены массы веществ и
- 20. Элементы ответа: 1) записаны уравнения реакций: 2) рассчитано количество вещества реагентов: 3) вычислены массы веществ и
- 21. Смесь натрия и оксида натрия растворили в воде. При этом выделилось 4,48 л (н.у.) газа и
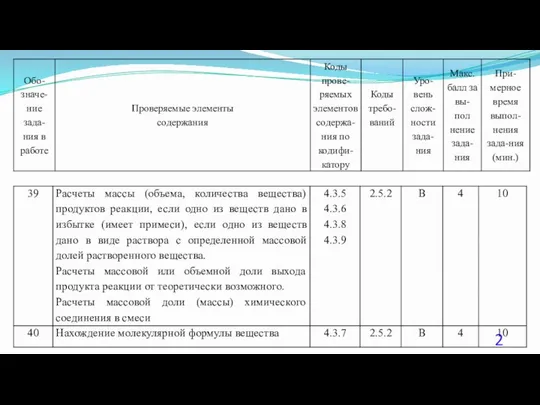
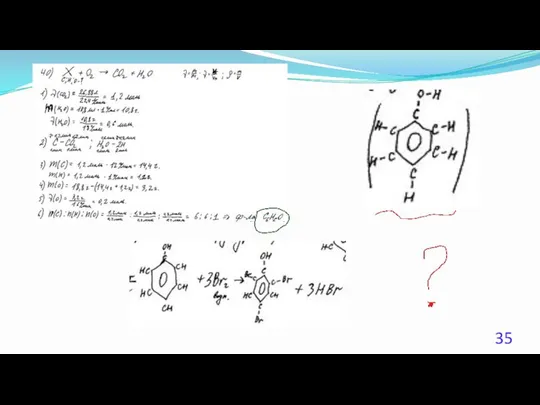
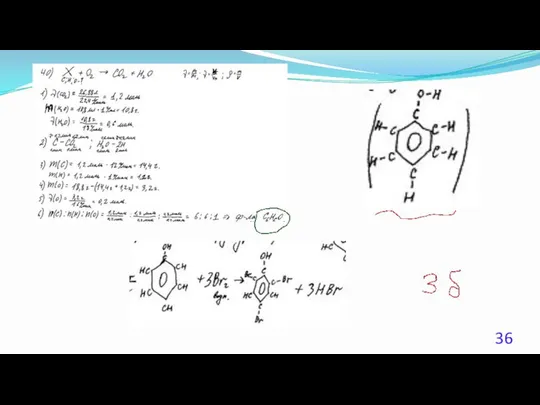
- 23. 40. (Демоверсия ЕГЭ 2016). При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г
- 24. Решение 1. Содержание верного ответа: (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа. 1)
- 25. Решение 2. Общая формула вещества CxHyOz n(CO2) = 35,2 /44 = 0,8 моль; n(С) = 0,8
- 26. Решение 3. Если при взаимодействии органического вещества с оксидом меди(II) образуется кетон, то это вещество –
- 27. Решение 4. n(CO2) = 35,2 /44 = 0,8 моль; n(H2O) = 18,0 / 18 = 1,0моль;
- 28. Решение 5. Если при взаимодействии органического вещества с оксидом меди(II) образуется кетон, то это вещество –
- 29. Задание 40 1. Инструкции по оцениванию
- 30. При сгорании 4,48 л (н.у.) газообразного органического вещества получили 35,2 г углекислого газа и 10,8 мл
- 41. Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе.
- 42. 1) Найдено соотношение атомов углерода, водорода и кислорода в соединении: w(H) = 100 – 40,0 –
- 44. Скачать презентацию






































 Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Шкала рН
Шкала рН Тотығутотықсыздану титрлеу әдістері. Дәріс № 7
Тотығутотықсыздану титрлеу әдістері. Дәріс № 7 Мас-спектр кластерів вуглецю
Мас-спектр кластерів вуглецю Предельные углеводороды
Предельные углеводороды Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени
Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени Металлы и сплавы -материал для древних и современных олимпийских наград.
Металлы и сплавы -материал для древних и современных олимпийских наград. Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Алюминий в природе
Алюминий в природе Моделирование (7 класс)
Моделирование (7 класс) Топливо и топливосжигающие устройства. Искусственные виды топлив. Газификация твердого топлива
Топливо и топливосжигающие устройства. Искусственные виды топлив. Газификация твердого топлива Региональная металлогения
Региональная металлогения Термический анализ
Термический анализ Расчет ректификационной колонны
Расчет ректификационной колонны Дисперсные
Дисперсные  Дисперсные системы
Дисперсные системы Органічні розчинники. Їх застосування
Органічні розчинники. Їх застосування Химическая энергия
Химическая энергия Управління якістю лікарських засобів у фармацевтичній галузі
Управління якістю лікарських засобів у фармацевтичній галузі Биохимия почек и мочи. (Лекция 10)
Биохимия почек и мочи. (Лекция 10) Промышленные типы месторождений железа
Промышленные типы месторождений железа Дисперсные системы
Дисперсные системы Соли. Названия и классификация солей
Соли. Названия и классификация солей Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ galogeny
galogeny Cоляная кислота и ее соли
Cоляная кислота и ее соли Производство азотной кислоты
Производство азотной кислоты МОУ Квитокская средняя общеобразовательная школа. УРОК ХИМИИ. 11 КЛАСС. Химия и производство. Учитель: Левицкая Лариса Виктор
МОУ Квитокская средняя общеобразовательная школа. УРОК ХИМИИ. 11 КЛАСС. Химия и производство. Учитель: Левицкая Лариса Виктор