Содержание
- 2. Три кити нанохімії Нанохімія Розмірний ефект Самозбірка та самоорганізація поліфункціональність
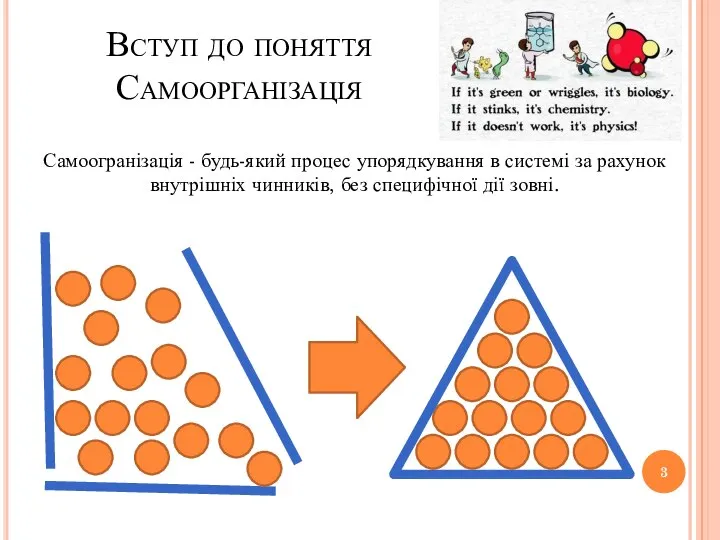
- 3. Вступ до поняття Самоорганізація Самоогранізація - будь-який процес упорядкування в системі за рахунок внутрішніх чинників, без
- 4. Самоорганізація дисипативна консервативна Процес упорядкування в відкритій системі за рахунок узгодженої дії множини елементів її складових
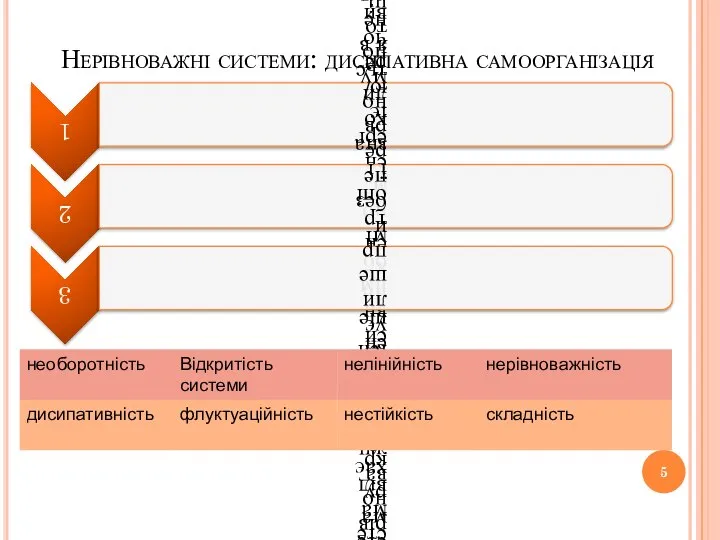
- 5. Нерівноважні системи: дисипативна самоорганізація
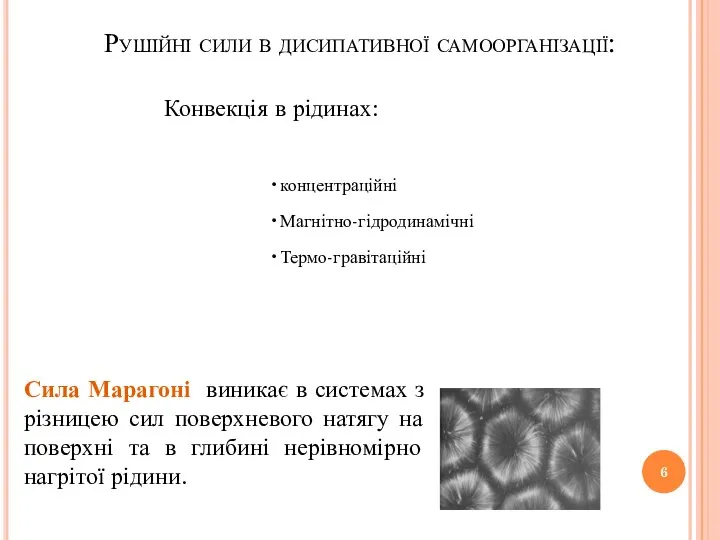
- 6. концентраційні Магнітно-гідродинамічні Термо-гравітаційні Рушійні сили в дисипативної самоорганізації: Конвекція в рідинах: Сила Марагоні виникає в системах
- 7. Приклади дисипативної самоорганізації: комірки Бенара Напрям руху рідини в комірці Бенара. Червона стрілка – рух гарячих
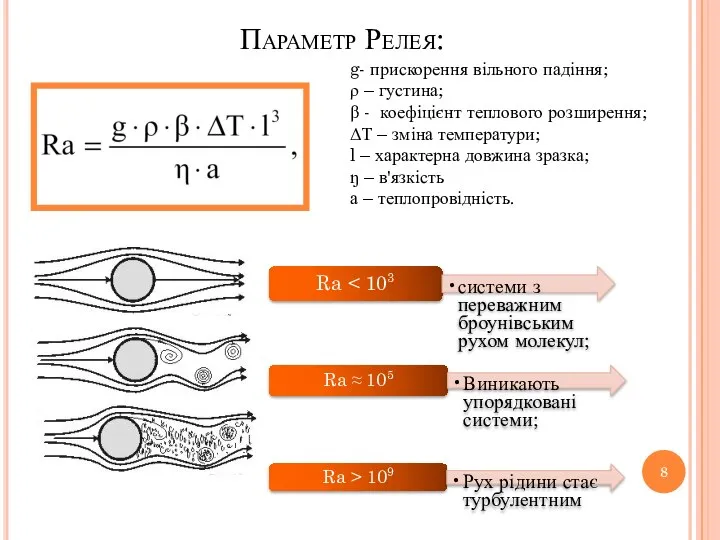
- 8. Параметр Релея: g- прискорення вільного падіння; ρ – густина; β - коефіцієнт теплового розширення; ΔТ –
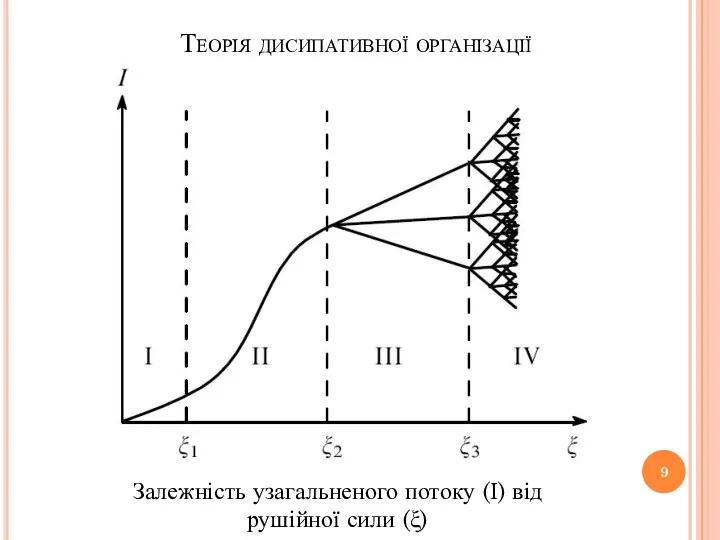
- 9. Теорія дисипативної організації Залежність узагальненого потоку (І) від рушійної сили (ξ)
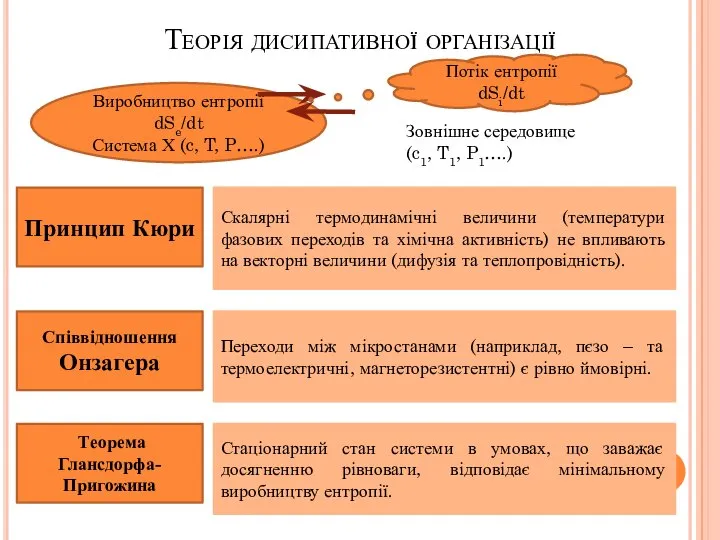
- 10. Теорія дисипативної організації Принцип Кюри Скалярні термодинамічні величини (температури фазових переходів та хімічна активність) не впливають
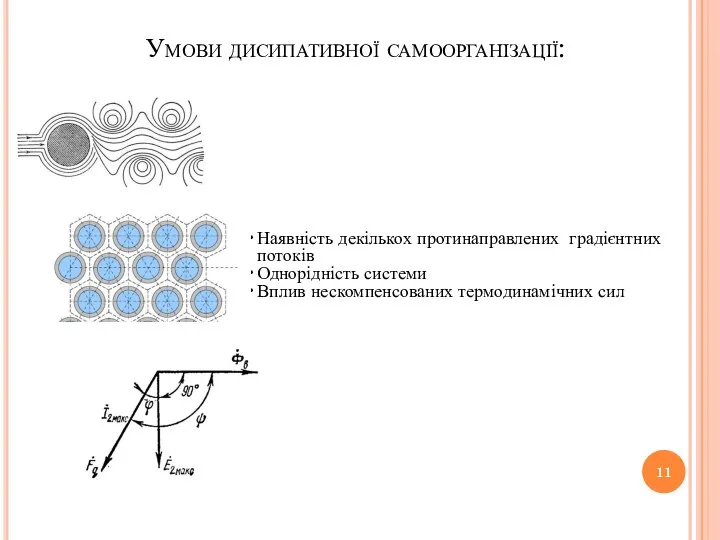
- 11. Умови дисипативної самоорганізації: Наявність декількох протинаправлених градієнтних потоків Однорідність системи Вплив нескомпенсованих термодинамічних сил
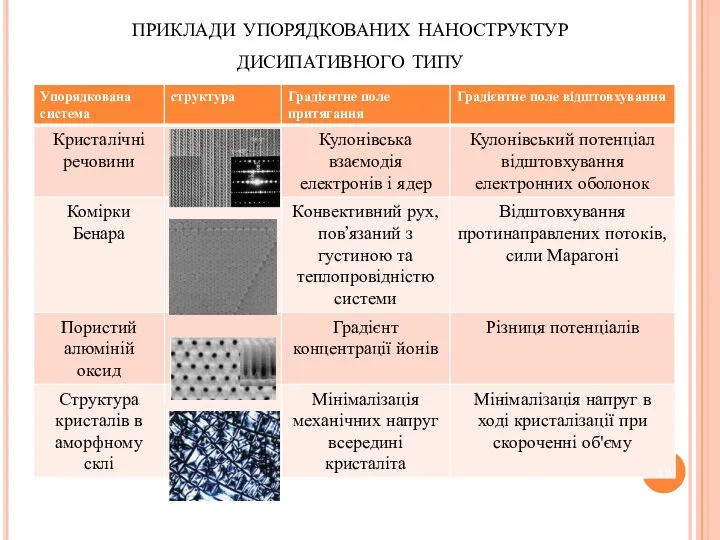
- 12. приклади упорядкованих наноструктур дисипативного типу
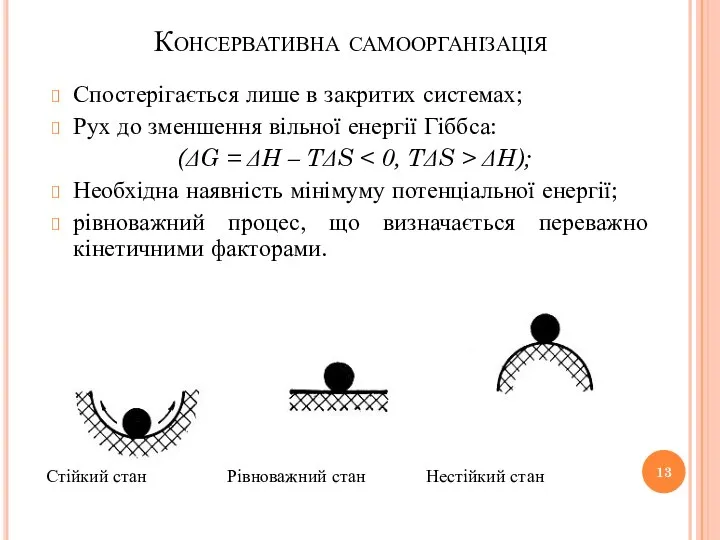
- 13. Консервативна самоорганізація Спостерігається лише в закритих системах; Рух до зменшення вільної енергії Гіббса: (ΔG = ΔH
- 14. Природа супрамолекулярних взаємодій Jean-Marie Lehn: Супрамолекулярна хімія – “це хімія молекулярних ансамблів та міжмолекулярних нековалентних зв'язків”
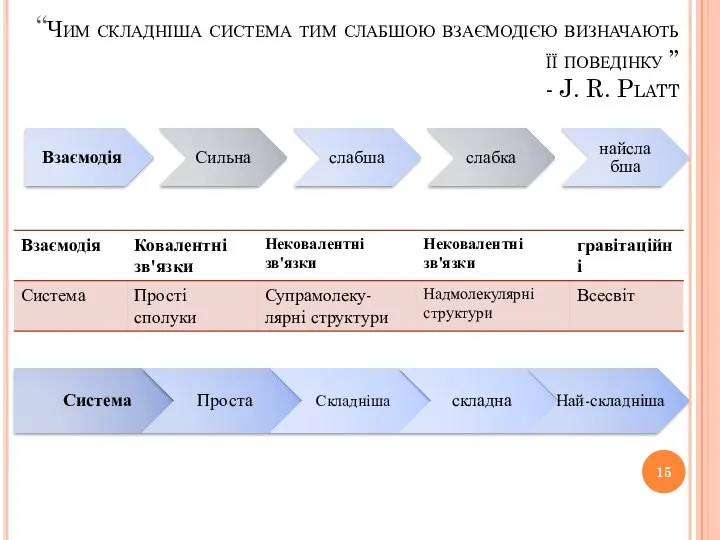
- 15. “Чим складніша система тим слабшою взаємодією визначають її поведінку ” - J. R. Platt Взаємодія Сильна
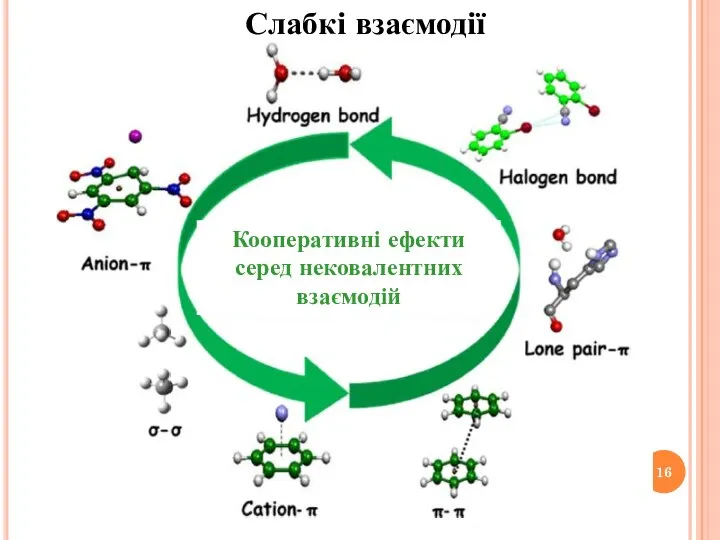
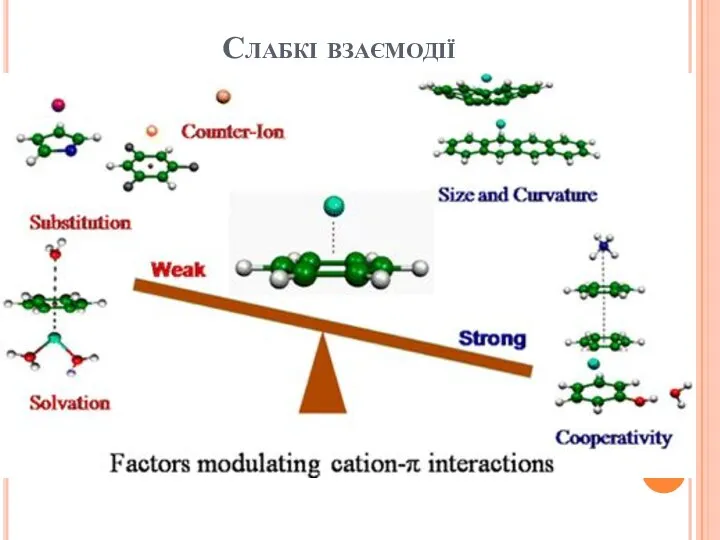
- 16. Слабкі взаємодії Кооперативні ефекти серед нековалентних взаємодій
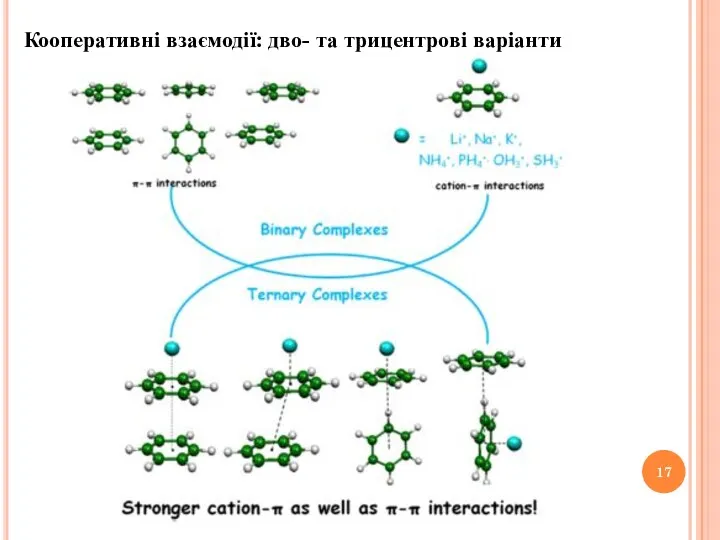
- 17. Кооперативні взаємодії: дво- та трицентрові варіанти
- 18. Слабкі взаємодії
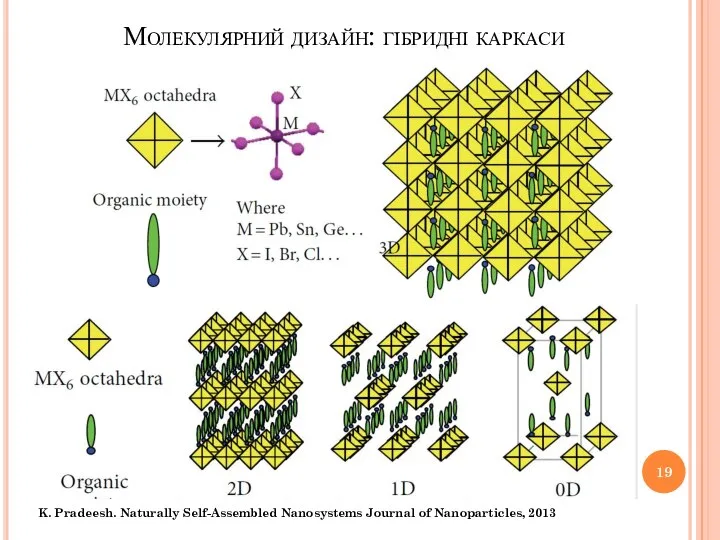
- 19. Молекулярний дизайн: гібридні каркаси K. Pradeesh. Naturally Self-Assembled Nanosystems Journal of Nanoparticles, 2013
- 20. Самозбірка (self-assembling) – процес утворення упорядкованої системи надмолекулярного типу за участі нековалентних взаємодій, де вихідні компоненти
- 21. Короткі нотатки: Самоорганізація – це процес упорядкування систем складної будови, що обумовлюється колективною поведінкою компонентів. Самоорганізація
- 23. Скачать презентацию






 Алюминий и его соединения
Алюминий и его соединения Лабораторная посуда и оборудование
Лабораторная посуда и оборудование Презентация по Химии "Классификация и номенклатура неорганических соединений" - скачать смотреть
Презентация по Химии "Классификация и номенклатура неорганических соединений" - скачать смотреть  Аммиак
Аммиак Формування мотивації до самостійної пізнавальної діяльності учнів на уроках хімії
Формування мотивації до самостійної пізнавальної діяльності учнів на уроках хімії Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы
Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы Полиэтилен
Полиэтилен Протолитические равновесия в растворах электролитов
Протолитические равновесия в растворах электролитов Сахар – практически чистая сахароза
Сахар – практически чистая сахароза Общая и медицинская химия
Общая и медицинская химия Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы The phenomenon of radioactivity. Radioisotopes. The nuclear reaction
The phenomenon of radioactivity. Radioisotopes. The nuclear reaction Вещественный состав магматических горных пород
Вещественный состав магматических горных пород Проведення полімеразної ланцюгової реакції з використанням діагностичних тест-систем
Проведення полімеразної ланцюгової реакції з використанням діагностичних тест-систем Неорганические соединения галогенов
Неорганические соединения галогенов Подгруппа мышьяка
Подгруппа мышьяка Алкадиены Учитель химии МОУ лицея №6 Дробот Светлана Сергеевна
Алкадиены Учитель химии МОУ лицея №6 Дробот Светлана Сергеевна Сера
Сера Підготувала учениця 10-Б класу Березянська Альона
Підготувала учениця 10-Б класу Березянська Альона  Оксиды. Названия оксидов
Оксиды. Названия оксидов Исследование Е. Е. Вагнера в области терпенов и камфоры
Исследование Е. Е. Вагнера в области терпенов и камфоры Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Пищевые добавки
Пищевые добавки Комбинированные задачи. Базовые формулы
Комбинированные задачи. Базовые формулы Біотехнічні основи технології харчових продуктів
Біотехнічні основи технології харчових продуктів Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика Электрохимические методы анализа, часть 2. Кулонометрия. Вольтамперометрия
Электрохимические методы анализа, часть 2. Кулонометрия. Вольтамперометрия Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01