Содержание
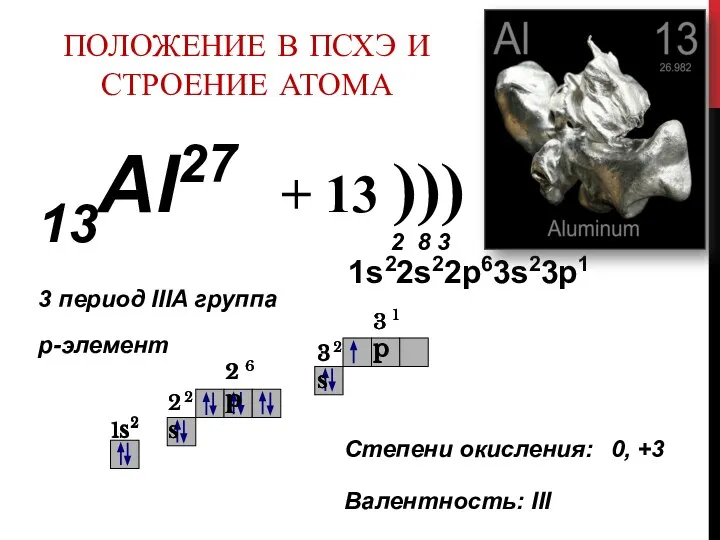
- 2. ПОЛОЖЕНИЕ В ПСХЭ И СТРОЕНИЕ АТОМА 13Аl27 + 13 ))) 2 8 3 1s22s22p63s23p1 3 период
- 3. НАХОЖДЕНИЕ В ПРИРОДЕ По распространенности в природе – 3 место (после О и Si). Среди металлов
- 4. НАХОЖДЕНИЕ В ПРИРОДЕ Каолин Al2O3 ∙ 2SiO2 ∙ 2H2O Нефелин Na2O ∙ Al2O3 ∙ 2SiO2 Боксит
- 5. ПОЛУЧЕНИЕ АЛЮМИНИЯ Путем электролиза из глинозема и боксита в расплавленном криолите (Na3AIF6) электролиз Al2O3 → 2Al
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ белый металл с серебристым блеском легкий (плотность = 2,7 г/см3) хороший проводник тепла
- 7. ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ С простыми веществами 4Аl +3O2 = 2Al2O3 оксид алюминия 2Аl + 3S =
- 8. ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ Со сложными веществами Очищенный от оксидной пленки алюминий реагирует с водой: 2Al +
- 9. ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ Со сложными веществами Не реагирует с конц.НNO3 и конц.H2SO4. ! ! ! С
- 10. ОКСИД АЛЮМИНИЯ Аl2O3 - белое тугоплавкое вещество. В воде не растворяется. В природе встречается в виде
- 11. ГИДРОКСИД АЛЮМИНИЯ Белый нерастворимый в воде порошок. Амфотерный гидроксид а) с кислотами Al(OH)3 + 3HCl =
- 12. КАЧЕСТВЕННАЯ РЕАКЦИЯ Качественная реакция на катион Al3+ АlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Аl3+ +
- 13. ПРИМЕНЕНИЕ Сплавы: дюралюминий, силумин, магналий Al – «крылатый металл». В производстве самолетов, автомобилей. Краска «серебрянка». В
- 14. СОСТАВЬТЕ ТЕСТОВЫЕ ЗАДАНИЯ ПО ТЕМЕ «АЛЮМИНИЙ И ЕГО СОЕДИНЕНИЯ»
- 15. Например: Элемент подгруппы алюминия: А) La B) In C) Si D) Mn E) Sc Ответ: ...
- 16. По распространенности в земной коре алюминий А) третий B) четвертый C) шестой D) первый E) второй
- 17. Природное соединение алюминия: А) гематит B) пирит C) магнетит D) боксит E) лимонит Ответ?
- 18. Степень окисления алюминия в соединениях: А) +1 B) +2 C) +6 D) +4 E) +3 Ответ
- 19. Магний и алюминий в промышленности получают путём А) гидролиза B) сольватолиза C) пиролиза D) озонолиза E)
- 20. В результате взаимодействия 2 моль гидроксида алюминия и 3 моль серной кислоты получится соль А) дигидрооксосульфат
- 21. В результате полного взаимодействия 1 моль гидроксида алюминия и 1 моль серной кислоты получиться соль А)
- 22. Сумма коэффициентов в уравнении реакции образования нерастворимого основания при взаимодействии AlCl3 и КOН: А) 4 B)
- 23. Желаю удачи!
- 25. Скачать презентацию





















 Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Исследование уравнения сжимаемости при высоких плотностях газов на примере аргона
Исследование уравнения сжимаемости при высоких плотностях газов на примере аргона Ցեմենտի արտադրություն
Ցեմենտի արտադրություն Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Презентація на тему: Твердість води Способи усунення твердості води
Презентація на тему: Твердість води Способи усунення твердості води  Микроорганизмы и важнейшие химические факторы среды обитания
Микроорганизмы и важнейшие химические факторы среды обитания Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Презентация по Химии "Кислотные дожди" - скачать смотреть
Презентация по Химии "Кислотные дожди" - скачать смотреть  Алюминиевые сплавы
Алюминиевые сплавы Неон. Получение
Неон. Получение Биохимия крови. (Лекция 9)
Биохимия крови. (Лекция 9) Приготовление раствора сахара
Приготовление раствора сахара Сплавы
Сплавы Электронная формула атома магния
Электронная формула атома магния Периодический закон, периодическая система. Формулировка периодического закона Д.И. Менделеева
Периодический закон, периодическая система. Формулировка периодического закона Д.И. Менделеева КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Мило. Мийні засоби
Мило. Мийні засоби  Домашняя химчистка рекомендует
Домашняя химчистка рекомендует Значення хімічних процесів у природі
Значення хімічних процесів у природі Биоорганическая химия
Биоорганическая химия Презентация по Химии "Основные классы неорганических соединений Соли" - скачать смотреть
Презентация по Химии "Основные классы неорганических соединений Соли" - скачать смотреть  Пластик и его применение в быту
Пластик и его применение в быту Комплексные соединения. Аммиакаты
Комплексные соединения. Аммиакаты Презентация по Химии "Круговорот углерода в природе" - скачать смотреть
Презентация по Химии "Круговорот углерода в природе" - скачать смотреть  Аккумуляторы и их устройство
Аккумуляторы и их устройство В менделеевской гостиной: А.А.Блок и Менделеевы
В менделеевской гостиной: А.А.Блок и Менделеевы Важнейшие классы бинарных соединений – оксиды и водородные соединения
Важнейшие классы бинарных соединений – оксиды и водородные соединения