Содержание
- 2. Учение о растворах Якоб Хендрик Вант-Гофф 1852-1911 Сванте Август Аррениус 1859-1927 Фридрих Вильгельм Оствальд 1853-1932 Рихард
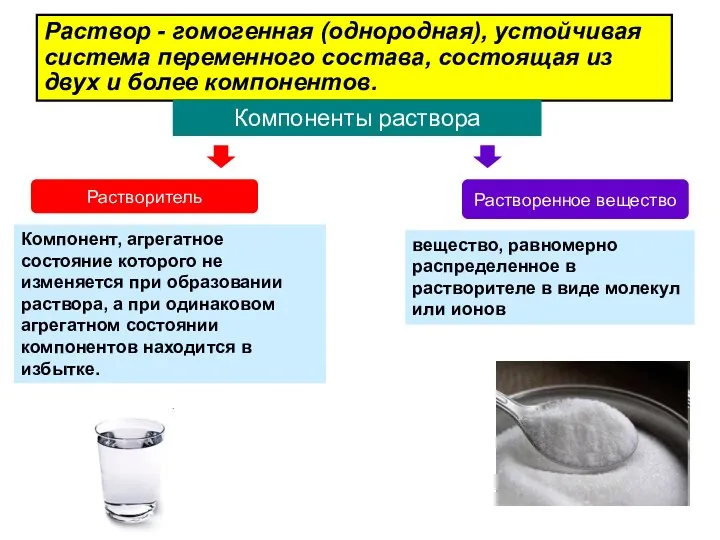
- 3. Раствор - гомогенная (однородная), устойчивая система переменного состава, состоящая из двух и более компонентов. Компоненты раствора
- 4. Различают растворы: газообразные, жидкие и твердые молекулярные растворы (неэлектролитов) и растворы электролитов. разбавленные (с небольшим содержанием)
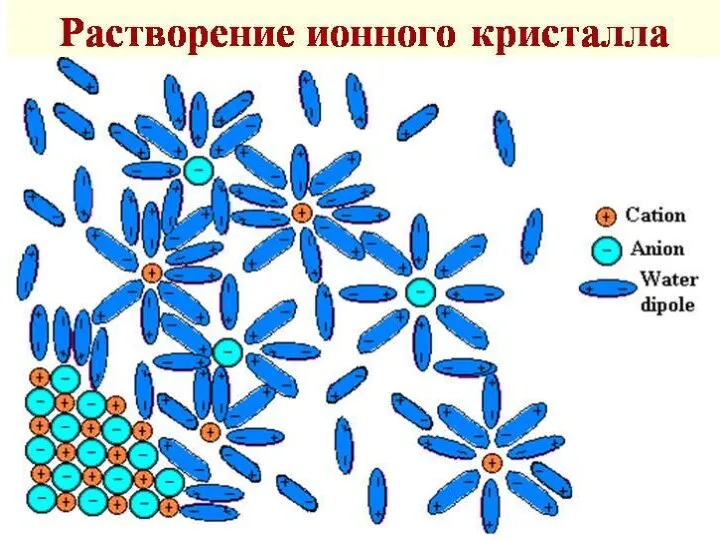
- 5. Растворение – физико-химический процесс, где происходит взаимодействие между частицами, образующими раствор, и равномерное распределение частиц.
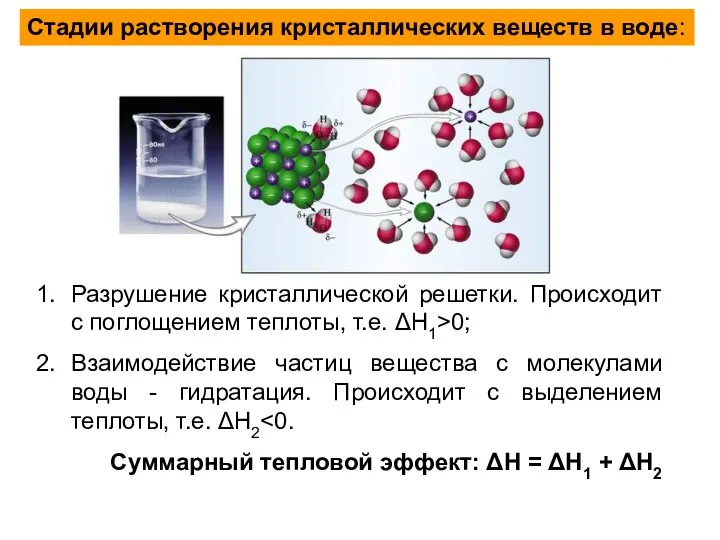
- 6. Стадии растворения кристаллических веществ в воде: Разрушение кристаллической решетки. Происходит с поглощением теплоты, т.е. ΔН1>0; Взаимодействие
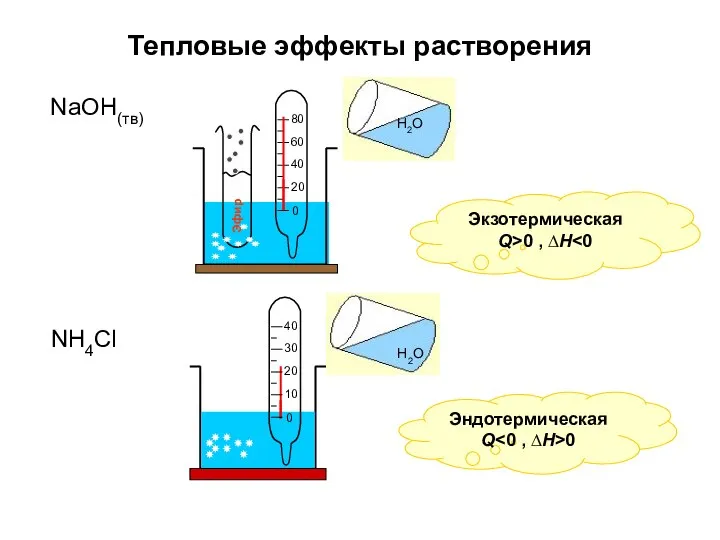
- 7. Экзотермическая Q>0 , ∆H NaOH(тв) Н2О NH4Cl Эндотермическая Q 0 Тепловые эффекты растворения
- 8. «Подобное растворяется в подобном» Вещества с ионным типом хим. связи лучше растворяются в полярных растворителях, неполярные
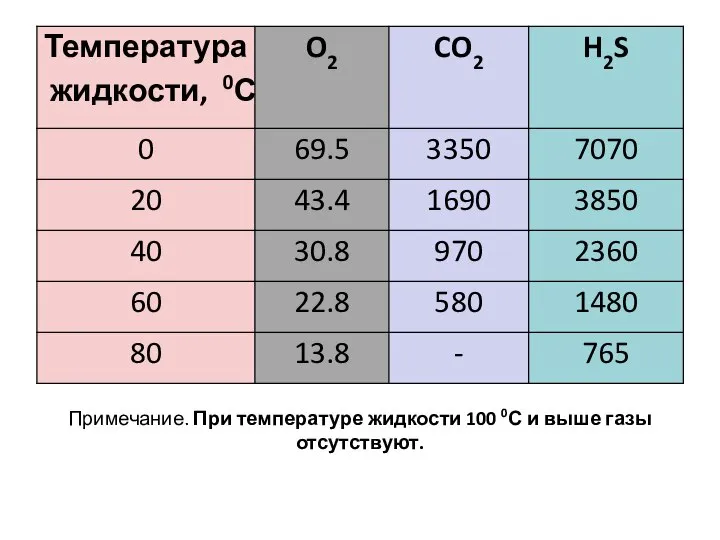
- 9. Примечание. При температуре жидкости 100 0С и выше газы отсутствуют.
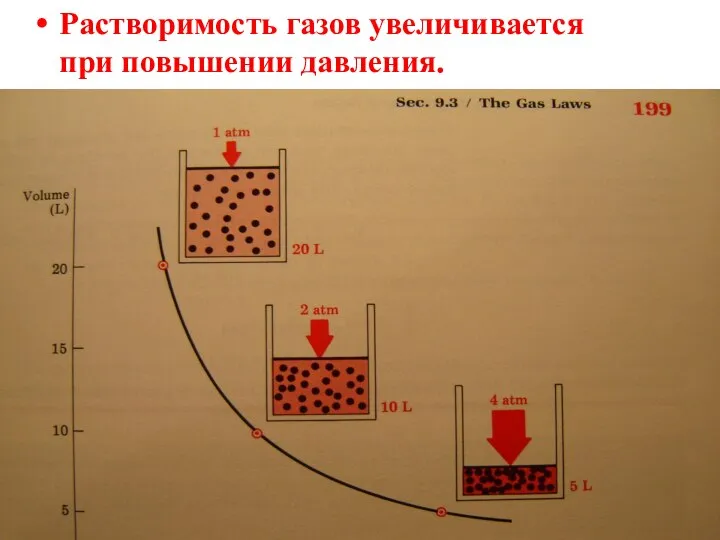
- 10. Растворимость газов увеличивается при повышении давления.
- 11. S = k ∙ р0 Закон Генри: Растворимость (концентрация) газа в жидкости пропорциональна парциальному давлению этого
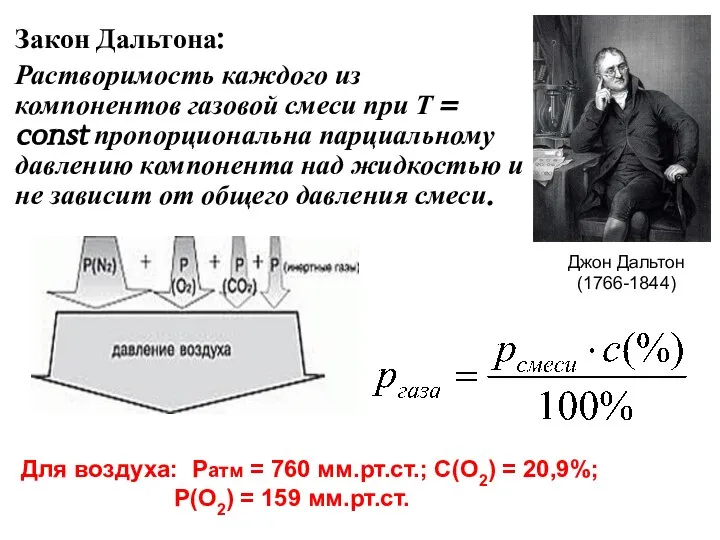
- 12. Закон Дальтона: Растворимость каждого из компонентов газовой смеси при Т = const пропорциональна парциальному давлению компонента
- 13. Закон Генри и Дальтона позволяет объяснить причины кессонной болезни
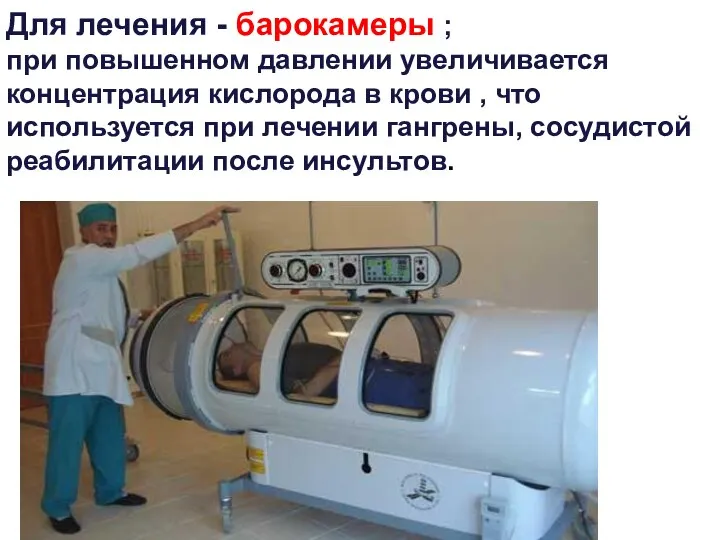
- 18. Для лечения - барокамеры ; при повышенном давлении увеличивается концентрация кислорода в крови , что используется
- 19. где S и S0 – растворимость газа в растворе электролита и в чистом растворителе, k –
- 20. Электролитами называются вещества, расплавы и растворы которых содержат подвижные ионы и проводят эл. ток. Явление распада
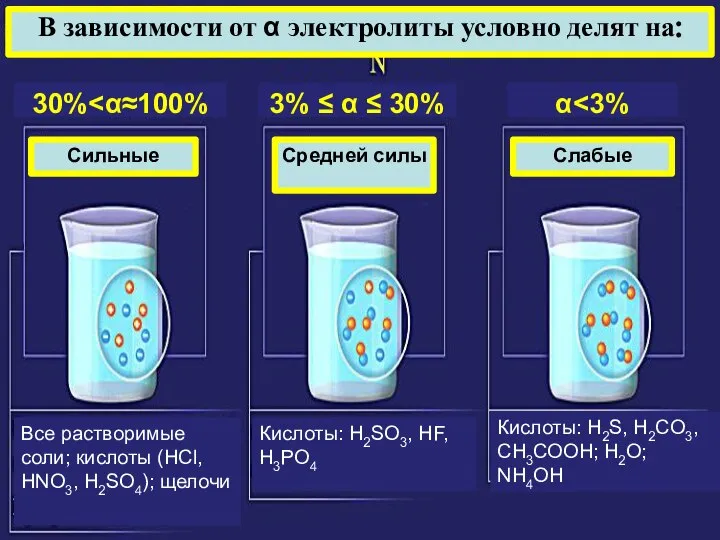
- 21. Степень диссоциации (α) - отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул
- 23. Факторы, влияющие на α: природа электролита и растворителя: чем полярнее хим. связь в молекуле электролита и
- 24. Электролитическая диссоциация слабых электролитов, является обратимой реакцией, например: CH3COOH ↔CH3COO͞ + H+ Константу равновесия такой реакции
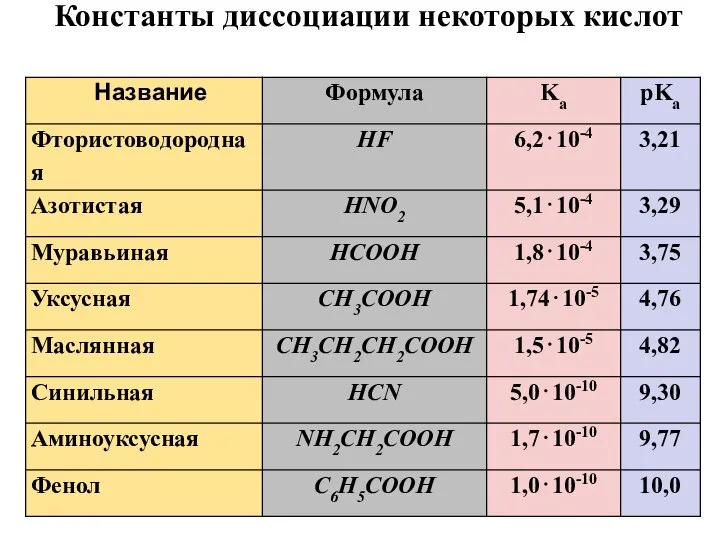
- 25. Константы диссоциации некоторых кислот
- 26. Связь константы диссоциации и степени диссоциации (закон разведения Оствальда) для слабых электролитов α → 0 и
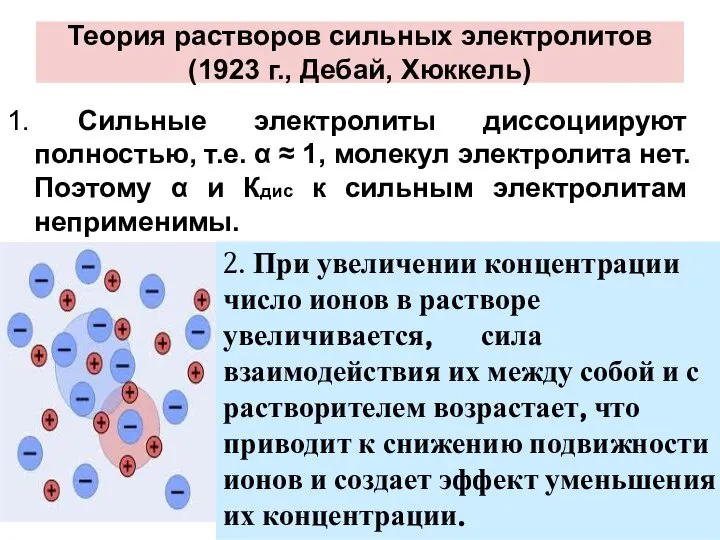
- 27. Теория растворов сильных электролитов (1923 г., Дебай, Хюккель) 1. Сильные электролиты диссоциируют полностью, т.е. α ≈
- 29. В разбавленных растворах γ = 1, тогда а = С. Коэффициент активности иона (γ) зависит: температуры;
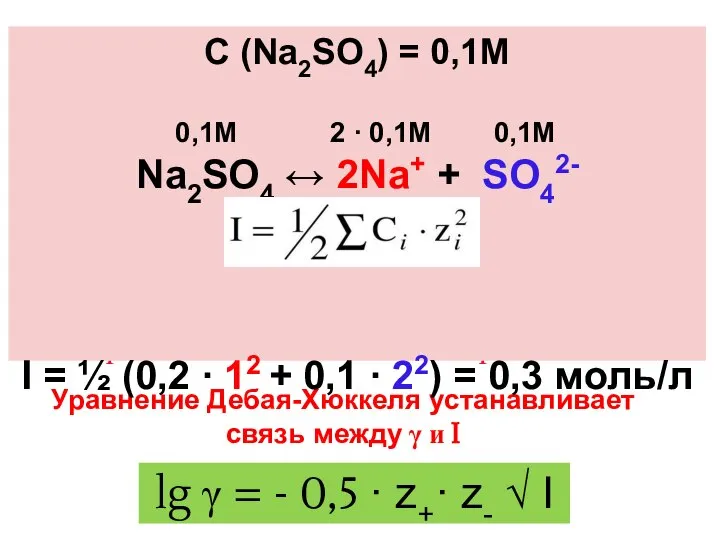
- 30. Ионная сила раствора — мера интенсивности электрического поля— мера интенсивности электрического поля, создаваемого ионами в растворе.
- 31. Ионная сила раствора (I) - величина, характеризующая силу электростатического взаимодействия ионов в растворе, которая равна полусумме
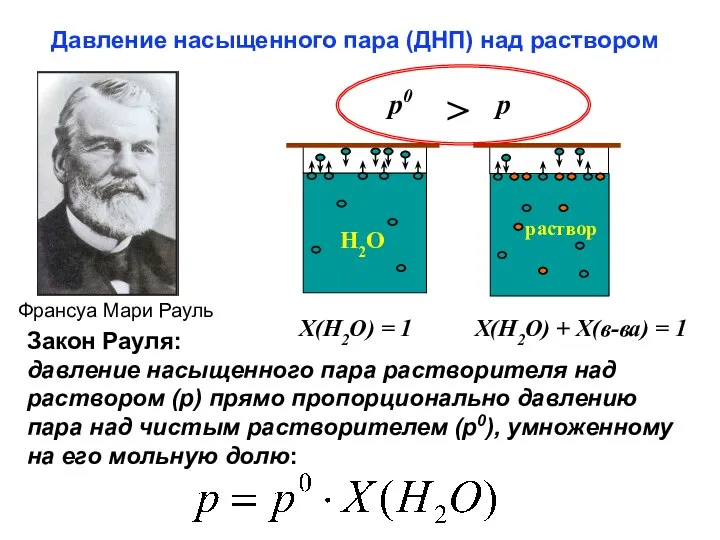
- 33. Давление насыщенного пара (ДНП) над раствором Франсуа Мари Рауль p0 > p Х(Н2О) = 1 Х(Н2О)
- 34. Вторая формулировка закона Рауля: относительное понижение давления насыщенного пара растворителя (p0) над раствором (p) нелетучего неэлектролита
- 35. КС – линия испарения (ж → п) КВ – линия кристаллизации (ж → тв) КА –
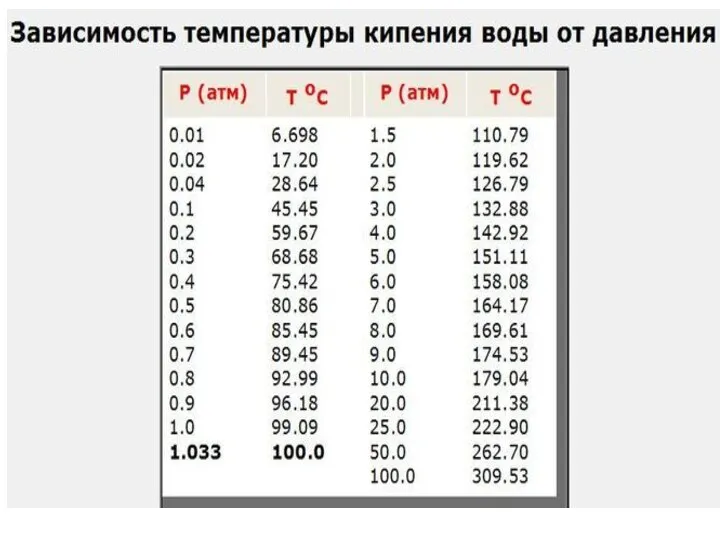
- 36. Растворы кипят при более высоких температурах по отношению к растворителю ΔТкип = Ткип(р-ра) - Ткип(р-ля), замерзают
- 37. Понижение Тзам и повышение Ткип растворов пропорционально моляльности раствора: ΔТзам = Ккр • Сm, Ккр –
- 38. В растворах электролитов число частиц больше из-за диссоциации. Вант-Гофф ввел поправочный изотонический коэффициент (i), который учитывает
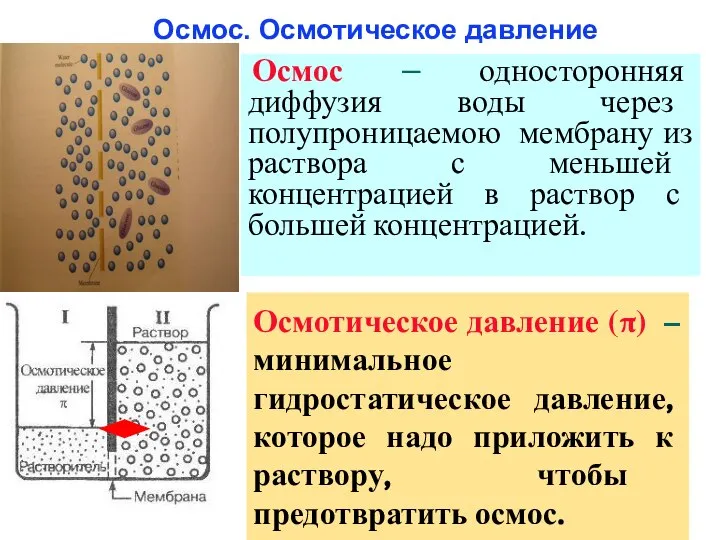
- 39. Осмос. Осмотическое давление Осмос – односторонняя диффузия воды через полупроницаемою мембрану из раствора с меньшей концентрацией
- 40. Закон Вант-Гоффа: – для растворов неэлектролитов – для растворов электролитов СМ- молярная концентрация (моль/л), R -
- 41. В организме осмотическое давление должно быть постоянным (изоосмия): π (плазмы)=7,7 атм= 740-780 кПа = 280-310 мОсм/л
- 42. При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их концентрацию выражают через осмолярную концентрацию
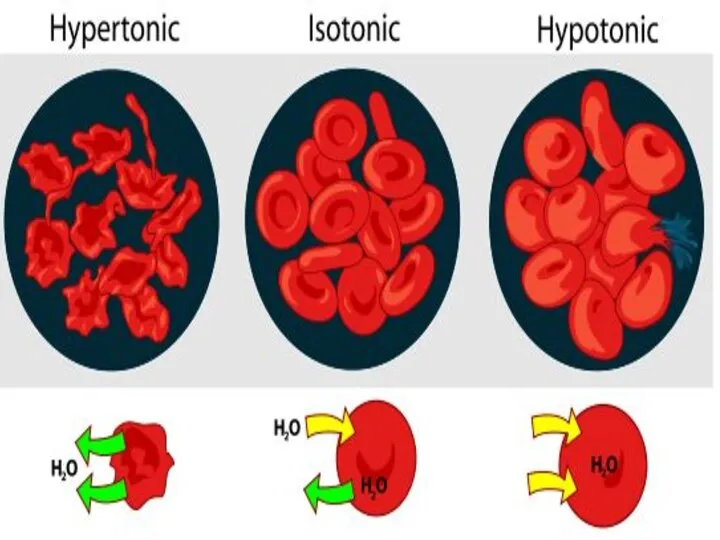
- 43. Растворы, у которых π больше, чем у π (плазмы) , называются гипертоническими. В медицине они применяются
- 44. Растворы, у которых π меньше, чем у π (плазмы) , называются гипотоническими. В медицине они для
- 46. Значение осмоса ⮚ упругость, тургор клеток ⮚ эластичность тканей, форма органов ⮚ усвоение пищи, образование лимфы,
- 47. Методы, основанные на изучении коллигативных свойств растворов осмометрия – измерение π, криоскопия – измерение ΔТзам (р-ра),
- 48. Применяются для определения : молекулярных масс различных веществ, чаще всего биополимеров (белков); суммарной концентрации всех растворенных
- 50. Скачать презентацию































 Мыла и синтетические моющие средства
Мыла и синтетические моющие средства Соли и классы химических веществ
Соли и классы химических веществ Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2)
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2) Химические свойства металлов. (9 класс)
Химические свойства металлов. (9 класс) Щавелевая кислота. Этандиовая кислота. Этандикислота
Щавелевая кислота. Этандиовая кислота. Этандикислота Почвоведение. Введение
Почвоведение. Введение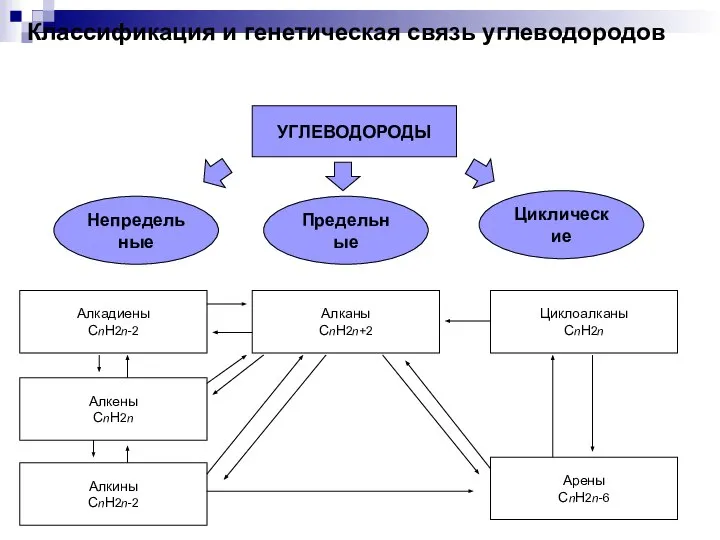 Классификация и генетическая связь углеводородов
Классификация и генетическая связь углеводородов Содержание глюкозы в крови
Содержание глюкозы в крови Электронная природа химической связи. Кристаллические и аморфные вещества
Электронная природа химической связи. Кристаллические и аморфные вещества Стиральные порошки и средства для стирки 2016
Стиральные порошки и средства для стирки 2016 Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Чем опасны нитраты
Чем опасны нитраты Выполнила: Иванова Алина, ученица 8 класса МБОУ «Ильинская СОШ». Руководитель: Фёдорова Светлана Ивановна, учитель химии МБОУ «И
Выполнила: Иванова Алина, ученица 8 класса МБОУ «Ильинская СОШ». Руководитель: Фёдорова Светлана Ивановна, учитель химии МБОУ «И Качественный химический анализ воды на определение металлов
Качественный химический анализ воды на определение металлов Презентация по Химии "Яке явище небезпечне для життя?" - скачать смотреть бесплатно
Презентация по Химии "Яке явище небезпечне для життя?" - скачать смотреть бесплатно Brain элементтері
Brain элементтері Технология экстракции цинаропикрина из растительного сырья
Технология экстракции цинаропикрина из растительного сырья Шкідливі хімічні речовини, забруднювачі атмосфери
Шкідливі хімічні речовини, забруднювачі атмосфери Hydrogen
Hydrogen Атомна одиниця маси. Відносна атомна маса хімічних елементів.
Атомна одиниця маси. Відносна атомна маса хімічних елементів.  Хімія і медицина
Хімія і медицина  Закон Авогадро
Закон Авогадро Одноатомные спирты. Химические свойства
Одноатомные спирты. Химические свойства Вплив фосфатної побутової хімії на організм людини.
Вплив фосфатної побутової хімії на організм людини. 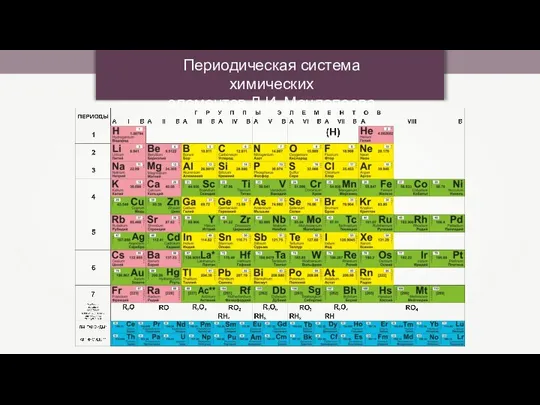 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Алкены - Презентация по Химии_
Алкены - Презентация по Химии_ «Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань 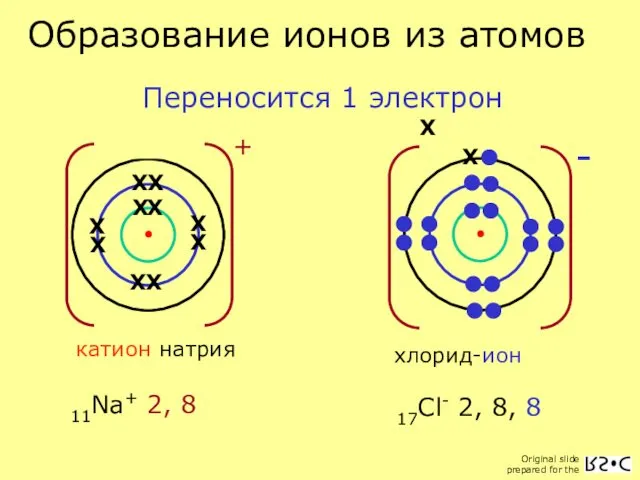 Образование ионов из атомов
Образование ионов из атомов