Содержание
- 3. ✔ Убывание кислотных свойств (H2CrO4 и H2MoO4) Элементы VIB группы ✔ rMo ≈ rW как следствие
- 4. Содержание в земной коре и минералы Cr – 20 место. Хромит или хромистый железняк (FeCr2O4 =
- 5. Открытие элементов Cr – в 1797 г. француз Воклен. От греческого «хрома» – «цвет» (из-за разнообразие
- 6. Cr Mo W Уменьшение активности металла: Cr + 2HCl = CrCl2 + H2↑ Mo и W
- 7. Получение Cr Выплавка феррохрома: FeCr2O4 + 4C = Fe + 2Cr + 4CO↑ (хромит) Получение чистого
- 8. Получение Mo 1 стадия – окислительный обжиг молибденита: 2 стадия – выщелачивание раствором аммиака: 7MoO3 +
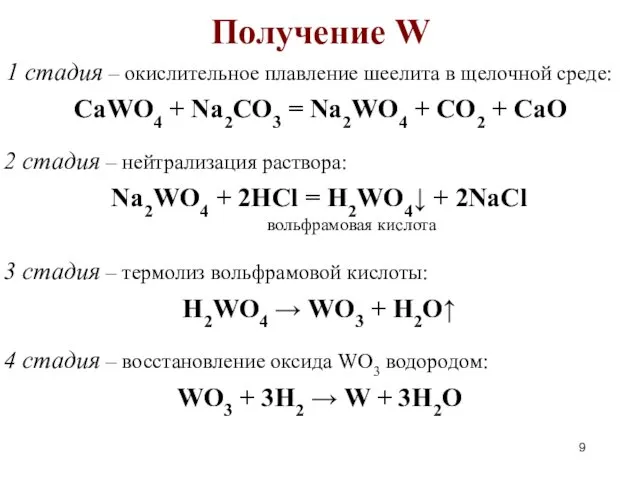
- 9. Получение W 1 стадия – окислительное плавление шеелита в щелочной среде: 2 стадия – нейтрализация раствора:
- 10. Простые вещества Твердые, тяжелые, тугоплавкие металлы W – самый тугоплавкий металл Сr – самый твердый металл
- 11. Свойства простых веществ: Cr 1) Cr + 2 HCl = CrCl2 + H2↑ Реакция в атмосфере
- 12. Свойства простых веществ: Cr 6) 2Cr + 3H2O = Cr2O3 +3H2↑ 7) 2Cr + 3/2O2 =
- 13. Свойства простых веществ: Mo, W 1) Растворение металлов: а) W + 8HF + 2HNO3 = H2[WF8]
- 14. Кислотно-основные свойcтва оксидов и гидроксидов CrO Cr(OH)2 основные Cr2O3 Cr(OH)3 CrO3 H2CrO4 амфотерные кислотные Низшие СО
- 15. Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O Cr(OH)3 + NaOH = Na[Cr(OH)4] тетрагидроксохромит натрия хромит натрия
- 16. Кислородные соединения Cr6+ CrO3 – темно-красный, разлагается выше 200 оС, растворим в воде: - термическое разложение:
- 17. Кислородные соединения Cr6+ Способы получения оксидов М6+: K2Cr2O7 + 2H2SO4конц= 2CrO3↓ + 2KHSO4 +H2O 2M +
- 18. H2CrO4: Ka1= 10–1, Ka2= 10–7 H2Cr2O7: Ka2= 10–2 Гидролиз солей: CrO42– – хромат ион, устойчив в
- 20. Соединения Cr6+ гораздо более сильные окислители, чем соединения Mo6+ и W6+ 4CrO3 + C2H5OH = 2Cr2O3
- 21. В зависимости от pH раствора: Cr2O72– + 3SO32– + 8H+ = 2Cr3+ + 3SO42– + 4H2O
- 22. Cr2O3 – очень стабилен, зеленый пигмент в красках. Не реагирует с водой, кислотами и р-рами щелочей.
- 23. Гидрооксид Cr3+ Получают добавлением щелочей или аммиака: Cr3+ + 3OH– = Cr(OH)3↓ Стареет, свежеосажденный амфотерен: Cr(OH)3
- 24. Соли Cr3+ Хромовые квасцы KCr(SO4)2.12H2O Многочисленные комплексы: CrCl3.6H2O – гидратная изомерия
- 25. Cr3+ → Cr6+ Сильные окислители: 2Cr3+ + 3S2O82– + 7H2O = Cr2O72– + 6SO42– + 14H+
- 26. Na15[MoVI126MoV28O462H14(H2O)70] ⋅~400H2O A. Müller, 1996 3.6 nm Гигантское колесо- Mo154
- 27. Наноежик или голубой лимон [HxMo368O1032(H2O)240(SO4)48]48– А. Мюллер, 2002
- 28. Применение Cr – коррозионностойкие стали, покрытия, инструменты Mo – жаропрочные стали, нагреватели W – нити накаливания,
- 29. Побочная подгруппа VII группы периодической системы
- 31. Mn, Tc, Re (n-1)d5ns2 Свойства Tc и Re очень похожи и сильно отличаюся от свойств Mn
- 32. Содержание в земной коре и минералы Mn – 15 место. Пиролюзит – рис. слева (MnO2.xH2O); браунит
- 33. Tc – первый искусственный элемент, 97Tc: t1/2 = 2,6.106 лет. Re – 81 место, ОЧЕНЬ редкий
- 34. Открытие элементов Mn – в 1774 г. шведы Шееле и Ган. Мангановый камень (пиролюзит) ремесленники добавляли
- 35. Получение простых веществ Дешевый метод MnO2 + Fe2O3 +5C = Mn + 2Fe + 5CO Дорогой
- 36. Свойства простых веществ
- 37. Хим. cвойства простых веществ Положение в ряду напряж. металлов ….Mg Mn Zn…H Cu Tc Re… Mn
- 38. Реакции при нагревании 3Mn + 2O2 = Mn3O4 (MnIIMnIII2O4) 3Mn + N2 = Mn3N2 (1200oC) Mn
- 39. Кислородные соединения M7+ M2О7 +Н2О = 2НMО4 Сильные кислоты, сила уменьшается в ряду Mn-Tc-Re HMnO4 нестабильна
- 40. Соли M7+ 2KMnO4 = K2MnO4 + MnO2 + O2↑ 2MnO4– + 5H2S + 6H+ = 2Mn2+
- 41. KMnO4 как окислитель Конпропорционирование 3MnSO4 + 2KMnO4 + 2H2O = 5MnO2↓ + K2SO4 + 2H2SO4
- 42. Получение KMnO4 Две стадии: 1) Щелочное плавление пиролюзита: 3MnO2 + KClO3 + 6KOH = 3K2MnO4 +
- 43. Кислородные соединения Mn6+ MnO3 и H2MnO4 – не известны Соли – манганаты (зеленый цвет) Манганаты склонны
- 44. Кислородные соединения Mn6+ Манганаты – сильные окислители, особенно в кислой среде, где восстанавливаются до Mn2+; в
- 45. Кислородные соединения Mn4+ MnO2 – важнейшее соединение Свойства окислителя (при нагревании): MnO2 + 4HClконц = MnCl2
- 46. Кислородные соединения Mn4+ Слабовыраженные амфотерные свойства MnO2 + 4HF = MnF4 + 2H2O MnO2 + CaO
- 47. Кислородные соединения Mn2+ MnO – серо-зеленый, не растворим в воде MnCO3 = MnO + CO2 (при
- 48. Соли Mn2+ Водорастворимые соли: MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O – в водных р-рах [Mn(H2O)6]2+ Не растворимые соли: MnCO3,
- 50. Скачать презентацию























![Na15[MoVI126MoV28O462H14(H2O)70] ⋅~400H2O A. Müller, 1996 3.6 nm Гигантское колесо- Mo154](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/495097/slide-25.jpg)
![Наноежик или голубой лимон [HxMo368O1032(H2O)240(SO4)48]48– А. Мюллер, 2002](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/495097/slide-26.jpg)





















 Белки, гормоны, антитела, ферменты
Белки, гормоны, антитела, ферменты Аммиак. Урок 58
Аммиак. Урок 58 Алкены – непредельные углеводороды
Алкены – непредельные углеводороды Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть
Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть  Кислород- история открытия, роль в природе
Кислород- история открытия, роль в природе Фракциялық айдау
Фракциялық айдау Аммиак. Физические и химические свойства. Получение и применение
Аммиак. Физические и химические свойства. Получение и применение Виды химической связи
Виды химической связи Бытовая химия в нашей жизни
Бытовая химия в нашей жизни Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Колообіг нітрогену в природі
Колообіг нітрогену в природі Фенолы. Физические свойства
Фенолы. Физические свойства Презентация по Химии "СТРУКТУРНАЯ ФОРМУЛА КРАХМАЛА" - скачать смотреть
Презентация по Химии "СТРУКТУРНАЯ ФОРМУЛА КРАХМАЛА" - скачать смотреть  Періодична система Менделєєва. Елементи 6 групи
Періодична система Менделєєва. Елементи 6 групи Химия соединения железа
Химия соединения железа ПОЛЕЗНЫЕ ИЛИ ОПАСНЫЕ
ПОЛЕЗНЫЕ ИЛИ ОПАСНЫЕ Изотопы. Химические и физические свойства
Изотопы. Химические и физические свойства Общая геология. Породообразующие минералы
Общая геология. Породообразующие минералы Биологическая химия
Биологическая химия Полиазометины (полишиффовы основания)
Полиазометины (полишиффовы основания) Количество вещества (8 класс)
Количество вещества (8 класс) Тему «Соли». Нитрат серебра(I) AgNO3
Тему «Соли». Нитрат серебра(I) AgNO3 Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Химия в сельском хозяйстве
Химия в сельском хозяйстве Биохимия, как наука
Биохимия, как наука Альдегиды и кетоны
Альдегиды и кетоны Химия
Химия Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов