Содержание
- 2. Нахождение в природе. Среди множества химических элементов, без которых невозможно существование жизни на Земле, углерод является
- 3. Положение в ПСХЭ. Общая характеристика элементов подгруппы углерода. Главную подгруппу IV группы периодической системы Д. И.
- 4. Электронное строение В нормальном состоянии элементы этой подгруппы проявляют валентность, равную 2. При переходе в возбуждённое
- 5. Методы получения: лабораторные и промышленные. Углерод Неполное сжигание метана: СН4 + О2 = С + 2Н2О
- 6. По мере продвижения оксида углерода (IV) снизу вверх последний соприкасается с раскалённым углём: CO2 + C
- 7. Оксид углерода (IV) В промышленности: Побочный продукт при производстве извести: CaCO3 → CaO + CO2↑. В
- 8. Угольная кислота Получают растворением оксида углерода (IV) в воде. Так как угольная кислота очень не прочное
- 9. Кремниевая кислота Получают при действии кислот на растворы её солей. При этом она выпадает в виде
- 10. Аллотропные видоизменения углерода. Углерод существует в трех аллотропных модификациях: алмаз, графит и карбин.
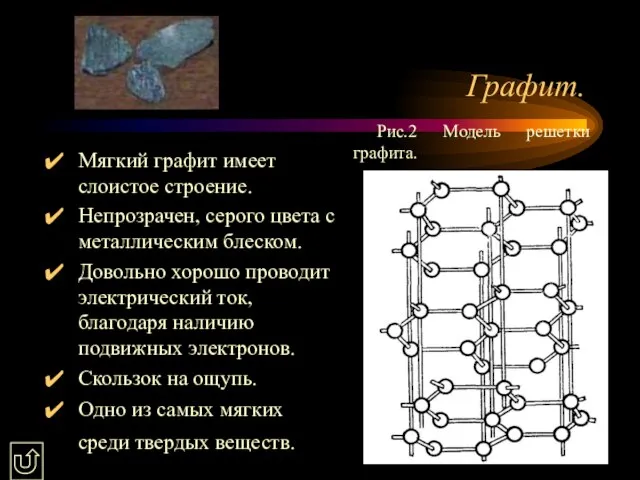
- 11. Графит. Мягкий графит имеет слоистое строение. Непрозрачен, серого цвета с металлическим блеском. Довольно хорошо проводит электрический
- 12. Алмаз. Алмаз - самое твердое природное вещество. Кристаллы алмазов высоко ценятся и как технический материал, и
- 13. Карбин и Зеркальный углерод. Карбин представляет собой порошок глубокого черного цвета с вкраплением более крупных частиц.
- 14. Химические свойства. Щелочи переводят кремний в соли кремниевой кислоты с выделением водорода :Si + 2КОН +
- 15. Карбиды. Соединения углерода с металлами и другими элементами, которые по отношению к углероду являются электроположительными, называются
- 16. Применение. Углерод определяется тем, что свыше 90 % всех первичных источников потребляемой в мире энергии приходится
- 17. Оксид углерода (IV) ✔ Получение сахара. ✔ Тушение пожаров. ✔ Производство фруктовых вод. ✔ «Сухой лёд».
- 18. Оксид кремния (IV) Силикатных кирпичи. Керамические изделия. Стекло.
- 19. Силикаты. Клей.
- 20. Интересный факт. Подземный углерод мог не раз вызвать массовое вымирание на планете и постоянно грозит разразиться
- 22. Скачать презентацию

















 Производство водорода
Производство водорода Хімічні добавки. Е-числа
Хімічні добавки. Е-числа Получение водорода в промышленности и его применение Химия 8 класс
Получение водорода в промышленности и его применение Химия 8 класс Экспертиза шоколада
Экспертиза шоколада Электролиз растворов электролитов урок по химии в 10 классе
Электролиз растворов электролитов урок по химии в 10 классе  Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Серная кислота Михалева Татьяна Сергеевна Учитель химии БОУ г. Омска СОШ №61 2014
Серная кислота Михалева Татьяна Сергеевна Учитель химии БОУ г. Омска СОШ №61 2014  Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез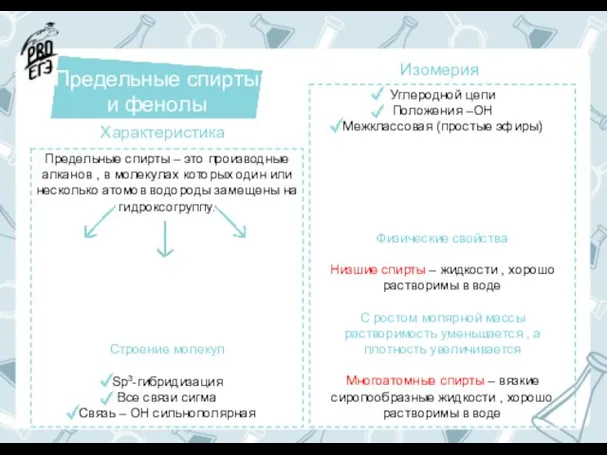 Предельные спирты и фенолы
Предельные спирты и фенолы Причина отказа повреждений технологического оборудования и принятия мер по их устранению установки производства газовой серы
Причина отказа повреждений технологического оборудования и принятия мер по их устранению установки производства газовой серы Структура електронної оболонки атома
Структура електронної оболонки атома Химический состав молока
Химический состав молока Любимый Алюминий
Любимый Алюминий Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Презентация по Химии "Вода для жизни!" - скачать смотреть бесплатно
Презентация по Химии "Вода для жизни!" - скачать смотреть бесплатно Стекло и его разновидности
Стекло и его разновидности Водные свойства и водный режим почв
Водные свойства и водный режим почв Стан, роль і місце органічної хімії в сучасній хімічній освіті.
Стан, роль і місце органічної хімії в сучасній хімічній освіті.  Электролиз. Электролиз хлорида натрия
Электролиз. Электролиз хлорида натрия Методы трансформации карбоновых кислот и их производных
Методы трансформации карбоновых кислот и их производных Цветные металлы и сплавы
Цветные металлы и сплавы Задачи к экзамену по дисциплине «ИПР и ОП»
Задачи к экзамену по дисциплине «ИПР и ОП» Периодическая Система Д. И. Менделеева в свете учения о строении атома
Периодическая Система Д. И. Менделеева в свете учения о строении атома ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 1 полугодие 8 класс Л.И.Настина, учитель химии
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 1 полугодие 8 класс Л.И.Настина, учитель химии  Полимеры. Функции полимеров
Полимеры. Функции полимеров Презентация по Химии "Алкены" - скачать смотреть бесплатно__
Презентация по Химии "Алкены" - скачать смотреть бесплатно__