Содержание
- 2. Алкены
- 3. Студент должен: знать стоение, номенклатуру, свойства, способы получения и применения алкенов умень составлять названия и химические
- 4. Реакции присоединения
- 5. Студент должен: Знать: Уметь:
- 6. Присоединение простых веществ Присоединение водорода – гидрирование, образуются алканы. Присоединение галогенов (+F2, CL2, Br2, I2) –
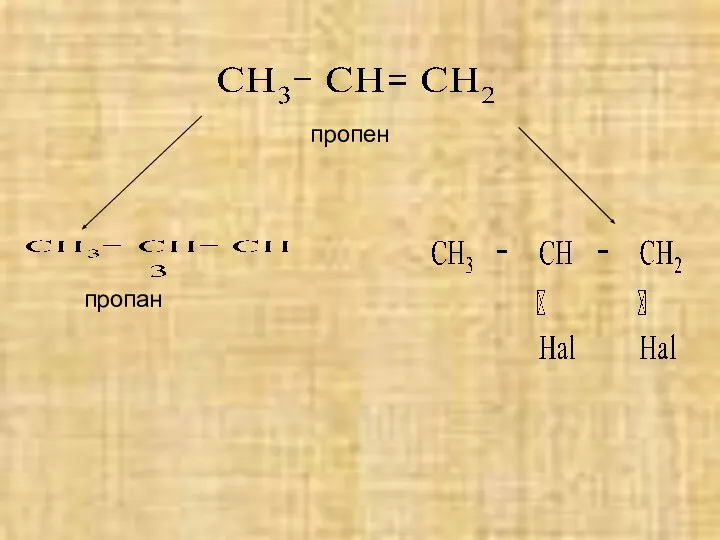
- 7. пропен пропан
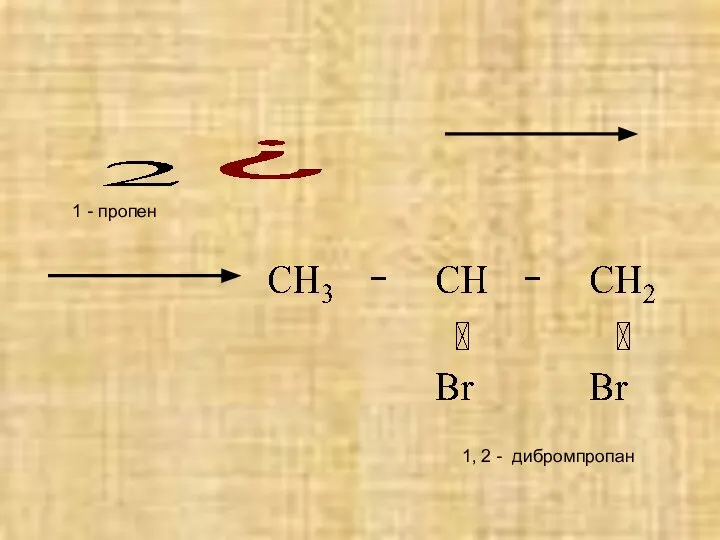
- 8. Качественно реакцией на все непредельные углеводороды, в том числе на алкены, является реакция с бромной водой.
- 9. 1, 2 - дибромпропан 1 - пропен
- 10. Присоединение сложных веществ Присоединение галогеноводородов (+HHal) – гидрогалогенирование, образуются моногалогенфлканы (R-Hal). Присоединение воды (+H2O) – гидратация,
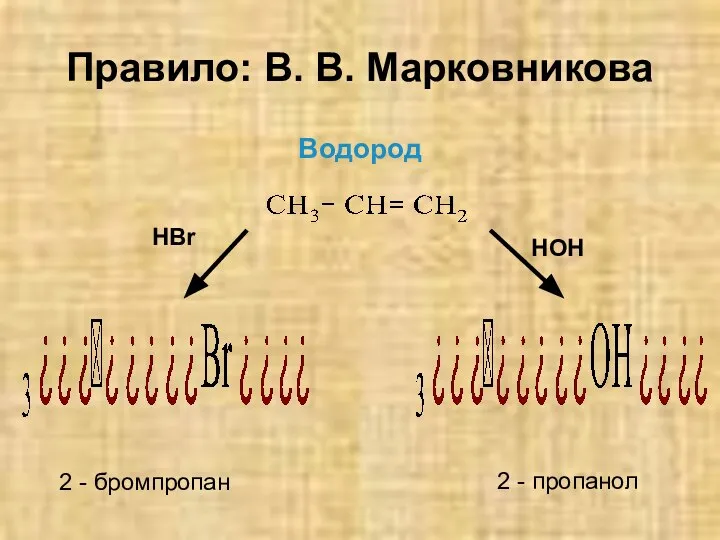
- 11. Присоединение веществ типа НХ (Х=Hal, OH и так далее) к несимметричным алкенам происходит по правилу: В.
- 12. Правило: В. В. Марковникова Атом водорода присоединяется к атому углерода у кратной связи, связанному с большим
- 13. Правило: В. В. Марковникова Водород HBr HOH 2 - бромпропан 2 - пропанол
- 14. Реакции окисления
- 15. Реакция окисления В зависимости от условий непредельные углеводороды окисляются в различной степени.
- 16. Горение. Полное (избыток О2) Неполное (недостаток О2)
- 17. Неполное окисление под действием окислителей типа KMnO4, K2Cr2O7. Одной из наиболее характерных реакций окисления является взаимодействие
- 18. Из KMnO4 1.2 – этандиол Раствор KMnO4 обесцвечивается, происходит гидроксилирование алкенов (введение гидроксогруппы) с образованием диолов
- 19. Реакции полимеризации
- 20. Реакции полимеризации. Процесс полимеризации алкенов открыт А М. Бутлеровым. Полимеризацией называется процесс соединения одинаковых молекул (мономеров),
- 21. Способы получения алкенов. Дегидрирование алканов (- Н2) Гидрирование алкинов (+ Н2) Дегидрирование спиртов (- H2O) Катализаторы:
- 22. При дегидрировании спиртов атом водорода отщепляется от соседнего атома углерода, связанного с наименьшим числом атомов водорода
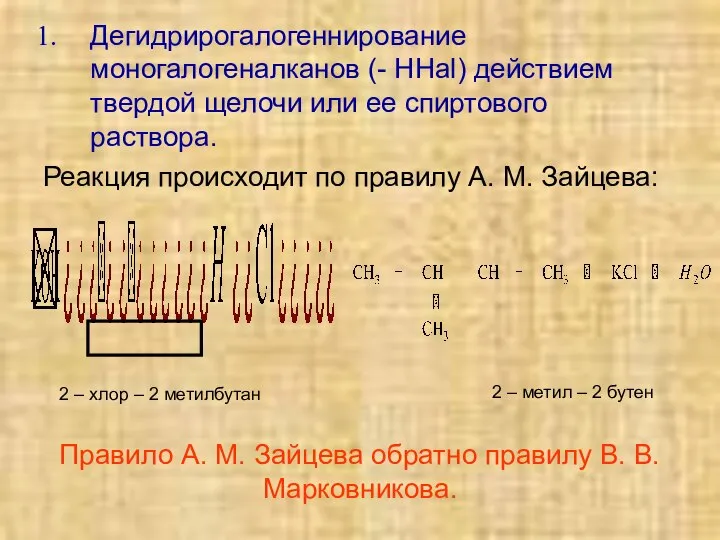
- 23. Дегидрирогалогеннирование моногалогеналканов (- HHal) действием твердой щелочи или ее спиртового раствора. Реакция происходит по правилу А.
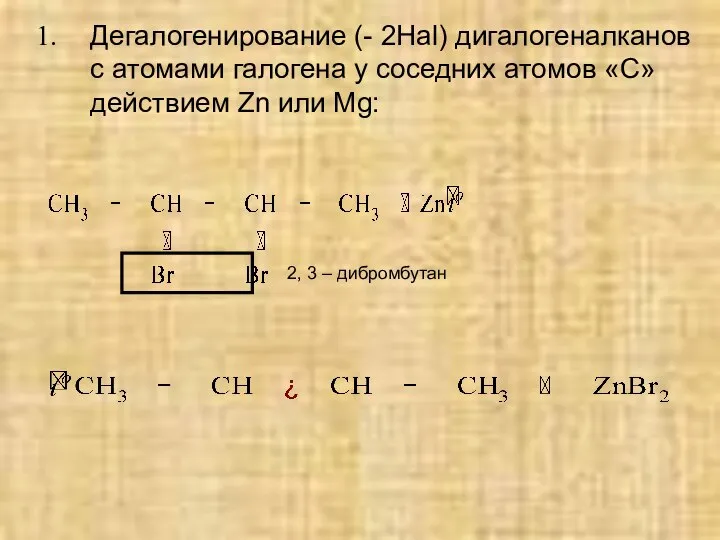
- 24. Дегалогенирование (- 2Hal) дигалогеналканов с атомами галогена у соседних атомов «С» действием Zn или Mg: 2,
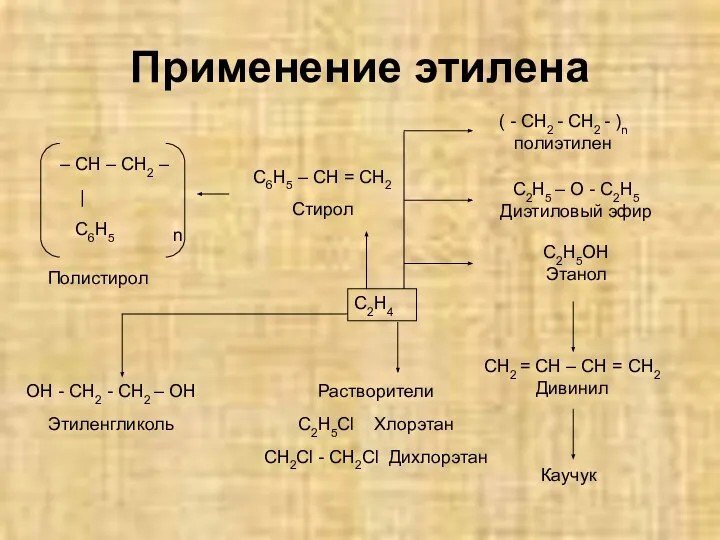
- 25. Применение этилена n
- 27. Скачать презентацию


















 Пищевая сода
Пищевая сода Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра Factors affecting the rate of chemical reaction
Factors affecting the rate of chemical reaction Минералогия с основами кристаллографии
Минералогия с основами кристаллографии Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей КИСЛОРОД
КИСЛОРОД  Оксид фосфора
Оксид фосфора Мыло. Компоненты мыла
Мыло. Компоненты мыла Типы кристаллических структур
Типы кристаллических структур Фосфор. История открытия
Фосфор. История открытия II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид
II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид Мұнайлардың жіктелуі
Мұнайлардың жіктелуі Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Коллигативные свойства растворов
Коллигативные свойства растворов Вивчення особливостей застосування детекторів дорогоцінних каменів та каратомірів
Вивчення особливостей застосування детекторів дорогоцінних каменів та каратомірів Введение в биоорганическую химию Лекция №1. Чуркина Светлана Илларионовна,
Введение в биоорганическую химию Лекция №1. Чуркина Светлана Илларионовна,  Буландырғыш аппараттарының құрылымдары
Буландырғыш аппараттарының құрылымдары Амедео Авогадро (1776-1856)
Амедео Авогадро (1776-1856) Занимательные опыты
Занимательные опыты Программа элективных курсов «Химические реакции в аналитической химии»
Программа элективных курсов «Химические реакции в аналитической химии» Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Восстановление и окисление
Восстановление и окисление Презентация по дисциплине «Химия» на тему: «Сложные эфиры» Автор: Садыгова Елена, студентка группы Т-1 Руководитель: Лебединск
Презентация по дисциплине «Химия» на тему: «Сложные эфиры» Автор: Садыгова Елена, студентка группы Т-1 Руководитель: Лебединск Симметрия кристаллических решеток
Симметрия кристаллических решеток Флавоноидтар
Флавоноидтар Процессы горения. Способы сжигания топлива. Горелочные устройства
Процессы горения. Способы сжигания топлива. Горелочные устройства Оксиды
Оксиды Химия потготовила Шевченко Весна 5”Г”
Химия потготовила Шевченко Весна 5”Г”