Содержание
- 2. Электролиз раствора хлорида меди (II) CuCl2 (-)Катод Cu2+ + 2Cl- Анод(+) восстановление: окисление: Cu2+ +2е- =
- 3. Схема электролиза раствора сульфата меди (II) CuSO4 (-)Катод Cu2+ + SO42- Анод(+) восстановление окисление ионов меди:
- 4. Анодные процессы в водных растворах электролитов
- 5. Изменение восстановительной активности анионов Анионы по их способности окисляться располагаются в следующем порядке: I-, Br-, S2-,
- 6. Электролиз раствора иодида калия KI (-)Катод K+ + I- Анод(+) Восстановление KOH окисление анионов молекул воды:
- 7. Катодные процессы в водных растворах электролитов
- 8. Электролиз раствора сульфата натрия Na2SO4 (-)Катод 2Na+ + SO42- Анод(+) восстановление окисление молекул воды молекул воды
- 9. Применение электролиза Электрометаллургия: а) получение активных металлов (K, Na, Ca, Mg, Al и др.) электролизом расплавов
- 10. Итоговое тестирование 1. Расплав какого вещества подвержен электролизу? а – оксид кальция б – парафин в
- 11. Итоговое тестирование 7. Расставьте анионы в порядке уменьшения их восстановительной активности. Ответ запишите в виде последовательности
- 12. Электролиз раствора поваренной соли
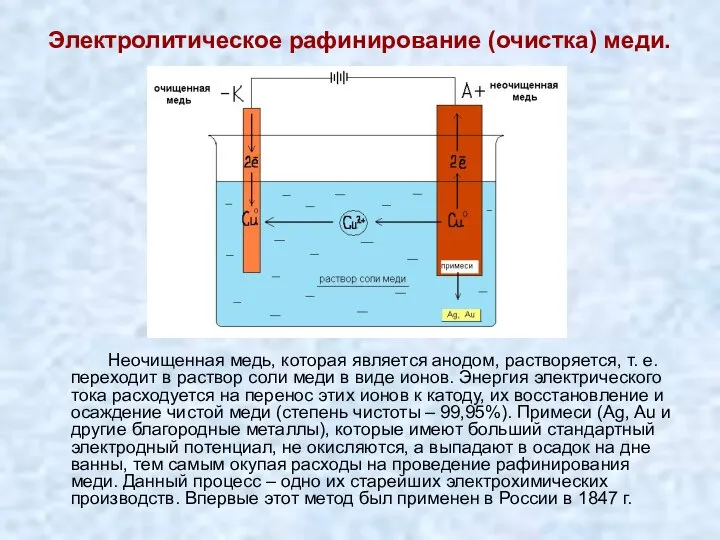
- 13. Электролитическое рафинирование (очистка) меди. Неочищенная медь, которая является анодом, растворяется, т. е. переходит в раствор соли
- 15. Скачать презентацию











 Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Химия в сельском хозяйстве.
Химия в сельском хозяйстве.  Аминспирттер және олардың биологиялық ролі.Элементорганикалық қосылыстар және олардың қасиеті
Аминспирттер және олардың биологиялық ролі.Элементорганикалық қосылыстар және олардың қасиеті Полимеризация бутилена и пропилена
Полимеризация бутилена и пропилена Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Методы анализа вещества
Методы анализа вещества Типы химических реакций в неорганической и органической химии
Типы химических реакций в неорганической и органической химии Синтез и структура медьсодержащих и серебросодержащих соединений пектина и хитозана
Синтез и структура медьсодержащих и серебросодержащих соединений пектина и хитозана Проект – дослідження мило Dove Роботу виконала учениця 11 класу Бабенко Аліна Віталіївна
Проект – дослідження мило Dove Роботу виконала учениця 11 класу Бабенко Аліна Віталіївна  Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Многоликая уксусная кислота
Многоликая уксусная кислота Распознавание химических соединений
Распознавание химических соединений Формирование ответственного отношения школьников к окружающей среде родного края на уроках химии и во внеурочное время.
Формирование ответственного отношения школьников к окружающей среде родного края на уроках химии и во внеурочное время.  Бионеорганическая химия. Комплексообразование в организме. (Лекция 3)
Бионеорганическая химия. Комплексообразование в организме. (Лекция 3) Глюкоза, ее строение и свойства
Глюкоза, ее строение и свойства Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М Лаки. Эмали. Красочные составы
Лаки. Эмали. Красочные составы Презентация по Химии "ЛИПИДНЫЙ ОБМЕН" - скачать смотреть бесплатно
Презентация по Химии "ЛИПИДНЫЙ ОБМЕН" - скачать смотреть бесплатно Строение атома
Строение атома Коррозия железа
Коррозия железа Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман
Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман  Искусственные или технические битумы
Искусственные или технические битумы Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Оксид фосфора P2O5
Оксид фосфора P2O5 Методы выращивания кристаллов
Методы выращивания кристаллов Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Химические свойства алкадиенов и алкинов
Химические свойства алкадиенов и алкинов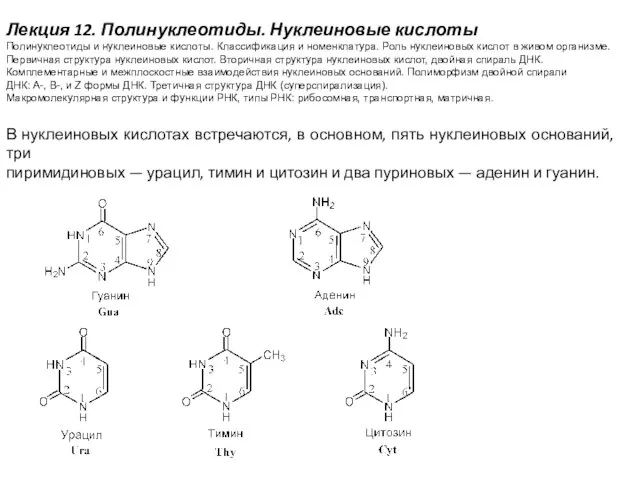 Полинуклеотиды. Нуклеиновые кислоты
Полинуклеотиды. Нуклеиновые кислоты