Содержание
- 2. Общая формула алканов СnH2n+2
- 4. Газы СH4 метан С2H6 этан С3H8 пропан С4H10 бутан
- 5. жидкости С5H12 пентан ….. С15H32 пентадекан
- 6. Твердые вещества Начиная с С16Н34
- 7. Газообразные парафиновые углеводороды входят в состав природных углеводородных газов, которые в зависимости от условий нахождения в
- 8. природные газы газы газоконденсатных месторождений попутные газы
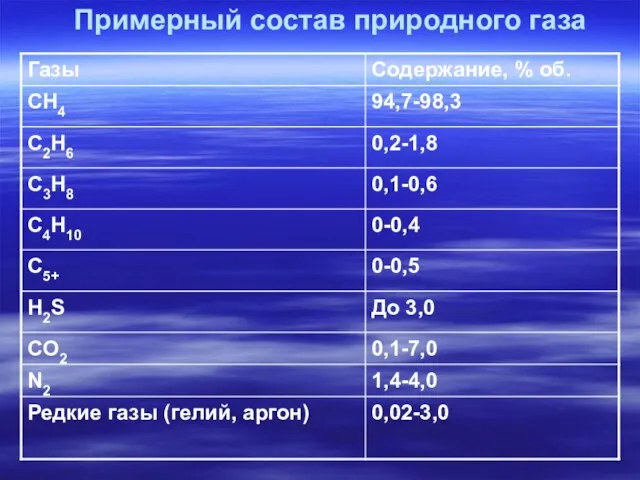
- 9. Примерный состав природного газа
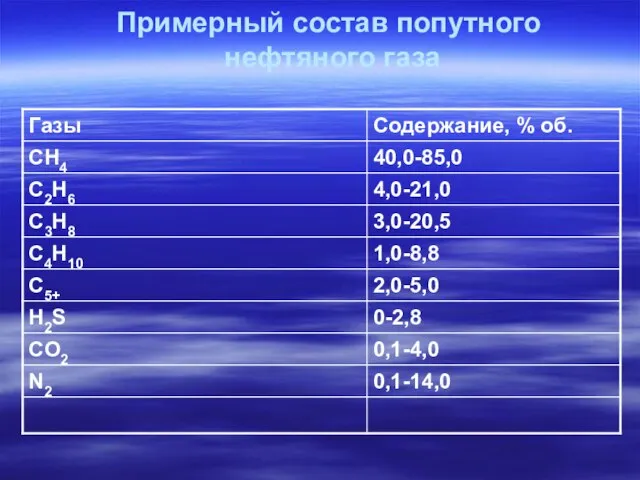
- 10. Примерный состав попутного нефтяного газа
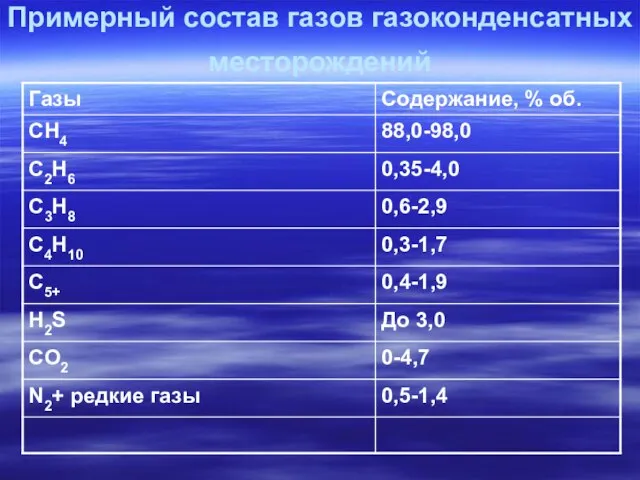
- 11. Примерный состав газов газоконденсатных месторождений
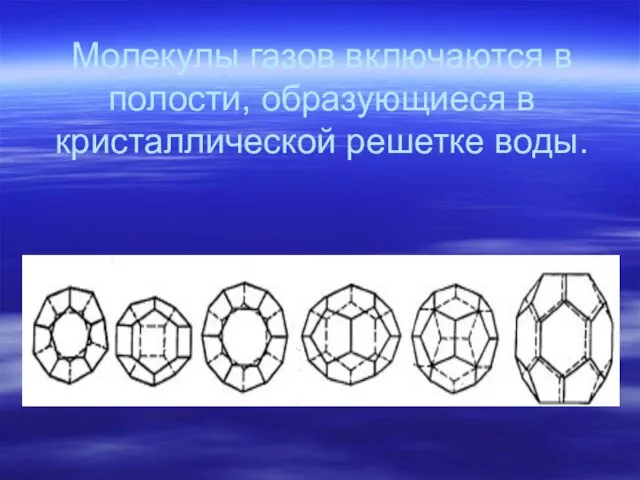
- 12. Газообразные парафины дают комплексы с водой, они называются гидратами природных газов, или соединениями включения, клатратными соединениями.
- 13. Молекулы газов включаются в полости, образующиеся в кристаллической решетке воды.
- 14. Систематическая номенклатура алканов (ИЮПАК; JUPAC; Международный союз теоретической и прикладной химии) 1. Выбирают самую длинную углеродную
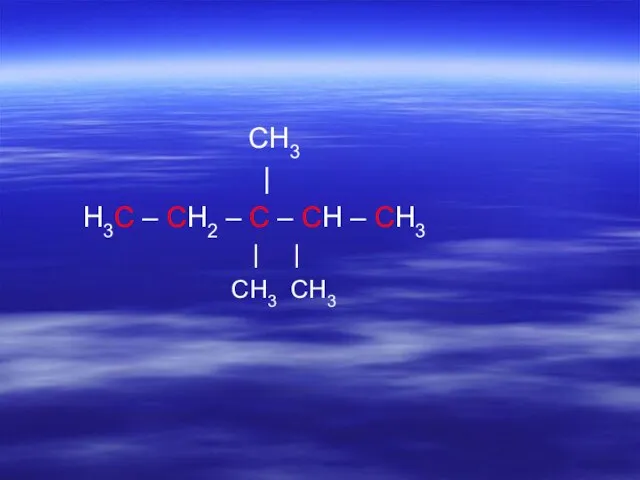
- 15. CH3 | H3C – CH2 – C – CH – CH3 | | CH3 CH3
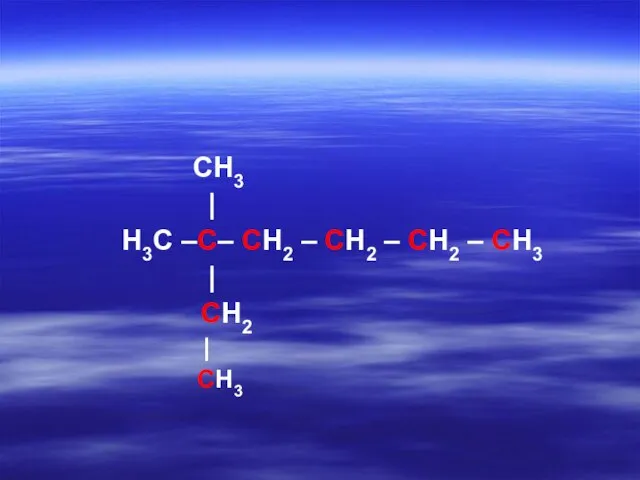
- 16. CH3 | H3C –C– CH2 – CH2 – CH2 – CH3 | CH2 | CH3
- 17. 2. Нумеруют атомы углерода в цепи, с того конца, к которому ближе расположен радикал (одновалентный остаток,
- 18. Формулы и названия радикалов
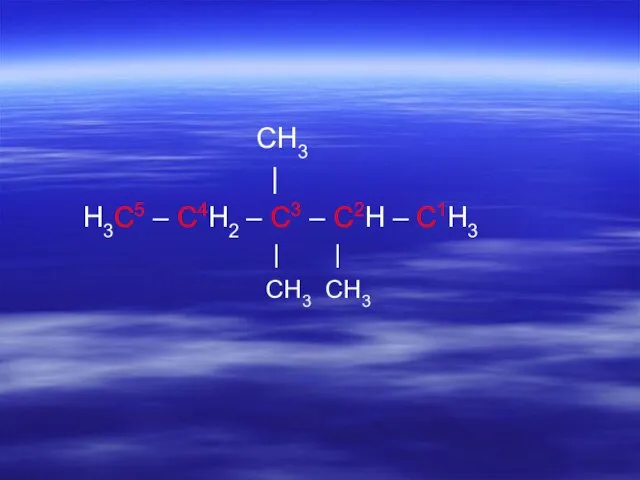
- 19. CH3 | H3C5 – C4H2 – C3 – C2H – C1H3 | | CH3 CH3
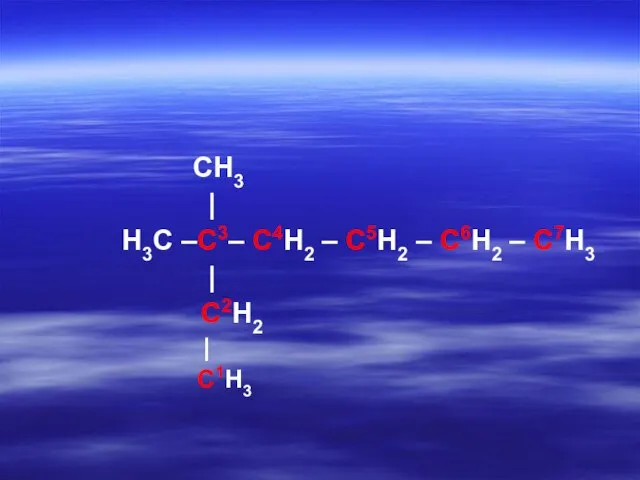
- 20. CH3 | H3C –C3– C4H2 – C5H2 – C6H2 – C7H3 | C2H2 | C1H3
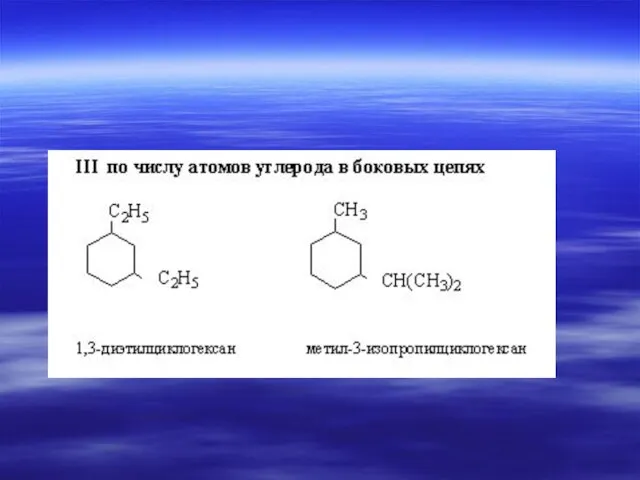
- 21. 3. Перечисляют все радикалы (в порядке возрастания сложности) перед каждым радикалом ставится цифра указывающая номер углерода
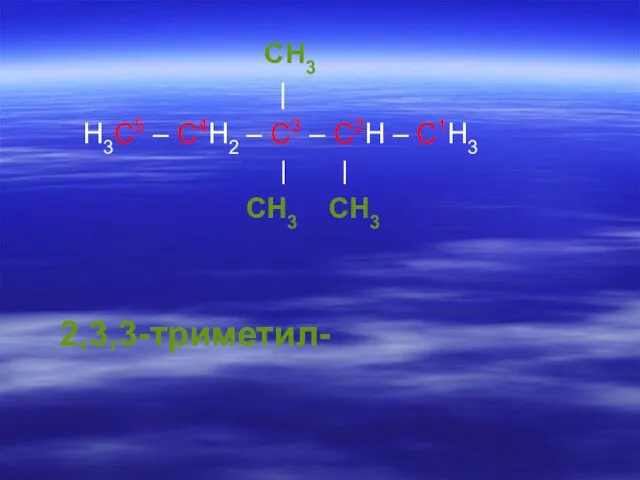
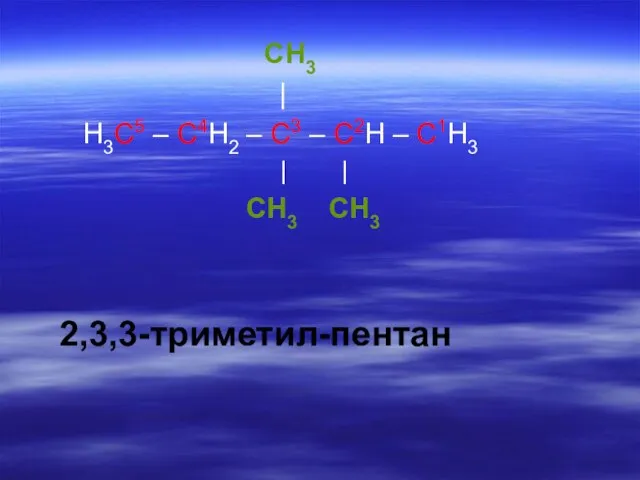
- 22. CH3 | H3C5 – C4H2 – C3 – C2H – C1H3 | | CH3 CH3 2,3,3-триметил-
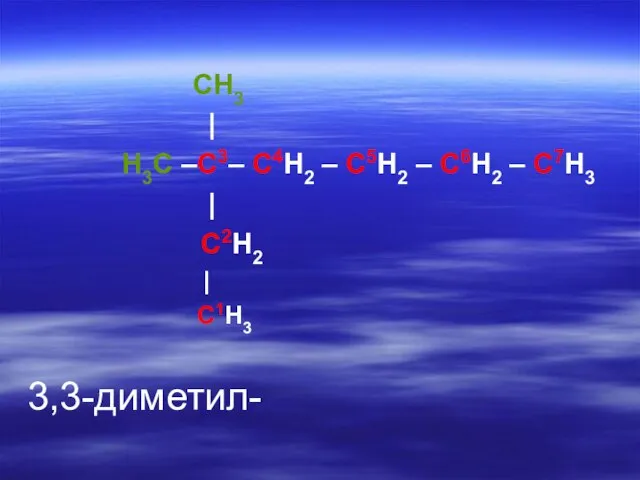
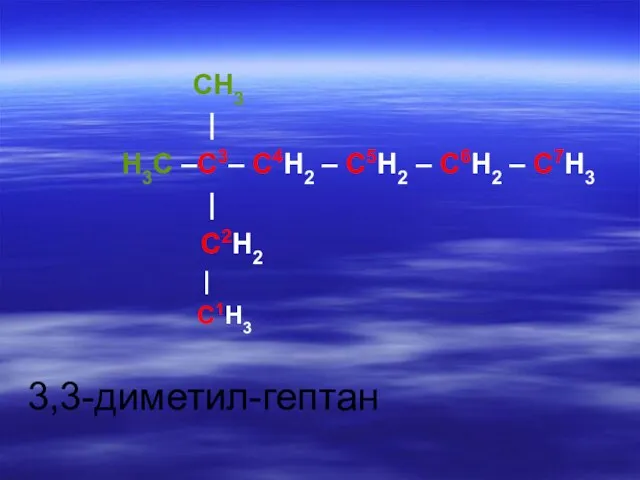
- 23. CH3 | H3C –C3– C4H2 – C5H2 – C6H2 – C7H3 | C2H2 | C1H3 3,3-диметил-
- 24. 4. Дают название пронумерованной цепи, которое соответствует названию нормального алкана, состоящего из такого же числа атомов
- 25. CH3 | H3C5 – C4H2 – C3 – C2H – C1H3 | | CH3 CH3 2,3,3-триметил-пентан
- 26. CH3 | H3C –C3– C4H2 – C5H2 – C6H2 – C7H3 | C2H2 | C1H3 3,3-диметил-гептан
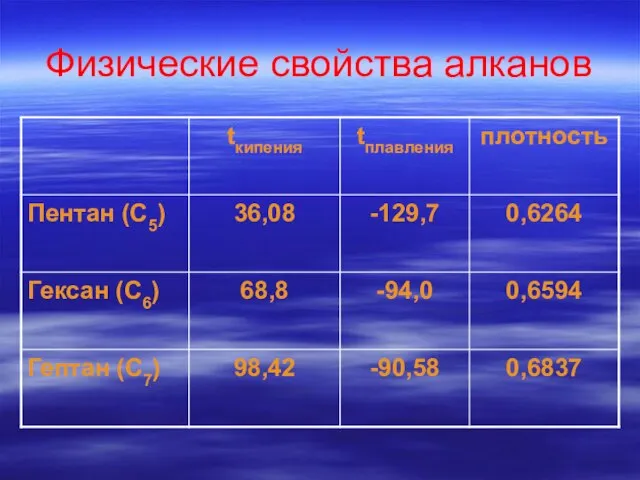
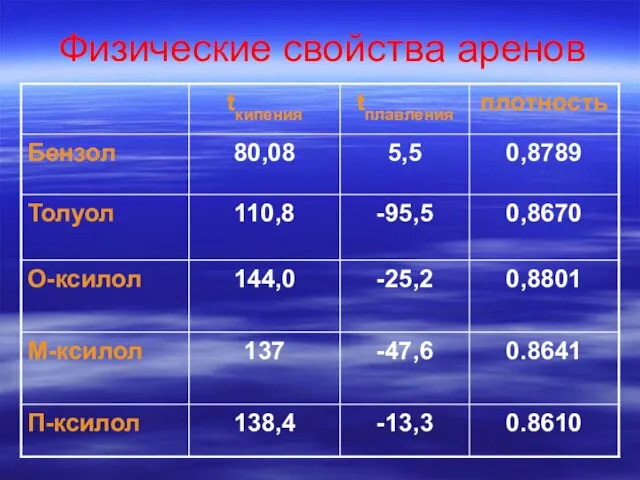
- 27. Физические свойства алканов
- 28. Вывод: Среди алканов нормального строения с ростом числа атомов углерода в молекуле растут: температура кипения температура
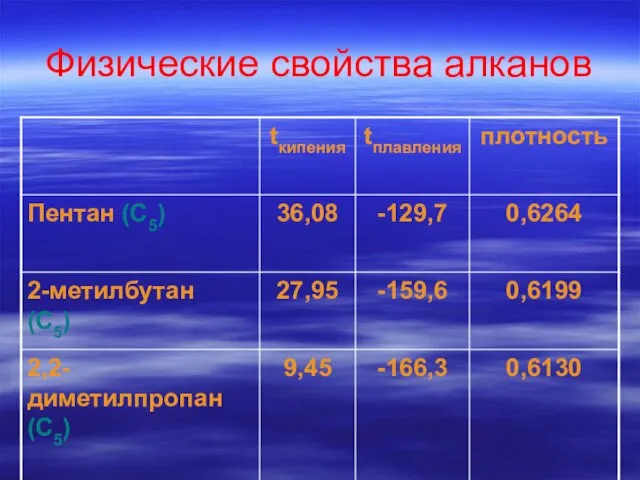
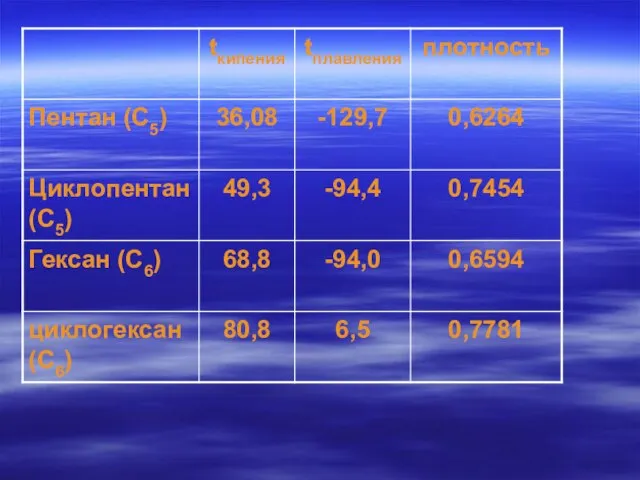
- 29. Физические свойства алканов
- 30. Вывод: Среди алканов одинакового состава, но разного строения минимальными показателями: температура кипения температура плавления плотность обладают
- 31. Углеводороды нефти Циклоалканы. Нафтены. Содержание в нефтях в среднем 25-80%
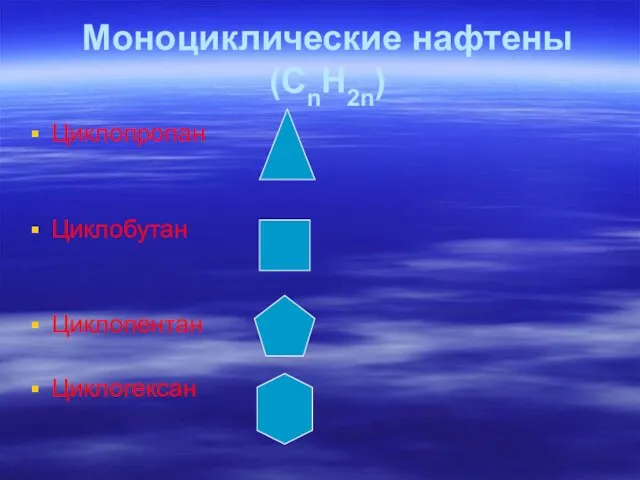
- 32. Циклопропан Циклобутан Циклопентан Циклогексан Моноциклические нафтены (СnH2n)
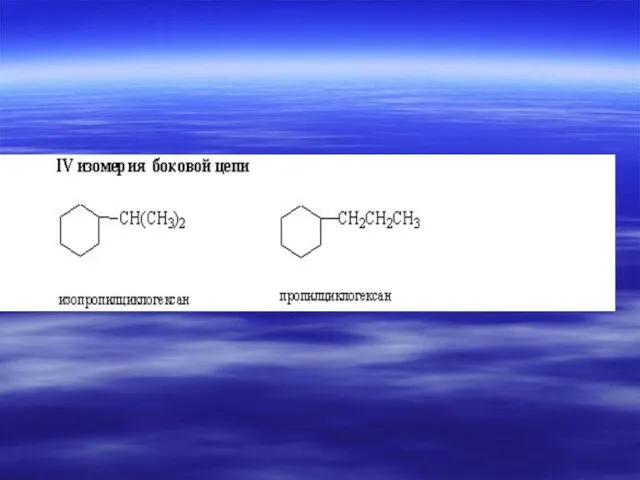
- 33. ИЗОМЕРИЯ
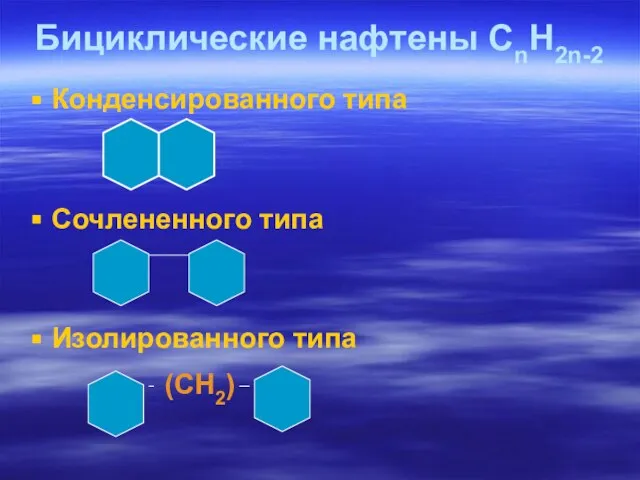
- 37. Бициклические нафтены СnH2n-2 Конденсированного типа Сочлененного типа Изолированного типа (CH2)
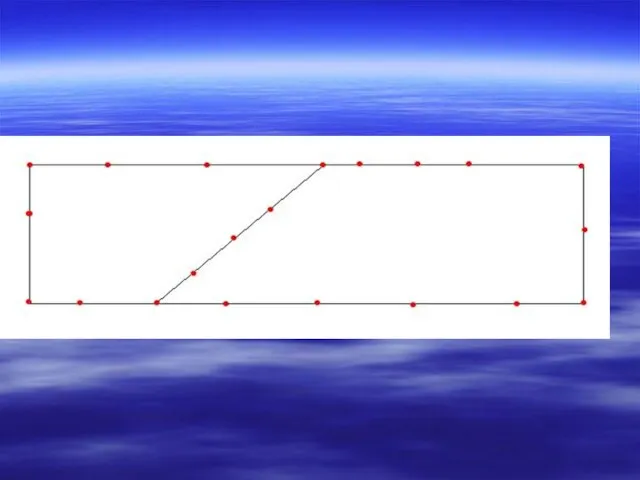
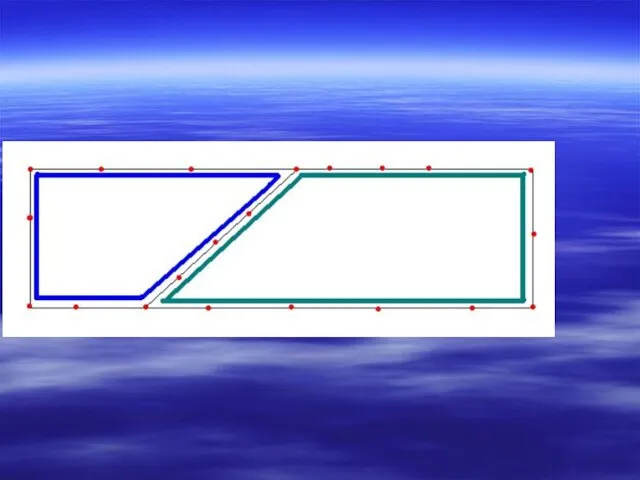
- 38. Мостикового типа
- 43. Спиро спиро [3,4] октан
- 44. Трициклические нафтены CnH2n-4 Пергидроантрацен Пергидрофенантрен адамантан
- 45. Моноциклические нафтены содержатся во фракциях выкипающих до 3000С и содержатся они в основном в бензиновых, керосиновых,
- 46. Физические свойства нафтенов Нафтены имеют более высокие температуры кипения и плавления и показатели преломления, чем соответствующие
- 48. Введение метильной группы в молекулу нафтена резко нарушает симметрию молекулы , что приводит к уменьшению температуры
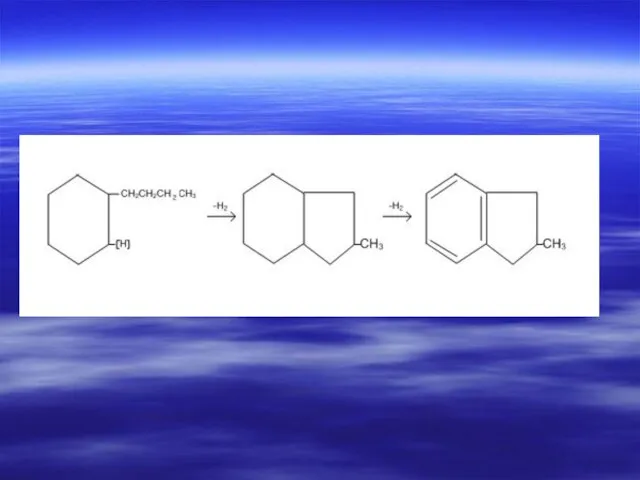
- 49. Химические свойства нафтенов Реакция дегидрогенизации. Реакция была открыта и изучена Н. Д. Зеленским Никола́й Дми́триевич Зели́нский
- 50. Циклогексан и его гомологи в присутствии Pt, Pd при 300 0С дегидрируются до ароматических углеводородов: При
- 51. Образование комплексов с тиомочевинной Нафтеновые углеводороды образуют соединения включения (клатраты) с тиомочевиной NH2CSNH2. Молекулы тиомочевины за
- 52. Изомеризация Алкилпроизводные нафтенов с достаточно длинной углеродной цепью (С3 и более) над платиной при 300 0С
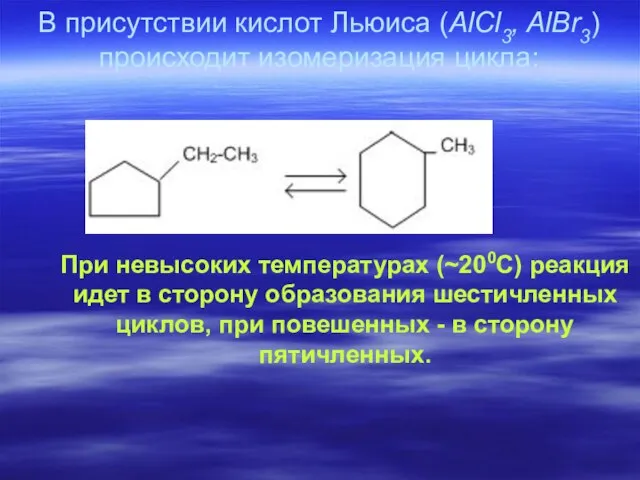
- 54. В присутствии кислот Льюиса (AlCl3, AlBr3) происходит изомеризация цикла: При невысоких температурах (~200С) реакция идет в
- 55. Реакция окисления. Устойчивость к кислороду у нафтенового цикла ниже, чем у ароматического. При окислении нафтеновых углеводородов
- 56. Нафтены имеют более высокие октановые числа чем соответствующие им алканы
- 57. Автомобильные бензины В бензиновых фракциях содержатся моноциклические производные циклопентана и циклогексана; выше 1600С появляются бициклические углеводороды,
- 58. Циклопентан содержится в очень небольших количествах (до 3% на сумму циклопентанов); значительно больше метилциклопентана. Основное количество
- 59. Углеводороды нефти Ароматические углеводороды. Арены. Содержание в нефтях в среднем 10-20%
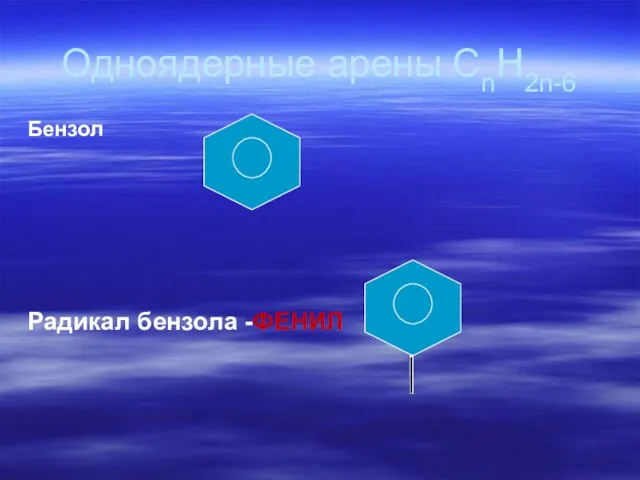
- 60. Одноядерные арены СnH2n-6 Бензол Радикал бензола -ФЕНИЛ
- 61. Толуол Метил-бензол
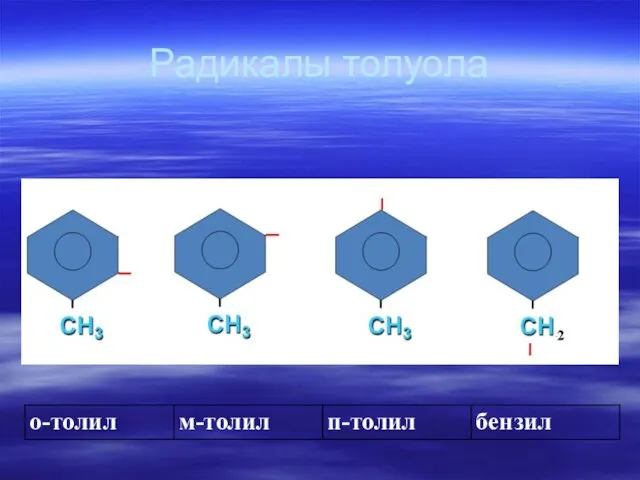
- 62. Радикалы толуола
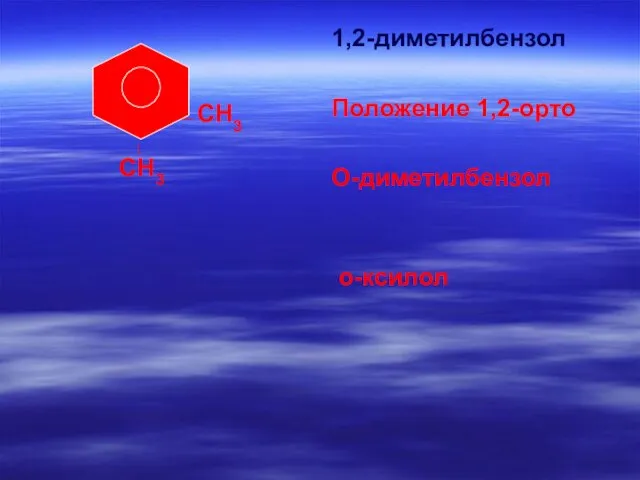
- 63. СН3 1,2-диметилбензол Положение 1,2-орто О-диметилбензол о-ксилол СН3
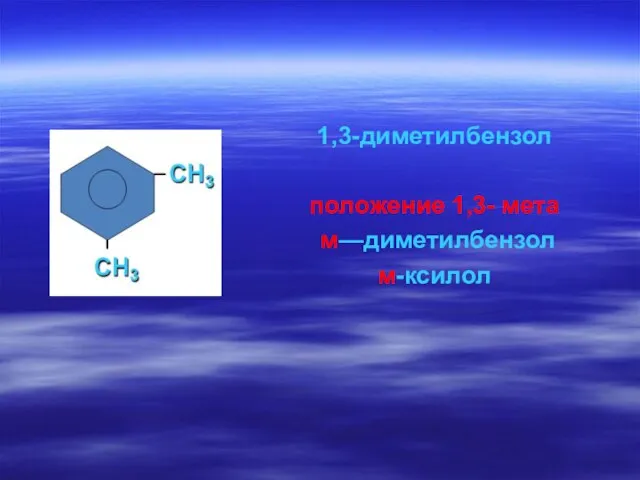
- 64. 1,3-диметилбензол положение 1,3- мета м—диметилбензол м-ксилол
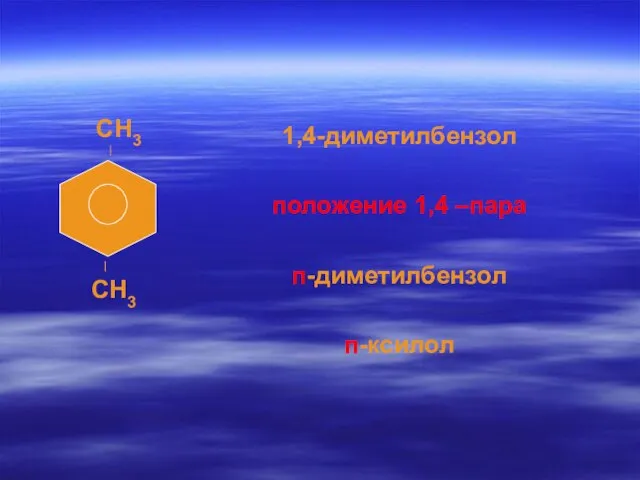
- 65. 1,4-диметилбензол положение 1,4 –пара п-диметилбензол п-ксилол
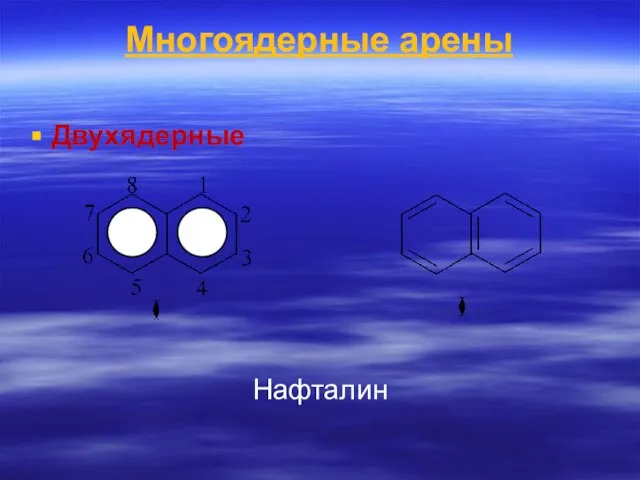
- 66. Многоядерные арены Двухядерные Нафталин
- 67. дифенилметан
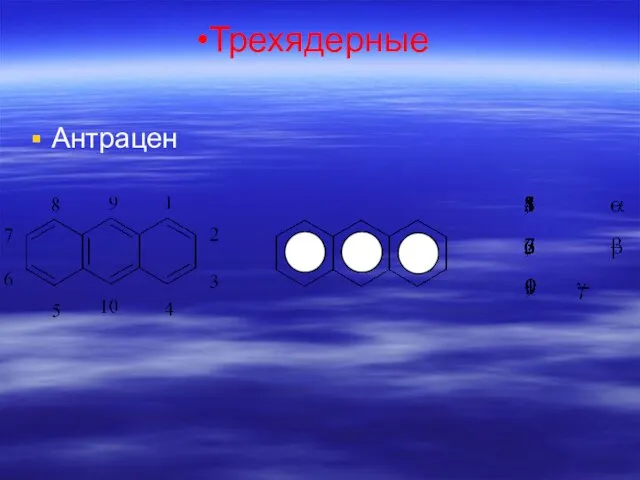
- 68. Трехядерные Антрацен
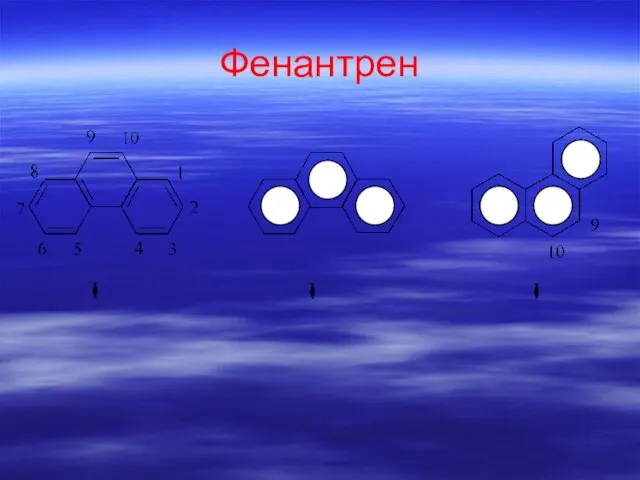
- 69. Фенантрен
- 70. Трифенилметан
- 71. Четырехядерные ХРИЗЕН
- 72. ПИРЕН
- 73. Физические свойства аренов
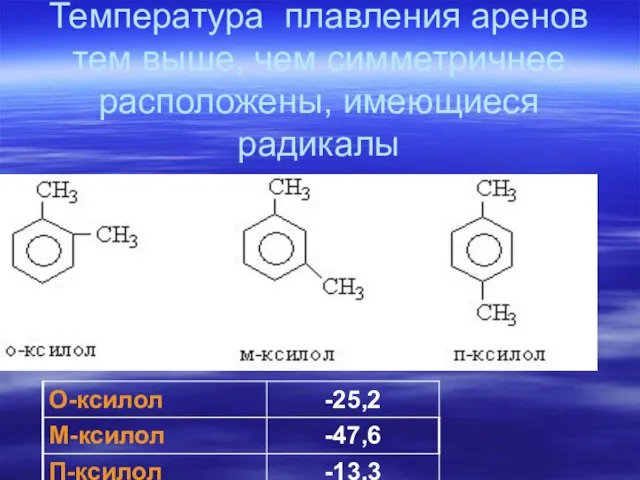
- 74. Температура плавления аренов тем выше, чем симметричнее расположены, имеющиеся радикалы
- 75. На температуру плавления в многоядерных конденсированных системах влияет взаимное расположение колец
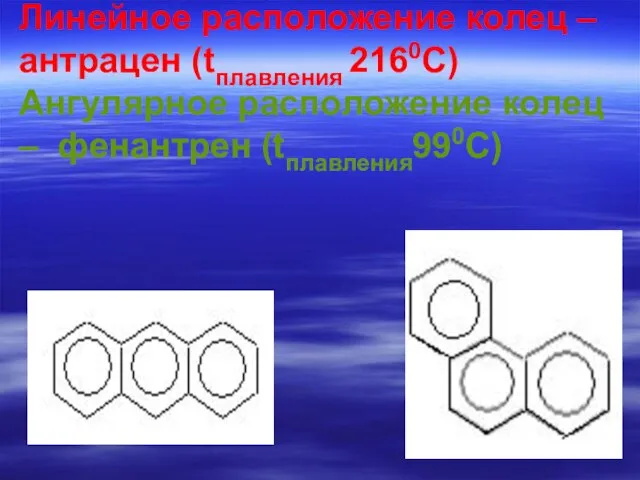
- 76. Линейное расположение колец – антрацен (tплавления 2160С) Ангулярное расположение колец – фенантрен (tплавления990С)
- 77. Окисление бензола Бензол не окисляется при нагревании такими сильными окислителями как концентрированные растворы KMnO4, K2Cr2O7, концентрированной
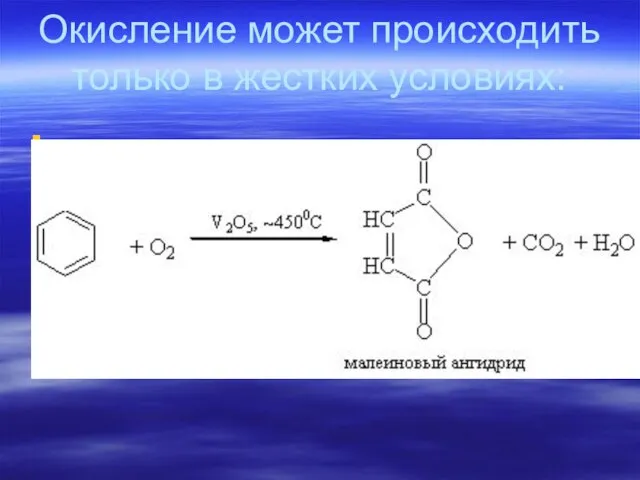
- 78. Окисление может происходить только в жестких условиях:
- 79. Гомологи бензола окисляются значительно легче, чем бензол, по С–Н связям в α-положении радикала.
- 80. Александр Флавианович Добрянский В зависимости от содержания и распределения аренов подразделил нефти на три класса
- 81. Первый класс – с плотностью 0,900 Второй класс - с плотностью 0,850-0,900 Третий класс- с плотностью
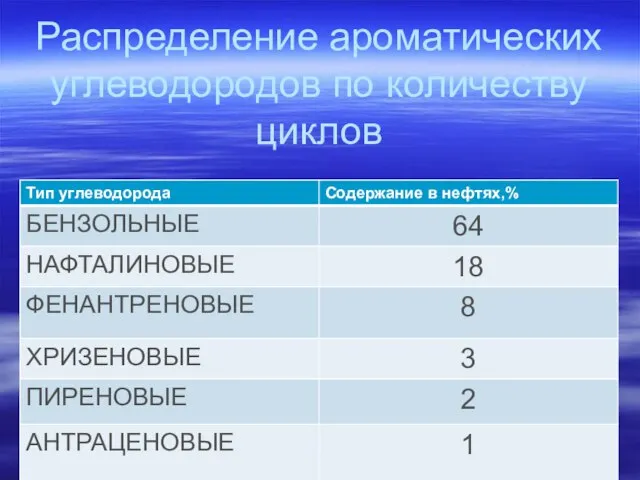
- 82. Распределение ароматических углеводородов по количеству циклов
- 83. В бензиновой фракции нефти Понка-Сити соотношение аренов С6:С7:С8:С9
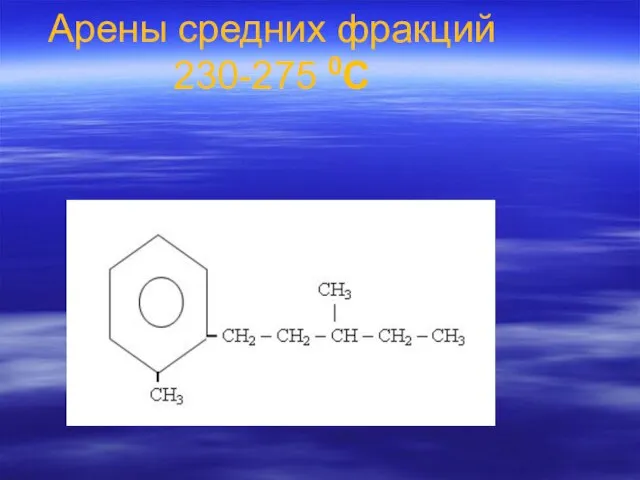
- 84. Арены средних фракций 230-275 0С
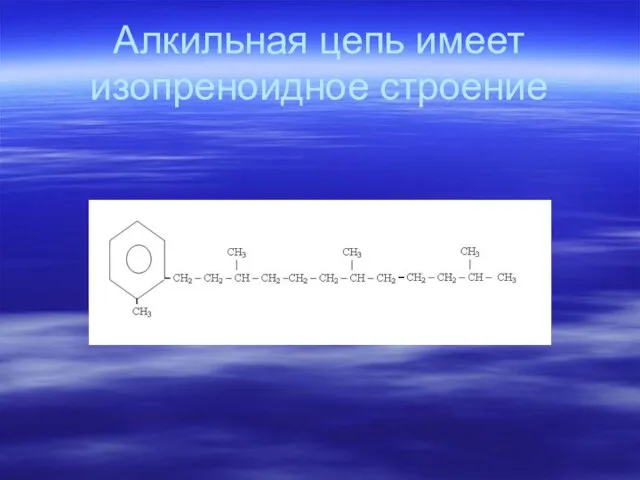
- 85. Алкильная цепь имеет изопреноидное строение
- 87. Скачать презентацию



















![Спиро спиро [3,4] октан](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/554798/slide-42.jpg)
























 Карбоновые кислоты
Карбоновые кислоты Цікаві досліди з хімії
Цікаві досліди з хімії История развития химии
История развития химии Кислородосодержащие соединения - спирты
Кислородосодержащие соединения - спирты Желім беріктігіне әсер ететін факторларды зерттеу
Желім беріктігіне әсер ететін факторларды зерттеу Исследование качества питьевой воды в г. Кашира-8 и способы снижения ее общей жесткости
Исследование качества питьевой воды в г. Кашира-8 и способы снижения ее общей жесткости Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Углерод и его оксиды
Углерод и его оксиды ГИА-9 Химия. А1
ГИА-9 Химия. А1 Презентация по Химии "Презентация Химический состав растений" - скачать смотреть
Презентация по Химии "Презентация Химический состав растений" - скачать смотреть  Мило та його склад
Мило та його склад  Как вести себя при встрече с агрессивными собаками Как вести себя при встрече с агрессивными собаками
Как вести себя при встрече с агрессивными собаками Как вести себя при встрече с агрессивными собаками Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер
Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер Тела. Вещества. Частицы. Разнообразие веществ
Тела. Вещества. Частицы. Разнообразие веществ Урок по химии в 10 классе: «Углерод и кремний – р-элементы IVA-группы» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Ко
Урок по химии в 10 классе: «Углерод и кремний – р-элементы IVA-группы» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Ко Автомобильные пластичные смазки
Автомобильные пластичные смазки Origin of petroleum dilemma
Origin of petroleum dilemma Метаморфические породы
Метаморфические породы Periodic Table: It’s Elementary
Periodic Table: It’s Elementary Расчеты по уравнениям химической реакции
Расчеты по уравнениям химической реакции Презентация по Химии "Готовимся к экзамену по химии" - скачать смотреть
Презентация по Химии "Готовимся к экзамену по химии" - скачать смотреть  Презентация Коррозия
Презентация Коррозия Класифікація оксидів. Оксиди в природі, їх використання та фізичні властивості.
Класифікація оксидів. Оксиди в природі, їх використання та фізичні властивості.  Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Генетическая связь основных классов неорганических соединений
Генетическая связь основных классов неорганических соединений Алмаз
Алмаз Методы окислительно-восстановительного титрования (Редоксиметрия)
Методы окислительно-восстановительного титрования (Редоксиметрия) Газы, применяемые для резки и сварки металла
Газы, применяемые для резки и сварки металла