Содержание
- 2. Мета. Познайомити з класифікацією оксидів, закріпити навички складання формул оксидів та їх назв. Розглянути поширення оксидів
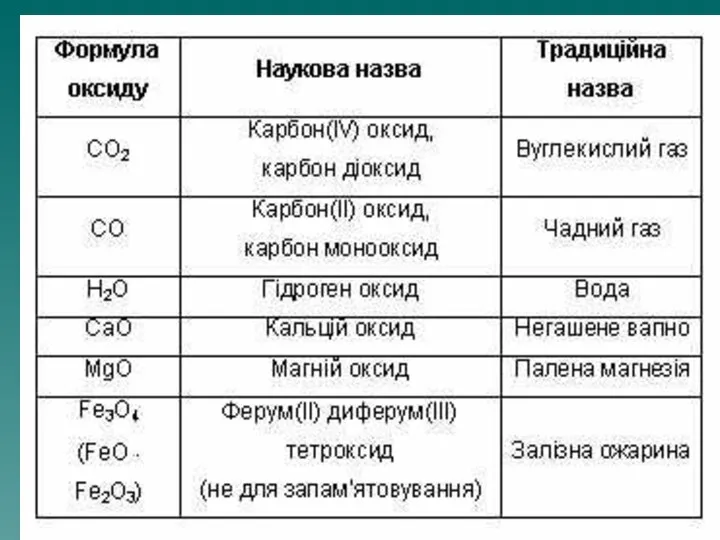
- 3. Оксид – це складна речовина, одна з яких кисень.
- 7. Оксиди, яким відповідають основи (незалежно від того, чи реагують вони з водою чи ні), називають основними
- 11. Оксиди, яким відповідають кислоти (незалежно від того, реагують вони з водою чи ні), називаються кислотними. Оксиди
- 14. Поширення у природі Оксиди багатьох елементів дуже поширені в природі. Як ти гадаєш, чому? Наприклад, така
- 15. Вода – це найдивовижніша, найпоширеніша і найнеобхідніша речовина на нашій планеті. Багато води перебуває у газуватому
- 16. Більшість оксидів, а саме оксиди елементів-металів, має немолекулярну будову і дуже високу температуру плавлення. Такі оксиди
- 18. Одержання оксидів Взаємодія простих і складних речовин з киснем: 2Mg + O2 → 2MgО 4P +
- 19. Поэтому важнейшим применением оксидов металлов является их восстановление. Например, в доменной печи происходит восстановление оксидов железа
- 21. Скачать презентацию
Слайд 2
Мета.
Познайомити з класифікацією оксидів, закріпити навички складання формул оксидів та їх
Мета.
Познайомити з класифікацією оксидів, закріпити навички складання формул оксидів та їх
назв.
Розглянути поширення оксидів у природі, їх фізичні властивості та використання.
Розглянути поширення оксидів у природі, їх фізичні властивості та використання.
Слайд 3
Оксид – це складна речовина, одна з яких кисень.
Оксид – це складна речовина, одна з яких кисень.
Слайд 4
Слайд 5
Слайд 6
Слайд 7
Оксиди, яким відповідають основи (незалежно від того, чи реагують вони з
Оксиди, яким відповідають основи (незалежно від того, чи реагують вони з
водою чи ні), називають основними
Це оксиди які утворені металом
CaO + H2О = Ca(OH)2
Na2O + H2О = 2 NaOH
Це оксиди які утворені металом
CaO + H2О = Ca(OH)2
Na2O + H2О = 2 NaOH
Слайд 8
Слайд 9
Слайд 10
Слайд 11
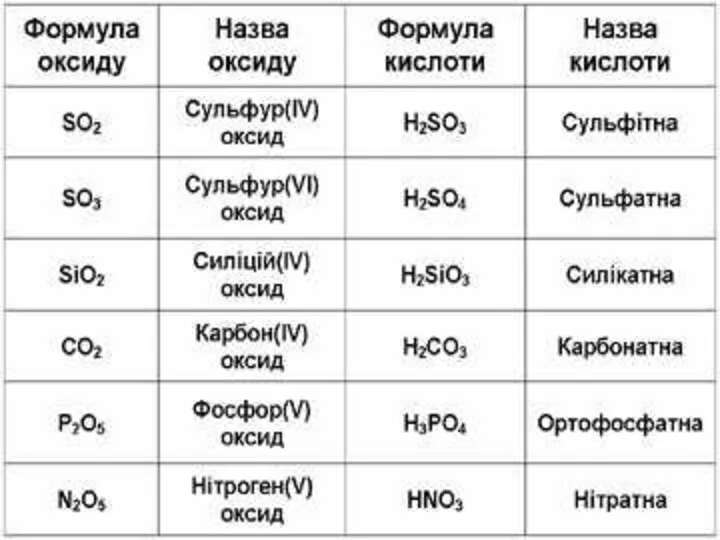
Оксиди, яким відповідають кислоти (незалежно від того, реагують вони з водою
Оксиди, яким відповідають кислоти (незалежно від того, реагують вони з водою
чи ні), називаються кислотними.
Оксиди утворені неметалом
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3 (спрощено)
P2O5 + ЗН2О = 2H3PO4
Оксиди утворені неметалом
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3 (спрощено)
P2O5 + ЗН2О = 2H3PO4
Слайд 12
Слайд 13
Слайд 14
Поширення у природі
Оксиди багатьох елементів дуже поширені в природі. Як ти
Поширення у природі
Оксиди багатьох елементів дуже поширені в природі. Як ти
гадаєш, чому?
Наприклад, така добре відома сполука, як звичайний річковий пісок (з деякими домішками) є оксидом з формулою SiO2 – силіцій(IV) оксид (кремнезем).
Майже чистим кремнеземом є гірський кришталь.
Цей оксид разом з алюміній оксидом Al2O3 входить до складу глин та багатьох інших мінералів.
З руд, які містять алюміній оксид Al2O3, виплавляють алюміній.
Звичайний наждак – це також алюміній оксид з домішками.
Алюміній оксид з невеликим вмістом різних домішок може бути і коштовним каменем (рубін, сапфір).
Дуже поширені в природі й оксиди Феруму – це різні залізні руди. Україна має великі запаси залізних руд (Криворізьке та Керченське родовища).
До складу повітря входить карбон(IV) оксид СО2 (вуглекислий газ), об’ємна частка якого в повітрі становить 0,3 %.
Однак найпоширенішим оксидом у природі є гідроген оксид Н2О (вода).
Наприклад, така добре відома сполука, як звичайний річковий пісок (з деякими домішками) є оксидом з формулою SiO2 – силіцій(IV) оксид (кремнезем).
Майже чистим кремнеземом є гірський кришталь.
Цей оксид разом з алюміній оксидом Al2O3 входить до складу глин та багатьох інших мінералів.
З руд, які містять алюміній оксид Al2O3, виплавляють алюміній.
Звичайний наждак – це також алюміній оксид з домішками.
Алюміній оксид з невеликим вмістом різних домішок може бути і коштовним каменем (рубін, сапфір).
Дуже поширені в природі й оксиди Феруму – це різні залізні руди. Україна має великі запаси залізних руд (Криворізьке та Керченське родовища).
До складу повітря входить карбон(IV) оксид СО2 (вуглекислий газ), об’ємна частка якого в повітрі становить 0,3 %.
Однак найпоширенішим оксидом у природі є гідроген оксид Н2О (вода).
Слайд 15
Вода – це найдивовижніша, найпоширеніша і найнеобхідніша речовина на нашій планеті.
Багато
Вода – це найдивовижніша, найпоширеніша і найнеобхідніша речовина на нашій планеті.
Багато
води перебуває у газуватому стані в атмосфері. У вигляді великих мас снігу і криги лежить вода цілорічно на вершинах високих гір і в полярних країнах. У надрах Землі також є вода, що просочує грунт і гірські породи. Воді належить найважливіша роль у геологічній історії нашої планети.
Вода має велике значення у промисловості, вона незамінний компонент практично всіх технологічних процесів. На виробництво 1 т сталі, наприклад, витрачається 300 м3 води, 1 т паперу – 900 м3, 1 т хімічного волокна – понад 2000 м3.
У всякому організмі вода є середовищем, в якому відбуваються хімічні процеси, що забезпечують життєдіяльність організму, і сама вода бере участь у багатьох біохімічних реакціях. Відомо, що масова частка води в організмі людини становить 65 %.
Вода має велике значення у промисловості, вона незамінний компонент практично всіх технологічних процесів. На виробництво 1 т сталі, наприклад, витрачається 300 м3 води, 1 т паперу – 900 м3, 1 т хімічного волокна – понад 2000 м3.
У всякому організмі вода є середовищем, в якому відбуваються хімічні процеси, що забезпечують життєдіяльність організму, і сама вода бере участь у багатьох біохімічних реакціях. Відомо, що масова частка води в організмі людини становить 65 %.
Слайд 16
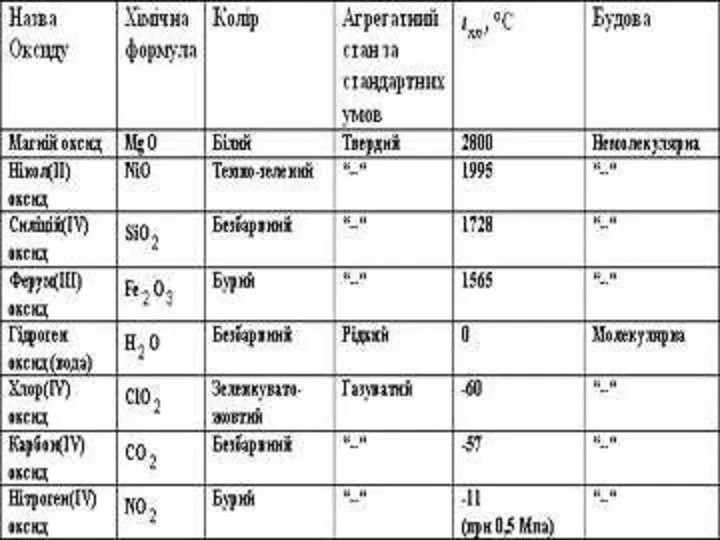
Більшість оксидів, а саме оксиди елементів-металів, має немолекулярну будову і дуже
Більшість оксидів, а саме оксиди елементів-металів, має немолекулярну будову і дуже
високу температуру плавлення. Такі оксиди – тверді речовини.
Деякі оксиди (оксиди елементів-неметалів) мають молекулярну будову і за стандартних умов перебувають в рідкому або газуватому стані.
Деякі оксиди (оксиди елементів-неметалів) мають молекулярну будову і за стандартних умов перебувають в рідкому або газуватому стані.
фізичні властивості оксидів
Слайд 17
Слайд 18
Одержання оксидів
Взаємодія простих і складних речовин з киснем:
2Mg + O2 →
Одержання оксидів
Взаємодія простих і складних речовин з киснем:
2Mg + O2 →
2MgО
4P + 5O2 → 2P2O5
S + O2 → SO2
2CO + O2 → 2CO2
2CuS + 3O2 → 2CuO + 2SO2
CH4 + 2O2 → CO2 + 2H2O
4NH3 + 5O2 –кат.→ 4NO + 6H2O
Розкладання деяких кислородсодержащих речовин (основ, кислот, солей) при нагріванні:
Cu(OH)2 –t°→ CuO+ H2O
(CuОН)2CO3 –t°→ 2Cuo + CO2 + H2O
2Pb(NO3)2 –t°→ 2PbO + 4NO2 + O2
2HMnO4 –t°;H2SO4(конц.) Mn2O7 + H2O
4P + 5O2 → 2P2O5
S + O2 → SO2
2CO + O2 → 2CO2
2CuS + 3O2 → 2CuO + 2SO2
CH4 + 2O2 → CO2 + 2H2O
4NH3 + 5O2 –кат.→ 4NO + 6H2O
Розкладання деяких кислородсодержащих речовин (основ, кислот, солей) при нагріванні:
Cu(OH)2 –t°→ CuO+ H2O
(CuОН)2CO3 –t°→ 2Cuo + CO2 + H2O
2Pb(NO3)2 –t°→ 2PbO + 4NO2 + O2
2HMnO4 –t°;H2SO4(конц.) Mn2O7 + H2O
Слайд 19
Поэтому важнейшим применением оксидов металлов является их восстановление. Например, в доменной
Поэтому важнейшим применением оксидов металлов является их восстановление. Например, в доменной
печи происходит восстановление оксидов железа с образованием металлического железа:
Fe3O4 + CO = 3FeO + CO2
FeO + CO = Fe + CO2
Химические свойства оксидов далеко не исчерпываются приведенными примерами. Более подробно с их свойствами мы познакомимся в последней главе – при изучении основных классов соединений.
** Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
SO3 + H2O = H2SO4
CaO + H2O = H2CaO2 или Ca(OH)2
В результате часто получаются очень нужные и полезные соединения. Например, H2SO4 – серная кислота, Са(ОН)2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr2O3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это – далеко не единственное их применение.
Fe3O4 + CO = 3FeO + CO2
FeO + CO = Fe + CO2
Химические свойства оксидов далеко не исчерпываются приведенными примерами. Более подробно с их свойствами мы познакомимся в последней главе – при изучении основных классов соединений.
** Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
SO3 + H2O = H2SO4
CaO + H2O = H2CaO2 или Ca(OH)2
В результате часто получаются очень нужные и полезные соединения. Например, H2SO4 – серная кислота, Са(ОН)2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr2O3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это – далеко не единственное их применение.














 Задачи на смеси и сплавы. Метод Пирсона
Задачи на смеси и сплавы. Метод Пирсона Презентация по Химии "Уран" - скачать смотреть
Презентация по Химии "Уран" - скачать смотреть  Уравнение Г-Х-К для мембранного потенциала
Уравнение Г-Х-К для мембранного потенциала Углерод. 9 класс
Углерод. 9 класс Игра «Химические элементы» (формулы и названия)
Игра «Химические элементы» (формулы и названия) Псевдовідкриття хімічних елементів
Псевдовідкриття хімічних елементів Кадмий (Cadmium)
Кадмий (Cadmium) Инсулинотерапия
Инсулинотерапия Кремень –камень 1824г.Я. Берцелиус
Кремень –камень 1824г.Я. Берцелиус  Презентация по Химии "Полимеры" 10 класс
Презентация по Химии "Полимеры" 10 класс Иммунохимические методы детекции
Иммунохимические методы детекции Озоновый слой. Механизмы образования и разрушения
Озоновый слой. Механизмы образования и разрушения Гормоны. Природа. Биохимические эффекты. (Тема 4)
Гормоны. Природа. Биохимические эффекты. (Тема 4) Термические превращения алкенов
Термические превращения алкенов Вольфрам және молибден
Вольфрам және молибден Природний газ
Природний газ Термодинамика и теплопередача. Реальные газы
Термодинамика и теплопередача. Реальные газы ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ  Химия и производство
Химия и производство Влияние растворителей на скорость органических реакций. (Лекция 10)
Влияние растворителей на скорость органических реакций. (Лекция 10) Презентация по Химии "Химическая связь (8 класс)" - скачать смотреть бесплатно
Презентация по Химии "Химическая связь (8 класс)" - скачать смотреть бесплатно Неравновесные явления в растворах электролитов
Неравновесные явления в растворах электролитов Теория химического строения органических веществ А М. Бутлерова
Теория химического строения органических веществ А М. Бутлерова Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Різноманіття карбонових кислот
Різноманіття карбонових кислот Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Соединения химических элементов
Соединения химических элементов Круговорот азота в природе
Круговорот азота в природе