Содержание
- 2. ВОДОРОД
- 3. Тест: общие сведения о водороде Необходимо выбрать правильные утверждения. Если вы согласны с утверждением, ставьте напротив
- 4. Определите, в каком из предложений речь идёт о химическом элементе, а в каком о простом веществе?
- 5. При помощи каких реакций можно получить водород, к какому типу относятся эти реакции? 2) Какими методами
- 6. Водород – самый распространенный химический элемент во Вселенной, является составной частью Солнца и звезд. В земной
- 7. Получение водорода Водород можно получить из природного газа, разложением воды, взаимодействием металлов с кислотами, взаимодействием активных
- 8. ТЕМА УРОКА «ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА И ЕГО ПРИМЕНЕНИЕ» Задачи:
- 9. Объясните, почему мыльные пузыри, заполненные водородом, поднимаются в вверх.
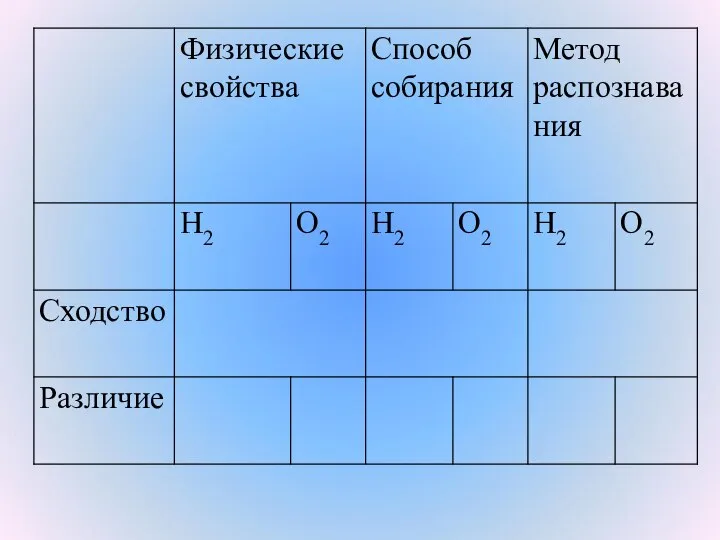
- 10. Физические свойства водорода Водород – бесцветный, самый легкий газ, в 14,5 раз легче воздуха. Нерастворим в
- 12. Химические свойства
- 13. Горение водорода 2H2 + O2= 2H2O 2 объема Н2 и 1 объем О2 – «гремучий газ»
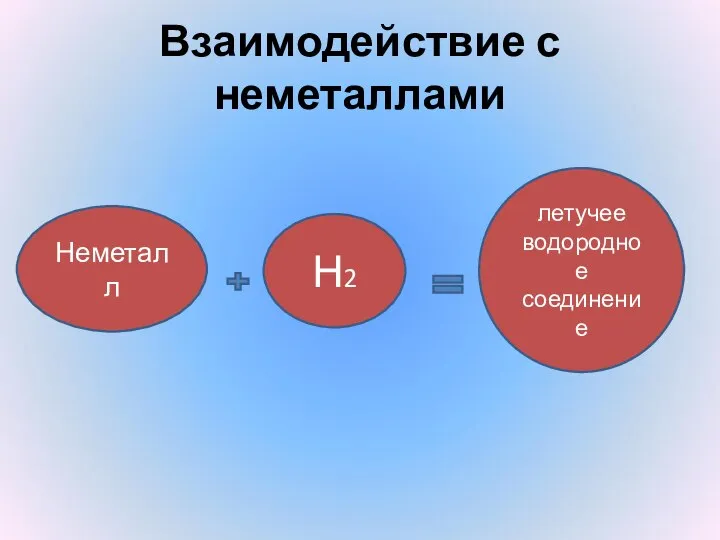
- 14. Взаимодействие с неметаллами Неметалл Н2 летучее водородное соединение
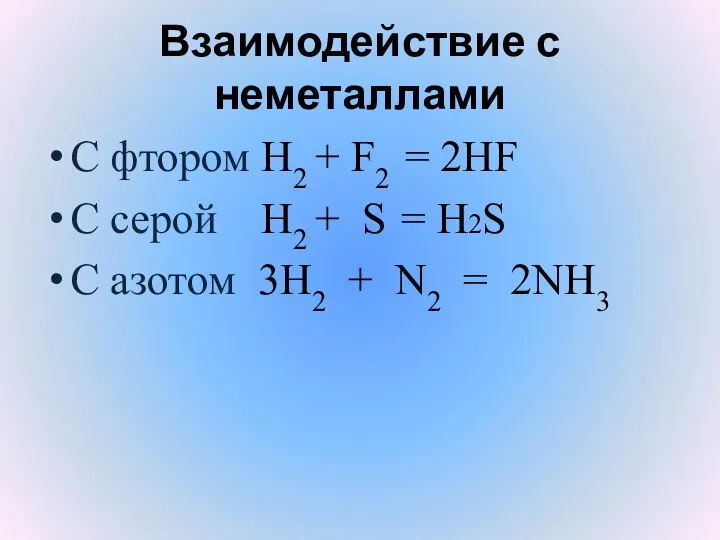
- 15. Взаимодействие с неметаллами С фтором H2 + F2 = 2HF С серой H2 + S =
- 16. Физкультминутка
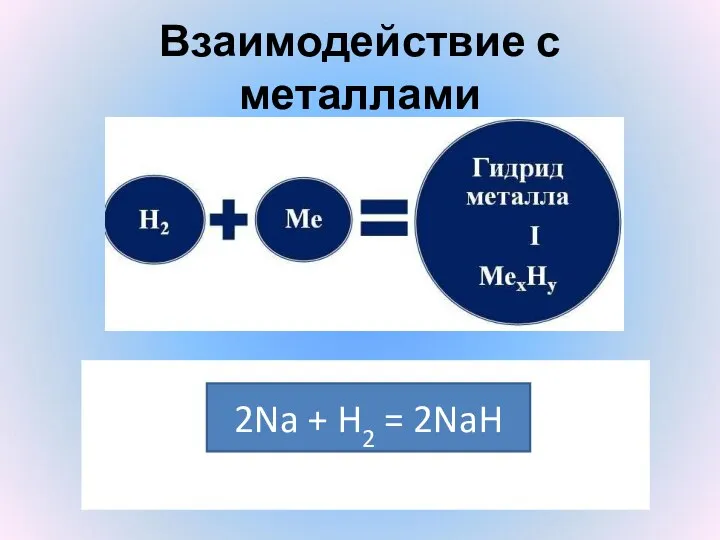
- 17. Взаимодействие с металлами 2Na + H2 = 2NaH
- 18. Лабораторная работа № 6 Взаимодействие водорода с оксидом меди. ТБ перед проведением работы: - проводить работу
- 19. В ходе эксперимента возникли следующие вопросы: Почему пробирку с оксидом меди (II) закрепили под наклоном? Почему
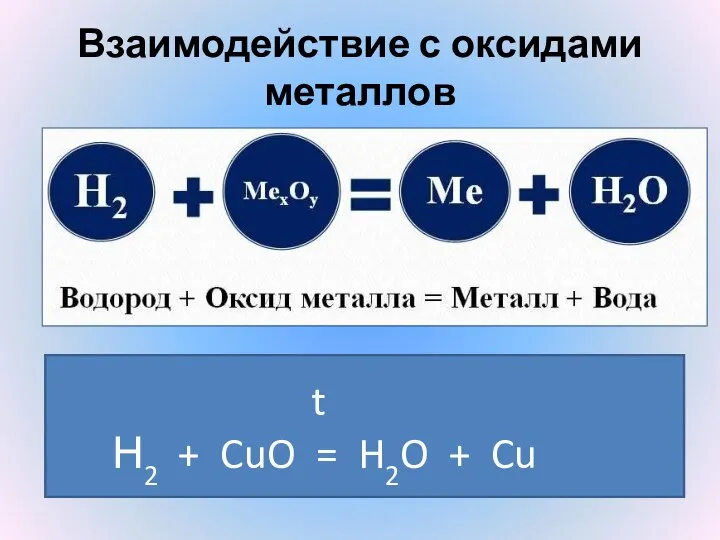
- 20. Взаимодействие с оксидами металлов Н2 + CuO t =Н2 + CuO t = H2O + Cu
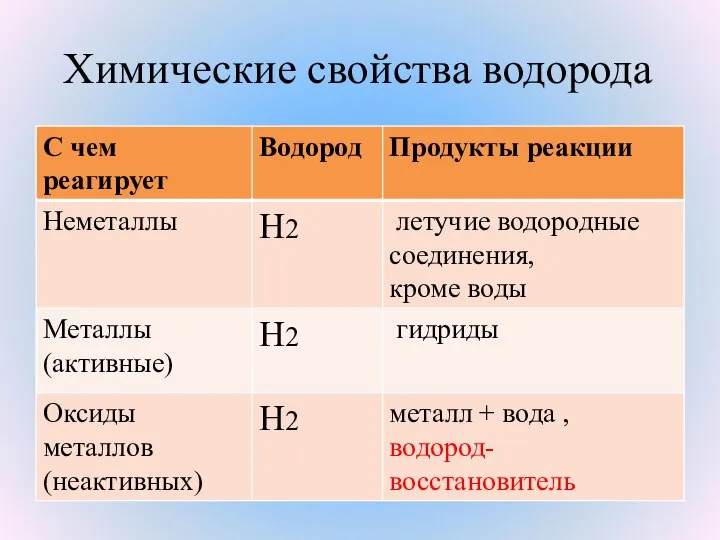
- 21. Химические свойства водорода
- 22. Предложите способы использования водорода на основании изученных свойств
- 23. Использование водорода в качестве топлива автомобилей. При сгорании водорода в кислороде образуется экологически чистый продукт –
- 24. Использование водорода в ракетных двигателях. Жидкий водород является распространенным компонентом ракетного топлива
- 25. Использование водорода в металлургической промышленности Водород как восстановитель, для получения металлов и неметаллов (кремния, вольфрама)
- 26. Сварка металла Смесь кислорода с водородом используют при сварке и резке металлов.
- 27. Синтез водородсодержащих веществ Синтез аммиака NH3 Синтез хлороводорода и соляной кислоты HCl
- 28. Производство стекла Водород является активным газом, в соединениях с азотом может использоваться в производстве листового, полого
- 29. В пищевой промышленности Превращение растительных масел в твердые жиры – маргарин
- 30. Выберите признаки, характерные для водорода 1) Газ, поддерживающий горение 2) Легче воздуха 3) В лаборатории получают
- 31. Составьте уравнения реакций взаимодействия водорода со следующими веществами: I Cl2 + H2 = HCl II Ca
- 32. Проверка выполнения задания Cl2 + H2 = 2HCl Ca + H2 = Ca H2 HgO +
- 33. ДОМАШНЕЕ ЗАДАНИЕ Выучить параграф 29, выполнить тестовые задания с. 101 Подготовиться к практической работе № 4,
- 34. Подумайте и закончите предложения: – Сегодня на уроке я узнал… – На уроке я понял… –
- 36. Скачать презентацию



























 Гексан С6Н14
Гексан С6Н14 Презентация по Химии "Хімія в повсякденному житті" - скачать смотреть бесплатно
Презентация по Химии "Хімія в повсякденному житті" - скачать смотреть бесплатно Окись азота
Окись азота Презентация по Химии "Синтетичні мийні засоби" - скачать смотреть бесплатно
Презентация по Химии "Синтетичні мийні засоби" - скачать смотреть бесплатно Опал
Опал Презентация Химия
Презентация Химия Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Важнейшие кислоты и кислотные остатки. (Леция 1)
Важнейшие кислоты и кислотные остатки. (Леция 1) «Соединения химических элементов»
«Соединения химических элементов» NiCl2 - Никель хлориді
NiCl2 - Никель хлориді Презентация по Химии "Презентация Пестициды" - скачать смотреть
Презентация по Химии "Презентация Пестициды" - скачать смотреть  Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака
Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака Ксенобиотики в окружающей среде и живых организмах. (Лекция 2)
Ксенобиотики в окружающей среде и живых организмах. (Лекция 2) Шкала рН
Шкала рН Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Определение ректификации
Определение ректификации Аттестаионная работа. Сахар. Изучаем и исследуем
Аттестаионная работа. Сахар. Изучаем и исследуем Значення хімічних процесів у природі
Значення хімічних процесів у природі Основные сведения о строении атомов
Основные сведения о строении атомов Зміна складу і технологічних властивостей молока під впливом різних факторів
Зміна складу і технологічних властивостей молока під впливом різних факторів Колоїдний захист
Колоїдний захист Генетичний зв'язок
Генетичний зв'язок Пути повышения критериев конкурентоспособности двигателей
Пути повышения критериев конкурентоспособности двигателей Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез
Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез Неорганическая химия Сероводород
Неорганическая химия Сероводород  Хімія і здоров’я людини Виконала Учениця 11-Б класу Тихонюк Альона
Хімія і здоров’я людини Виконала Учениця 11-Б класу Тихонюк Альона  Диагностическое тестирование по химии в 8 классе
Диагностическое тестирование по химии в 8 классе