Содержание
- 2. вУГЛЕВОДні Вперше термін «вуглеводи» запропонував російський хімік з Дерпта (нині Тарту) К.Шмідт в 1844 році.
- 3. вУГЛЕВОДні Вуглеводи самі універсальні й найпоширеніші органічні речовини на Землі. Клітини рослин багаті вуглеводами. Особено їх
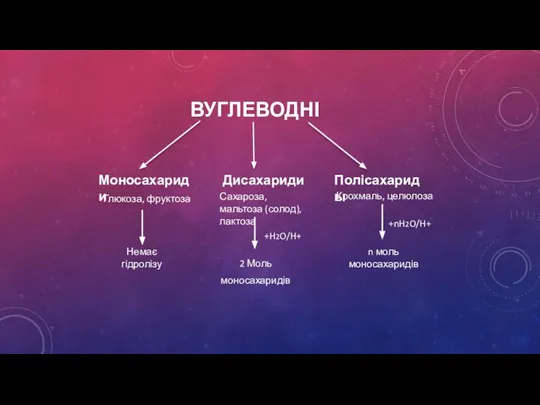
- 4. ВУГЛЕВОДНІ Моносахариди Дисахариди Полісахариды Глюкоза, фруктоза Сахароза, мальтоза (солод), лактоза Крохмаль, целюлоза +H2O/H+ +nH2O/H+ Немає гідролізу
- 5. Структурні формули органічних речовин Алкани – насичені вуглеводні ланцюгової будови. Загальна формула - СnH2n+2 Гомологічний ряд
- 6. Ненасичені вуглеводні – органічні сполуки, що мають кратні зв’язки між атомами Карбону (подвійні – С =
- 7. загальна формула кратні зв'язки тип гібридизації кут між напрямами зв'язку Алкени Алкіни CnH2n CnH2n-2 sp2 sp
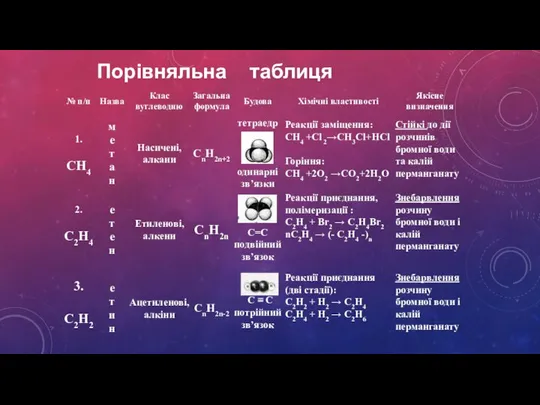
- 8. Порівняльна таблиця
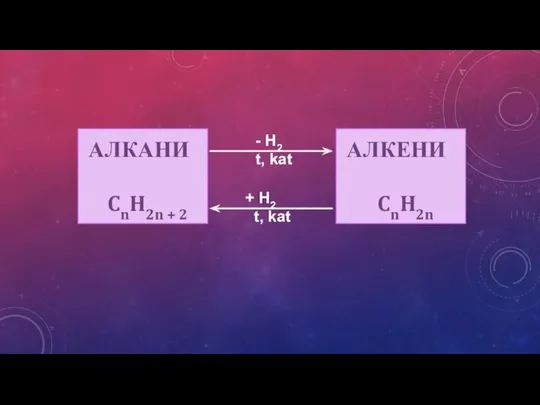
- 9. АЛКАНИ CnH2n + 2 H2 t, kat + H2 t, kat АЛКЕНИ CnH2n
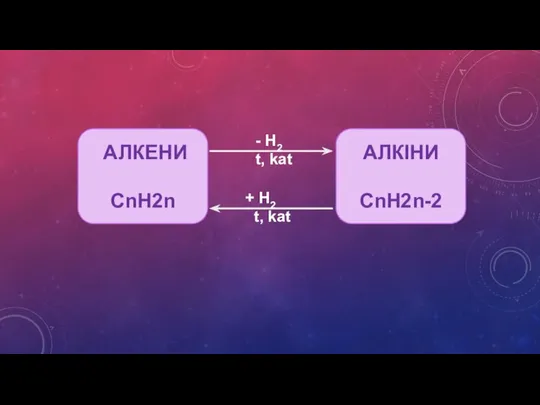
- 10. АЛКЕНИ СnH2n H2 t, kat + H2 t, kat АЛКІНИ СnH2n-2
- 11. Структурна формула бензену Арени – ненасичені вуглеводні із загальною формулою CnH2n-6, молекули яких, містять бензольне кільце.
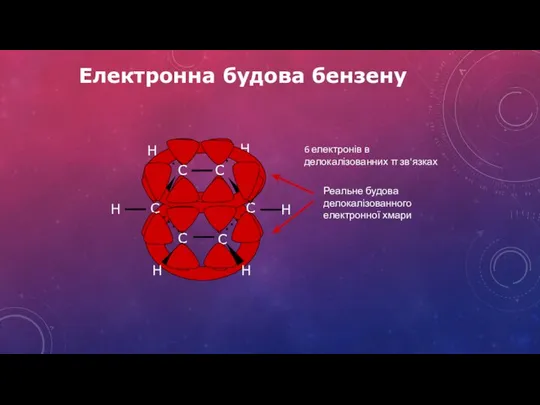
- 12. Електронна будова бензену 6 електронів в делокалізованних зв'язках
- 13. Отримання бензену Бензен є першим представником аренів. Його можна отримати трімерізаціей ацетилену. Бензол отримують при переробці
- 14. Фізичні властивості бензену Бензен: безбарвна рідина, з різким характерним запахом, легше води, розчиняється у воді, розчинний
- 15. Бензол горить. Полум'я бензолу кіптяве з-за високого вмісту карбону в молекулі. Хімічні властивості бензолу Через особливого
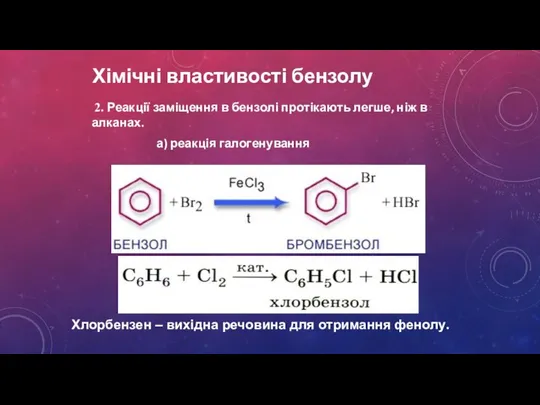
- 16. Хімічні властивості бензолу 2. Реакції заміщення в бензолі протікають легше, ніж в алканах. а) реакція галогенування
- 18. Скачать презентацию









 Электрохимические методы
Электрохимические методы Решение задач с использованием понятия «количество вещества»
Решение задач с использованием понятия «количество вещества» Продовольча проблема і хімія Сочнєвої Ірини 11-А
Продовольча проблема і хімія Сочнєвої Ірини 11-А  Презентация по Химии "Йод" - скачать смотреть
Презентация по Химии "Йод" - скачать смотреть  Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Дгебуадзе Загра Омардибировна, учитель химии, МОУ «СОШ № 14 г.Зеленокумска» Ставропольский край
Дгебуадзе Загра Омардибировна, учитель химии, МОУ «СОШ № 14 г.Зеленокумска» Ставропольский край Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда
Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда Каучук, резина, латекс
Каучук, резина, латекс «Чорне золото» Виконала роботу Учениця 11-а класу Макарівського НВК Заріцька Вікторія
«Чорне золото» Виконала роботу Учениця 11-а класу Макарівського НВК Заріцька Вікторія  Общие сведения о катализе и катализаторах
Общие сведения о катализе и катализаторах Характеристика химического элемента
Характеристика химического элемента Обмоточные провода
Обмоточные провода Введение в биохимию
Введение в биохимию Скорость химической реакции
Скорость химической реакции Биополимеры. Классификация полисахаридов (гликаны)
Биополимеры. Классификация полисахаридов (гликаны) Жаропрочные и жаростойкие стали
Жаропрочные и жаростойкие стали Взаимодействие металла
Взаимодействие металла Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10)
Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10) Полимеры, пластмассы и волокна
Полимеры, пластмассы и волокна «Созвездие талантов» Игра-зачет по теме «Основные классы неорганической химии» 8 класс Автор: Рязкова Н.А., учитель химии М
«Созвездие талантов» Игра-зачет по теме «Основные классы неорганической химии» 8 класс Автор: Рязкова Н.А., учитель химии М Октановое и цетановое числа
Октановое и цетановое числа Пути обмена глюкозо-6 фосфата в тканях. Анаэробное расщепление глюкозы. Спиртовое брожение. Метаболизм этанола. (Тема 2)
Пути обмена глюкозо-6 фосфата в тканях. Анаэробное расщепление глюкозы. Спиртовое брожение. Метаболизм этанола. (Тема 2) Ртуть и цинк
Ртуть и цинк Обмен липидов
Обмен липидов Хроматографические методы анализа. Метод газовой хроматографии
Хроматографические методы анализа. Метод газовой хроматографии Нержавеющая сталь
Нержавеющая сталь Силіцій Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
Силіцій Характеристика елемента та утворених ним сполук, кругообіг елемента в природі  Обмен липидов. Классификация липидов
Обмен липидов. Классификация липидов