Содержание
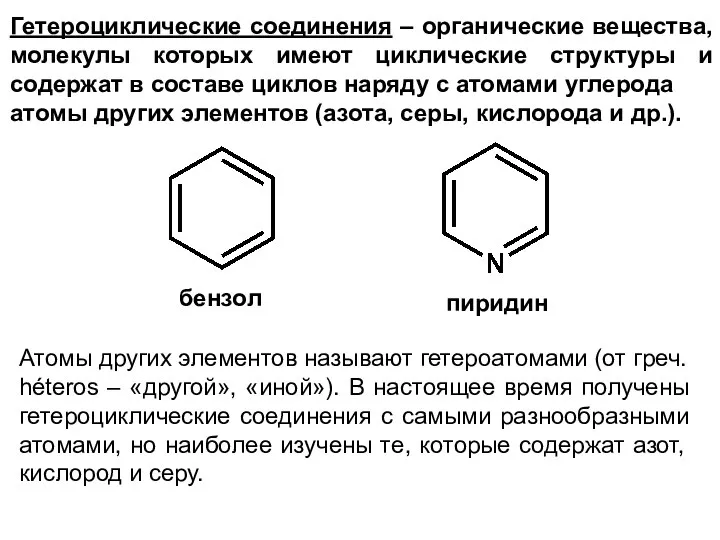
- 2. Гетероциклические соединения – органические вещества, молекулы которых имеют циклические структуры и содержат в составе циклов наряду
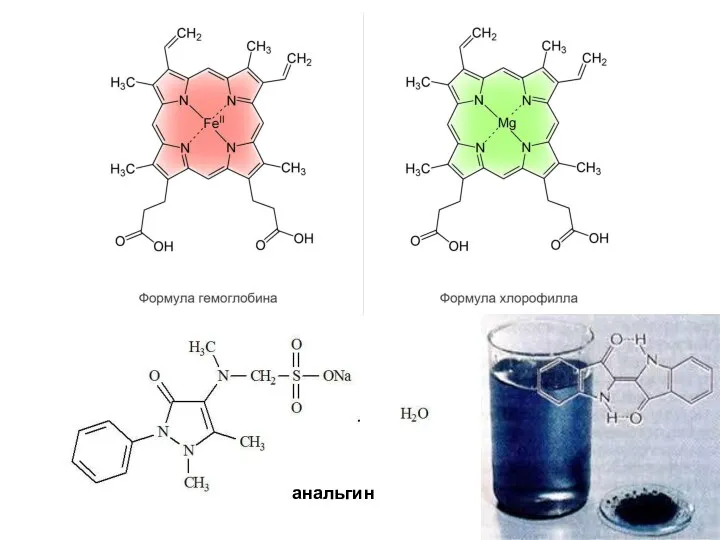
- 3. Применение и роль гетероциклических соединений Многочисленные гетероциклические соединения играют важную роль в биологии, медицине, сельском хозяйстве
- 4. анальгин
- 5. В зависимости от числа атомов, образующих гетероциклы, различают трех-, четырех-, пяти-, шестичленные гетероциклические соединения, содержащие один,
- 6. Номенклатура гетероциклических соединений ТРИВИАЛЬНАЯ НОМЕНКЛАТУРА СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА ЗАМЕНИТЕЛЬНАЯ НОМЕНКЛАТУРА (номенклатура Ганча — Видмана)
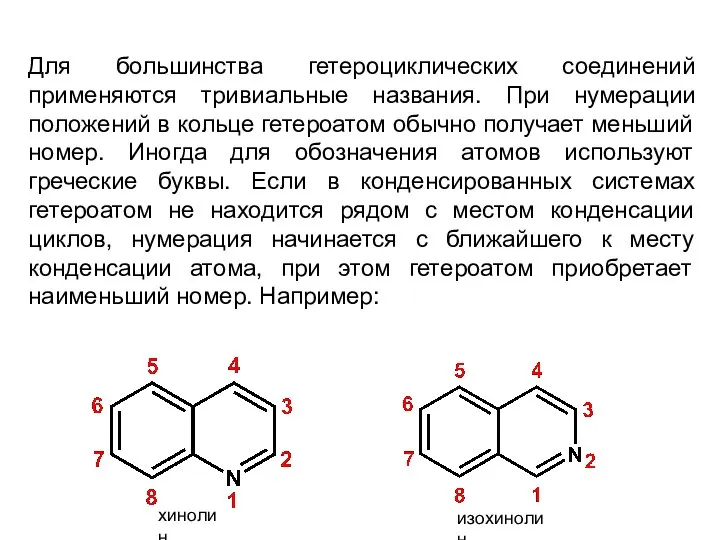
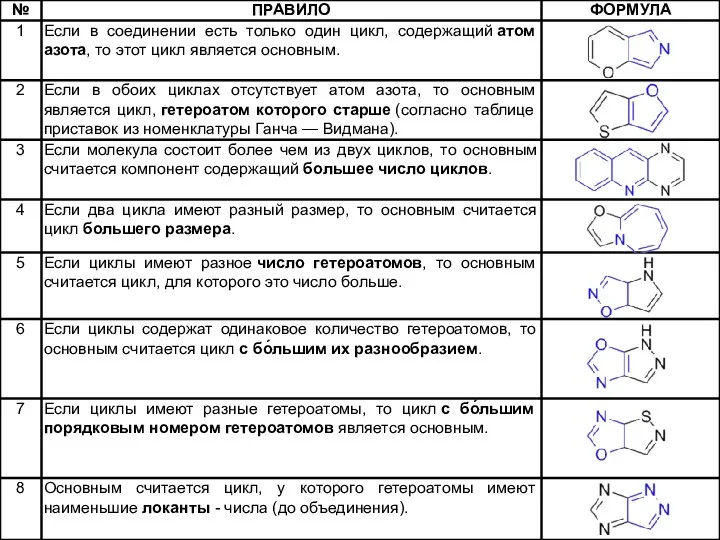
- 7. Для большинства гетероциклических соединений применяются тривиальные названия. При нумерации положений в кольце гетероатом обычно получает меньший
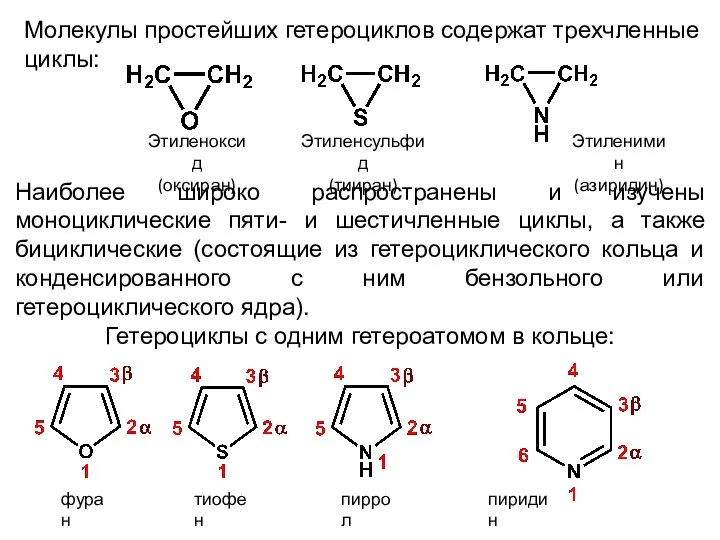
- 8. Молекулы простейших гетероциклов содержат трехчленные циклы: Наиболее широко распространены и изучены моноциклические пяти- и шестичленные циклы,
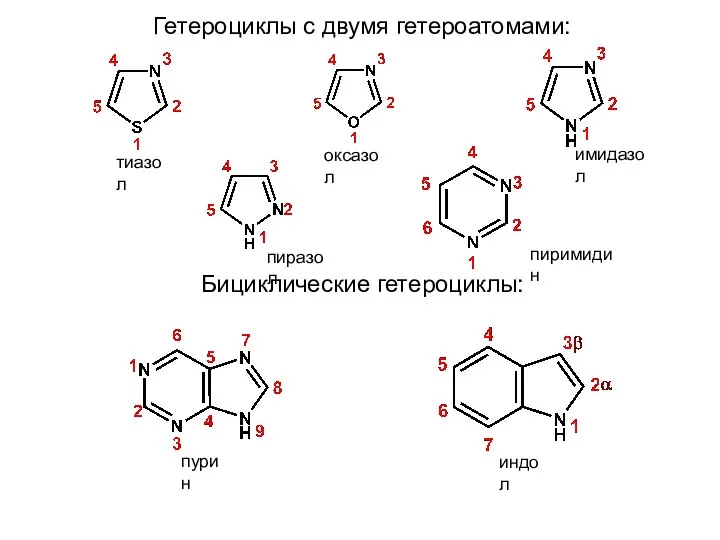
- 9. Гетероциклы с двумя гетероатомами: Бициклические гетероциклы: оксазол тиазол имидазол пиразол пиримидин пурин индол
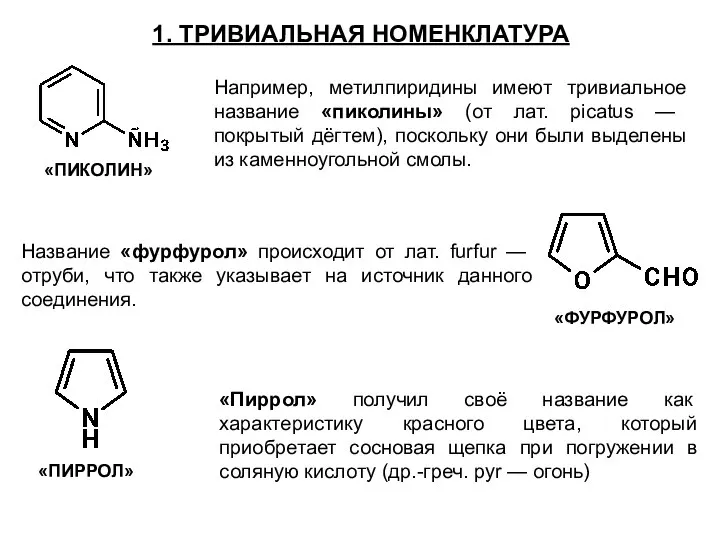
- 10. 1. ТРИВИАЛЬНАЯ НОМЕНКЛАТУРА «ПИКОЛИН» Например, метилпиридины имеют тривиальное название «пиколины» (от лат. picatus — покрытый дёгтем),
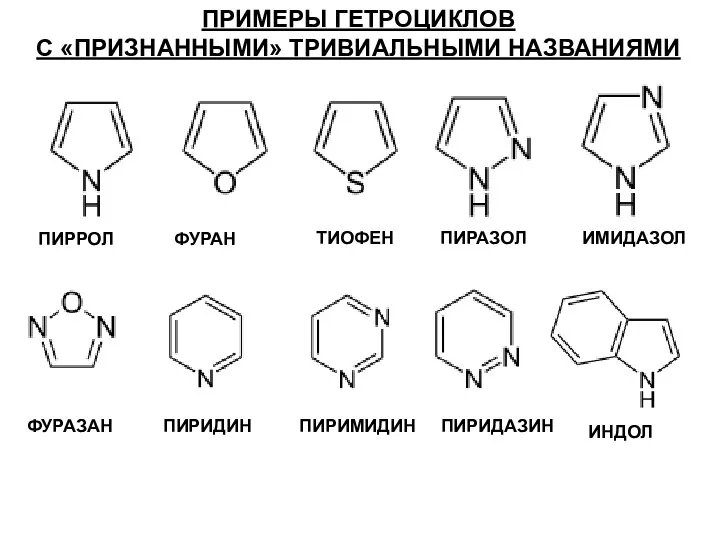
- 11. ПРИМЕРЫ ГЕТРОЦИКЛОВ С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ ПИРРОЛ ФУРАН ТИОФЕН ПИРАЗОЛ ИМИДАЗОЛ ФУРАЗАН ПИРИДИН ПИРИМИДИН ПИРИДАЗИН ИНДОЛ
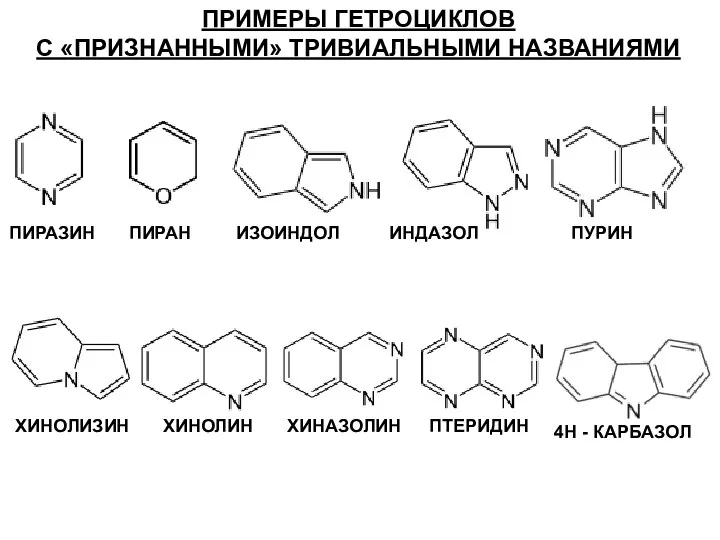
- 12. ПРИМЕРЫ ГЕТРОЦИКЛОВ С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ ПИРАЗИН ПИРАН ИЗОИНДОЛ ИНДАЗОЛ ПУРИН ХИНОЛИЗИН ХИНОЛИН ХИНАЗОЛИН ПТЕРИДИН 4Н
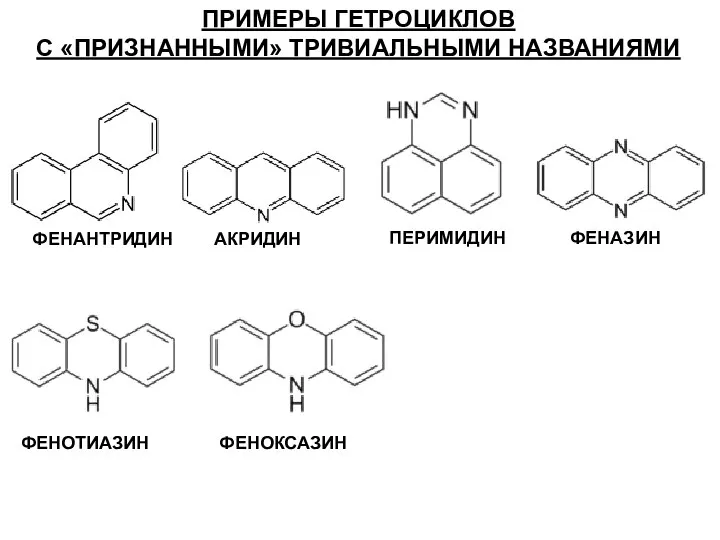
- 13. ПРИМЕРЫ ГЕТРОЦИКЛОВ С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ ФЕНАНТРИДИН АКРИДИН ПЕРИМИДИН ФЕНАЗИН ФЕНОТИАЗИН ФЕНОКСАЗИН
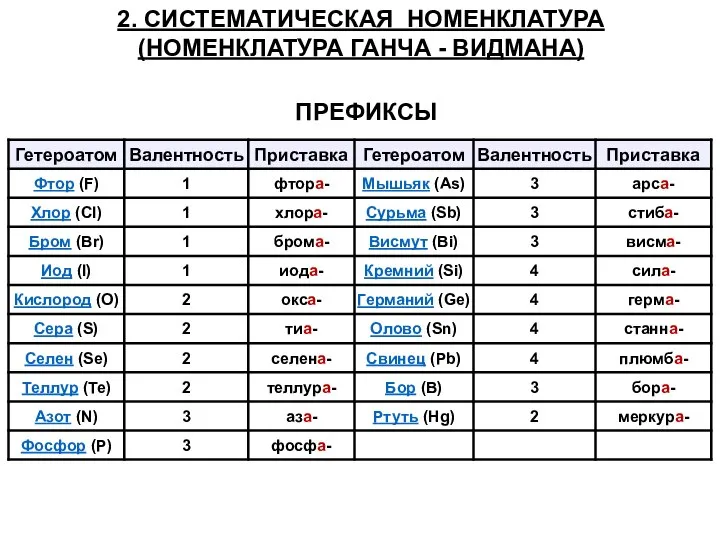
- 14. 2. СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА (НОМЕНКЛАТУРА ГАНЧА - ВИДМАНА) ПРЕФИКСЫ
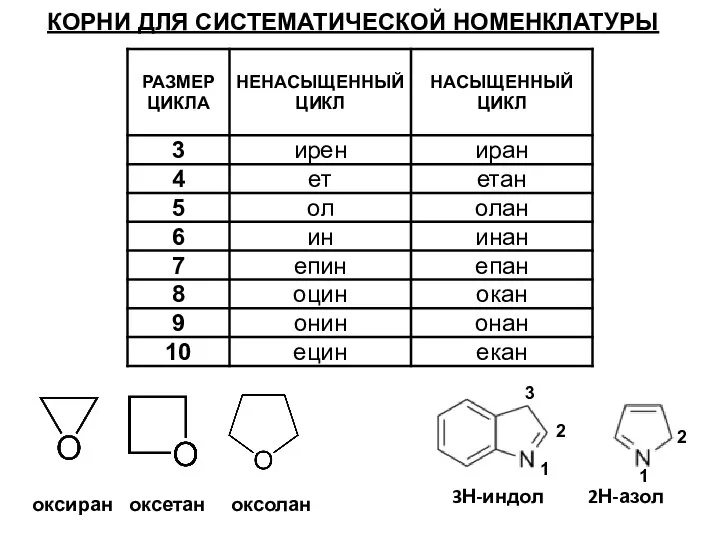
- 15. КОРНИ ДЛЯ СИСТЕМАТИЧЕСКОЙ НОМЕНКЛАТУРЫ оксиран оксетан оксолан 3Н-индол 1 2 3 2Н-азол 1 2
- 16. 3. ЗАМЕНИТЕЛЬНАЯ НОМЕНКЛАТУРА Заменительная номенклатура рассматривает гетероциклическое соединение как соответствующее карбоциклическое, в котором один или несколько
- 18. Название цикла, который выбран основным, становится корнем нового названия, а название побочного цикла — приставкой. Приставка
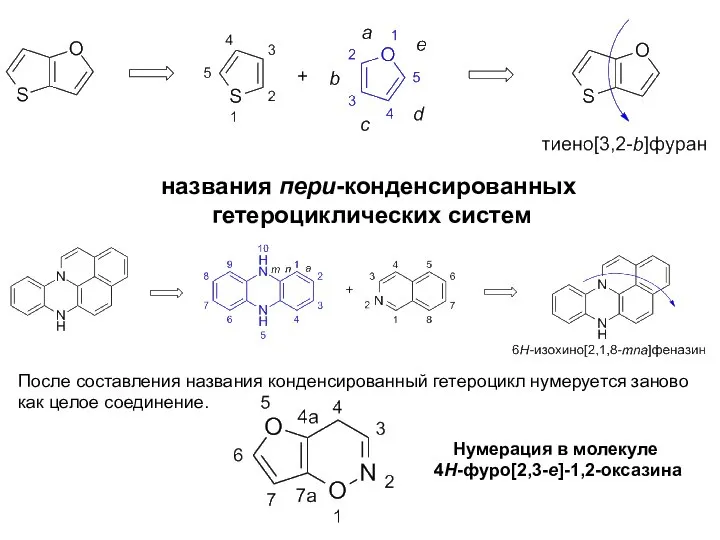
- 19. названия пери-конденсированных гетероциклических систем После составления названия конденсированный гетероцикл нумеруется заново как целое соединение. Нумерация в
- 20. Практическое занятие
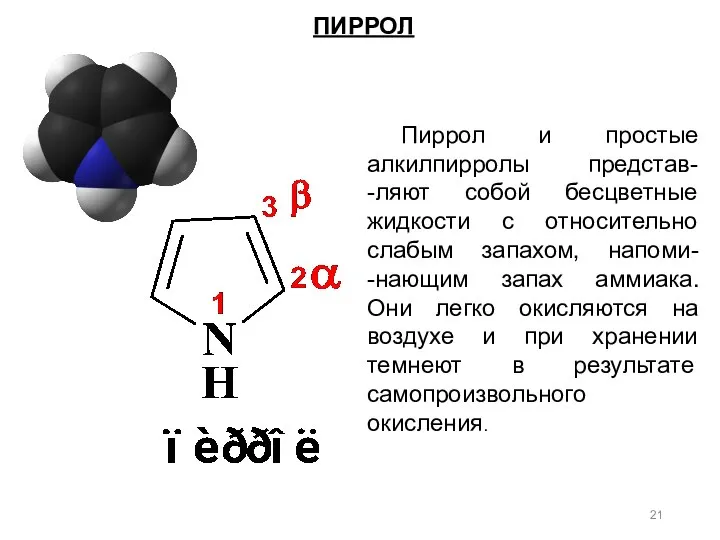
- 21. ПИРРОЛ Пиррол и простые алкилпирролы представ- -ляют собой бесцветные жидкости с относительно слабым запахом, напоми- -нающим
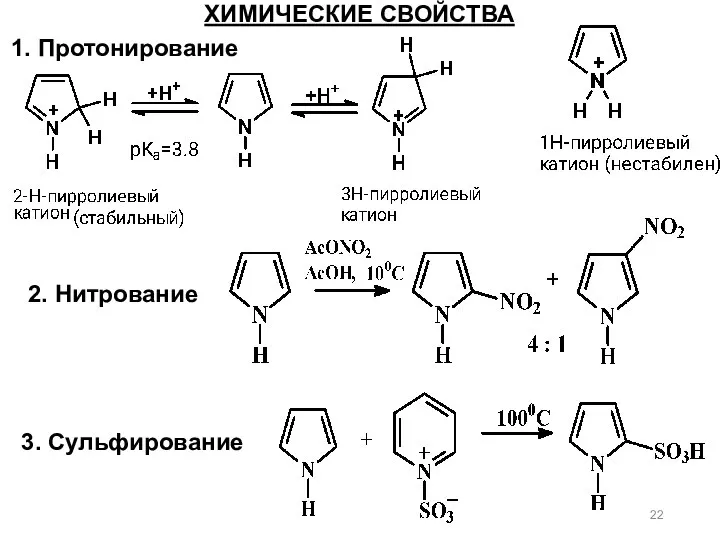
- 22. ХИМИЧЕСКИЕ СВОЙСТВА 1. Протонирование 2. Нитрование 3. Сульфирование
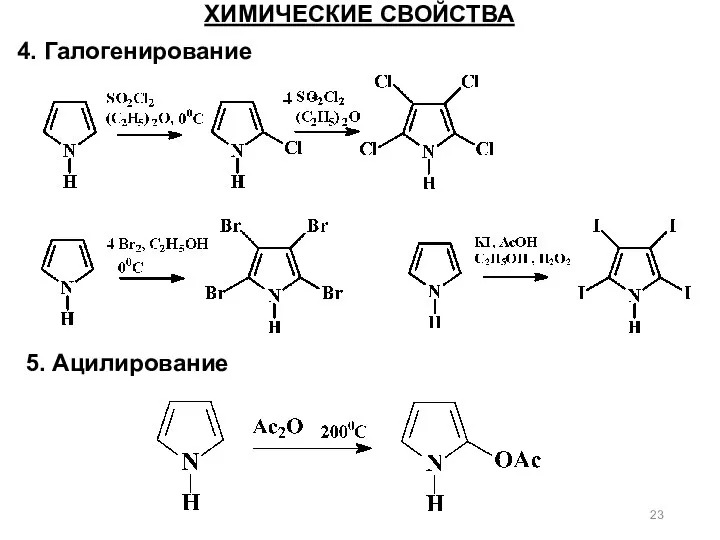
- 23. ХИМИЧЕСКИЕ СВОЙСТВА 4. Галогенирование 5. Ацилирование
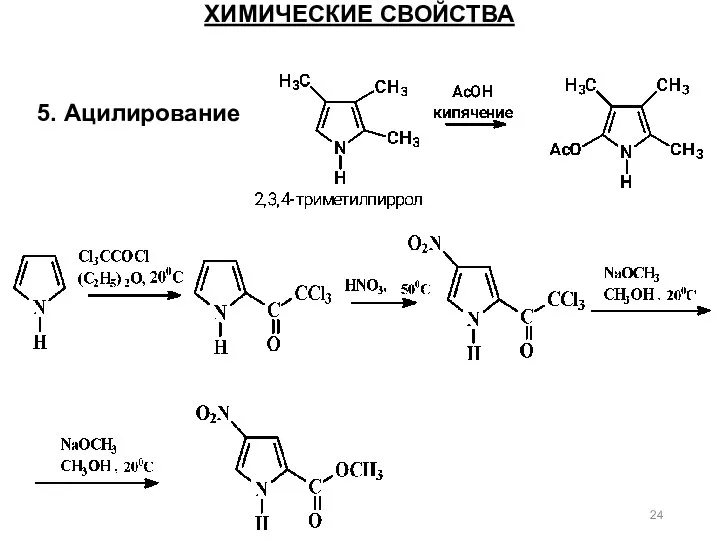
- 24. 5. Ацилирование ХИМИЧЕСКИЕ СВОЙСТВА
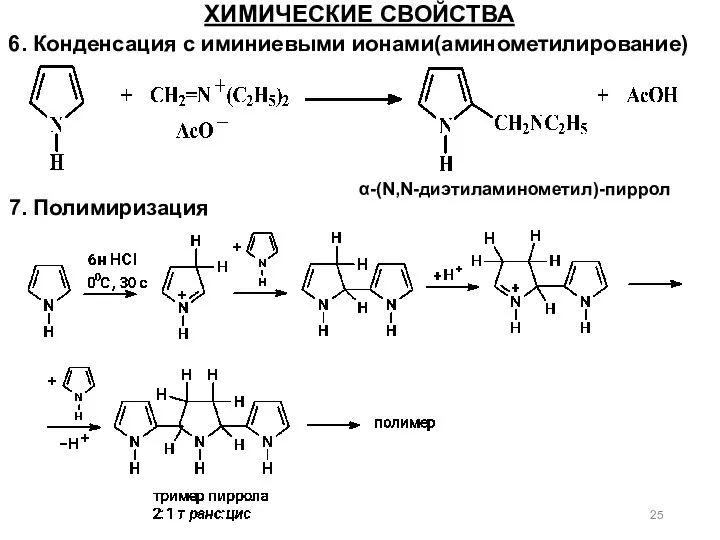
- 25. 6. Конденсация с иминиевыми ионами(аминометилирование) ХИМИЧЕСКИЕ СВОЙСТВА α-(N,N-диэтиламинометил)-пиррол 7. Полимиризация
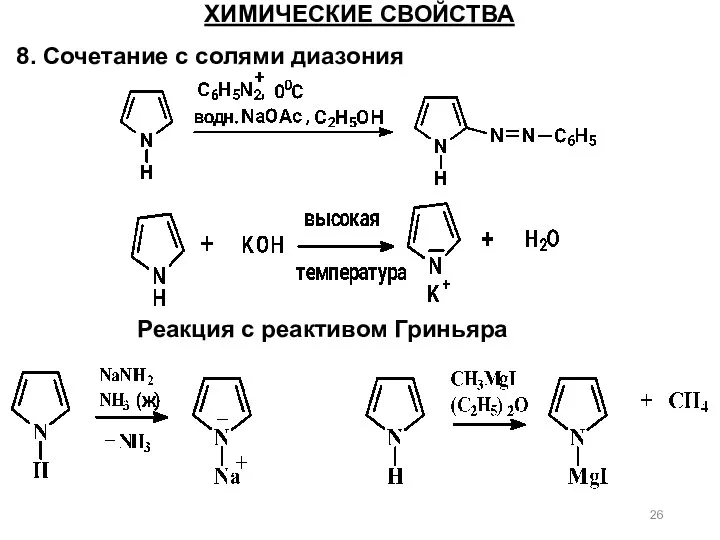
- 26. ХИМИЧЕСКИЕ СВОЙСТВА 8. Сочетание с солями диазония Реакция с реактивом Гриньяра
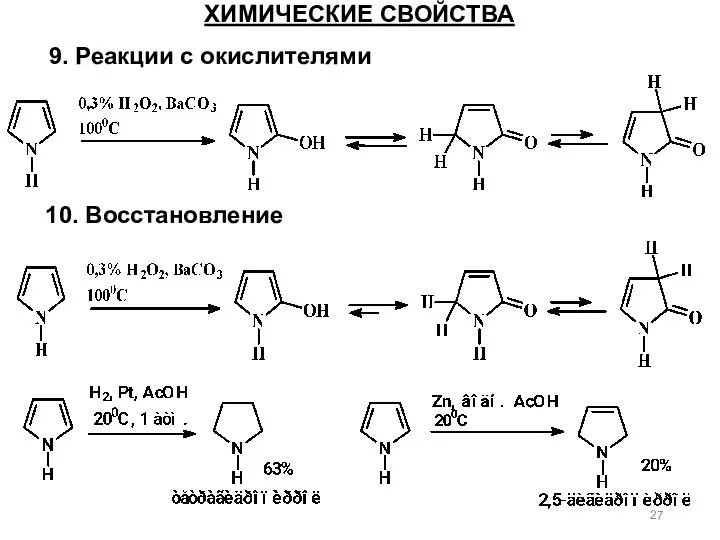
- 27. ХИМИЧЕСКИЕ СВОЙСТВА 9. Реакции с окислителями 10. Восстановление
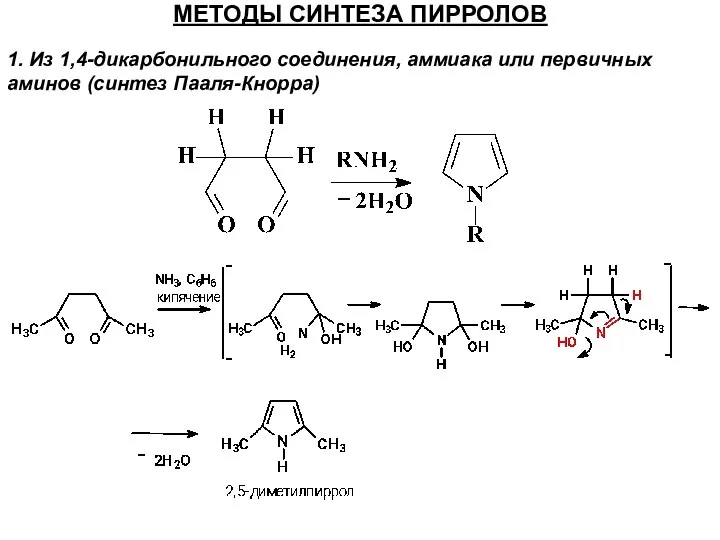
- 28. МЕТОДЫ СИНТЕЗА ПИРРОЛОВ 1. Из 1,4-дикарбонильного соединения, аммиака или первичных аминов (синтез Пааля-Кнорра)
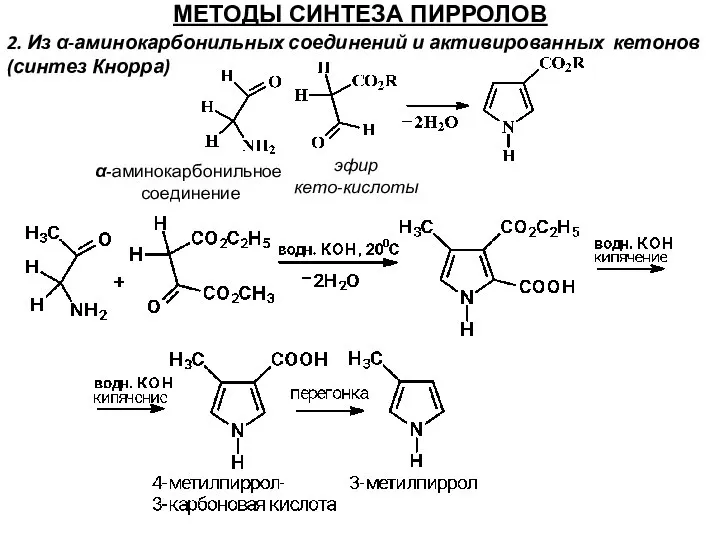
- 29. МЕТОДЫ СИНТЕЗА ПИРРОЛОВ 2. Из α-аминокарбонильных соединений и активированных кетонов (синтез Кнорра) α-аминокарбонильное соединение эфир кето-кислоты
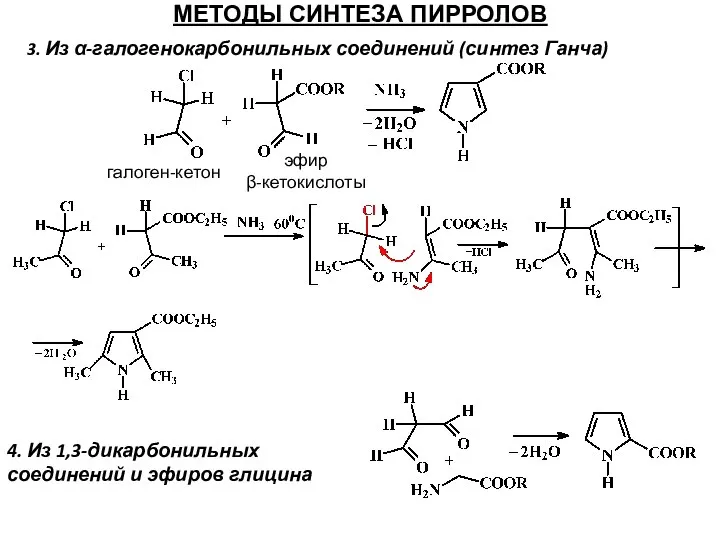
- 30. МЕТОДЫ СИНТЕЗА ПИРРОЛОВ 3. Из α-галогенокарбонильных соединений (синтез Ганча) эфир β-кетокислоты галоген-кетон 4. Из 1,3-дикарбонильных соединений
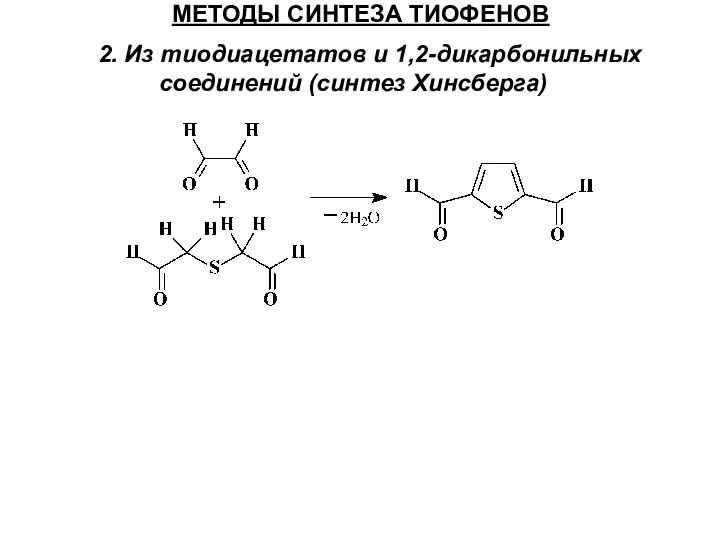
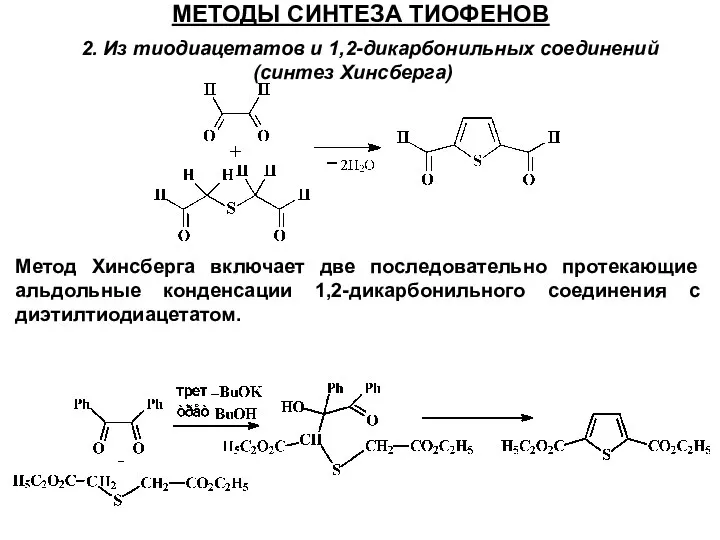
- 31. МЕТОДЫ СИНТЕЗА ТИОФЕНОВ 2. Из тиодиацетатов и 1,2-дикарбонильных соединений (синтез Хинсберга)
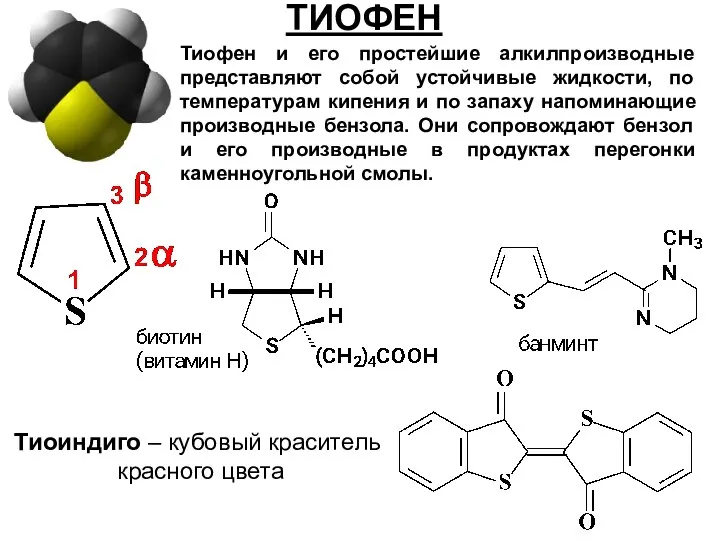
- 32. ТИОФЕН Тиофен и его простейшие алкилпроизводные представляют собой устойчивые жидкости, по температурам кипения и по запаху
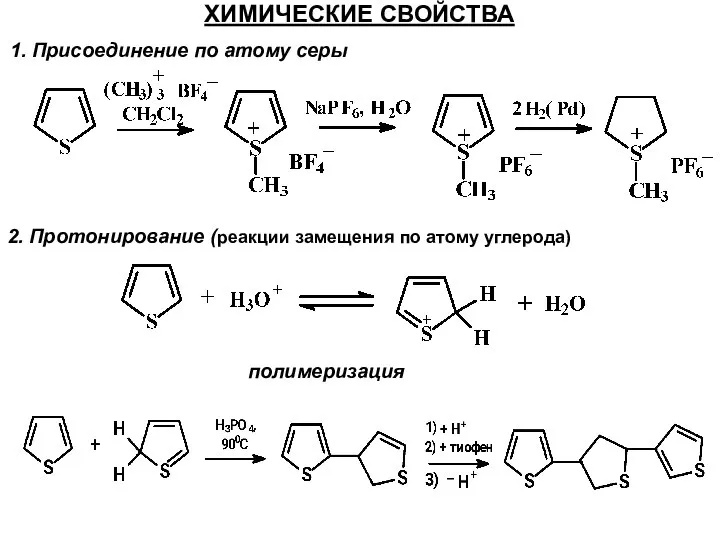
- 33. ХИМИЧЕСКИЕ СВОЙСТВА 1. Присоединение по атому серы 2. Протонирование (реакции замещения по атому углерода) полимеризация
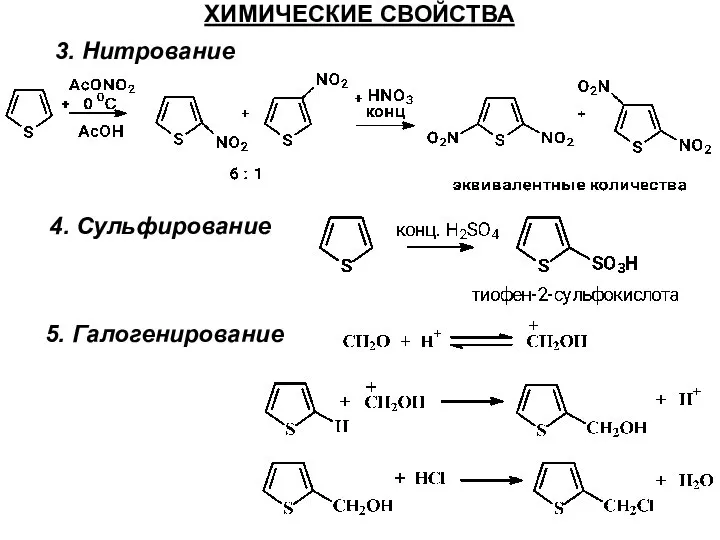
- 34. ХИМИЧЕСКИЕ СВОЙСТВА 3. Нитрование 4. Сульфирование 5. Галогенирование
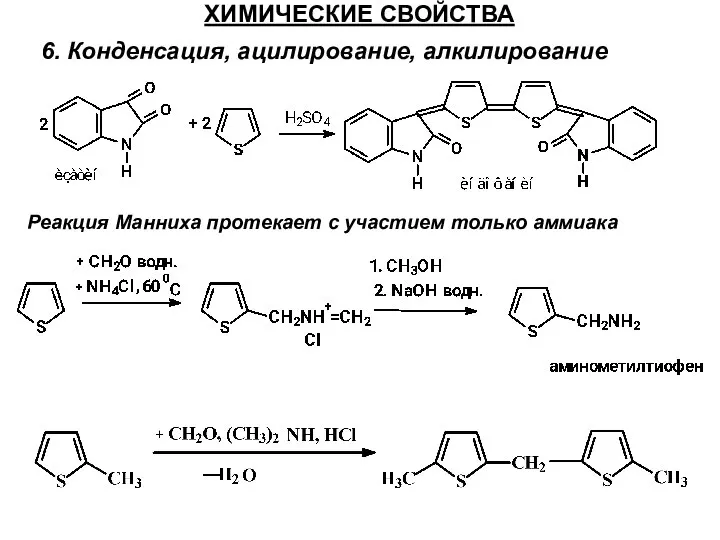
- 35. ХИМИЧЕСКИЕ СВОЙСТВА 6. Конденсация, ацилирование, алкилирование Реакция Манниха протекает с участием только аммиака
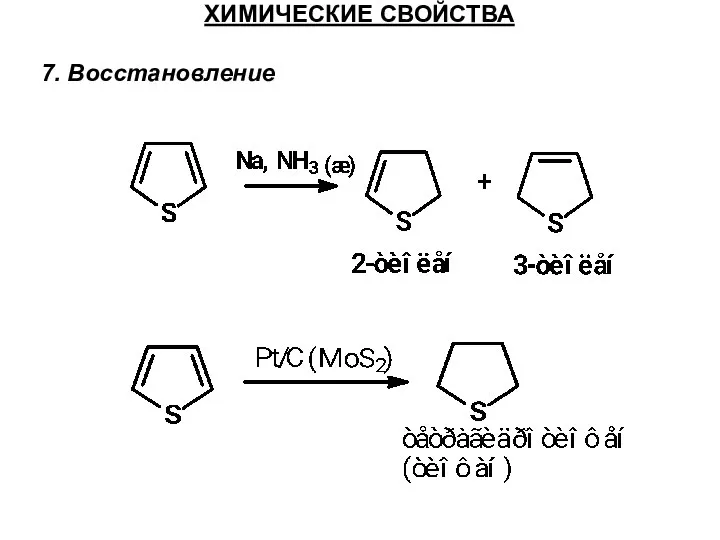
- 36. ХИМИЧЕСКИЕ СВОЙСТВА 7. Восстановление
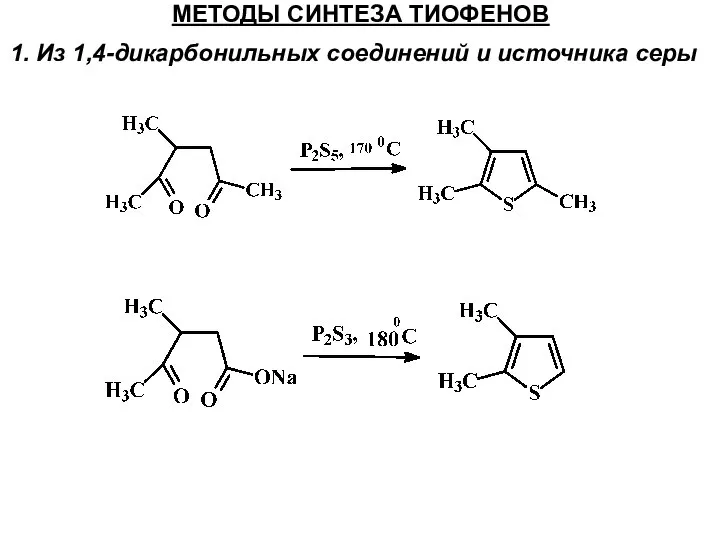
- 37. МЕТОДЫ СИНТЕЗА ТИОФЕНОВ 1. Из 1,4-дикарбонильных соединений и источника серы
- 38. МЕТОДЫ СИНТЕЗА ТИОФЕНОВ 2. Из тиодиацетатов и 1,2-дикарбонильных соединений (синтез Хинсберга) Метод Хинсберга включает две последовательно
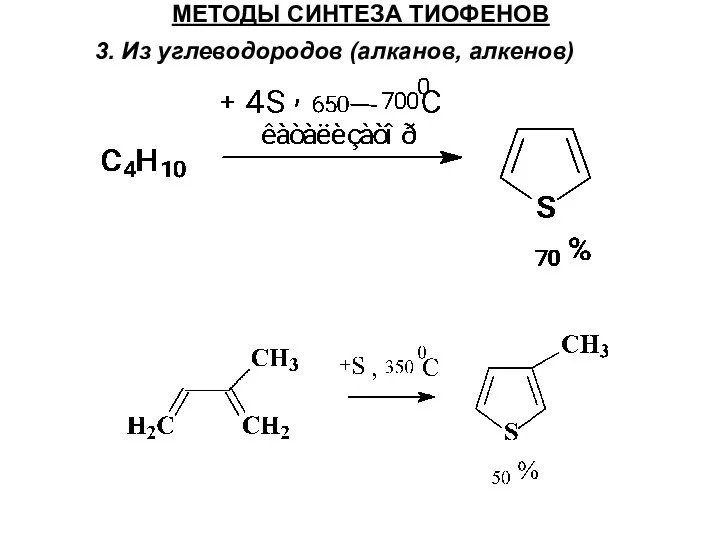
- 39. МЕТОДЫ СИНТЕЗА ТИОФЕНОВ 3. Из углеводородов (алканов, алкенов)
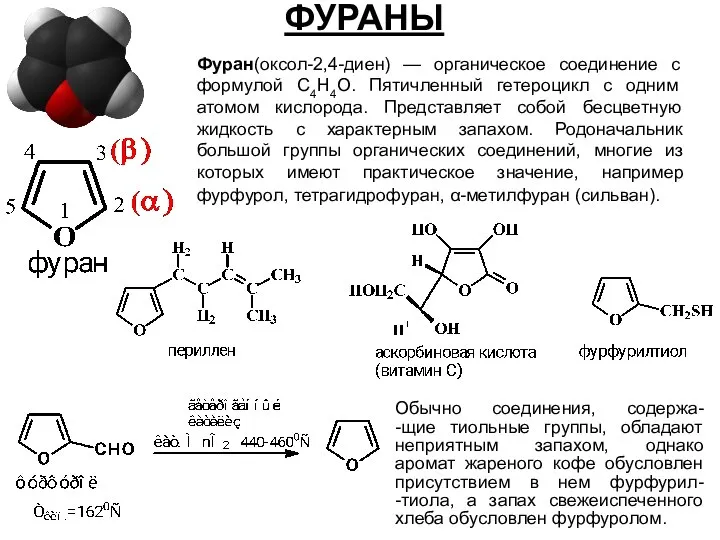
- 40. ФУРАНЫ Фуран(оксол-2,4-диен) — органическое соединение с формулой C4H4O. Пятичленный гетероцикл с одним атомом кислорода. Представляет собой
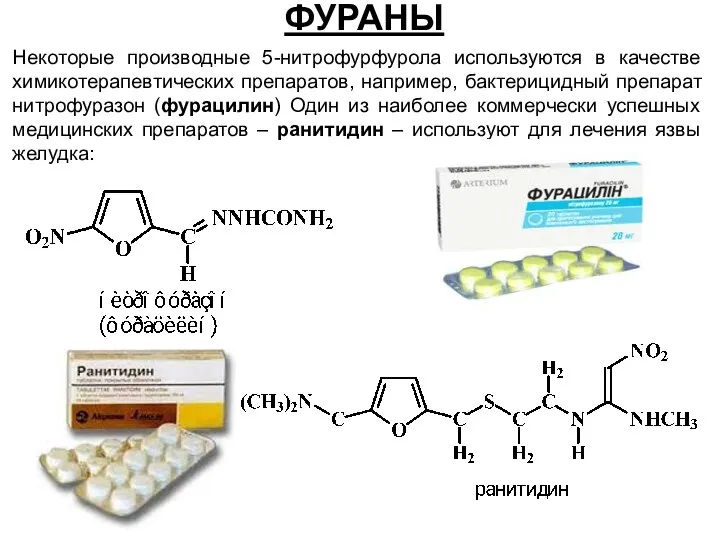
- 41. ФУРАНЫ Некоторые производные 5-нитрофурфурола используются в качестве химикотерапевтических препаратов, например, бактерицидный препарат нитрофуразон (фурацилин) Один из
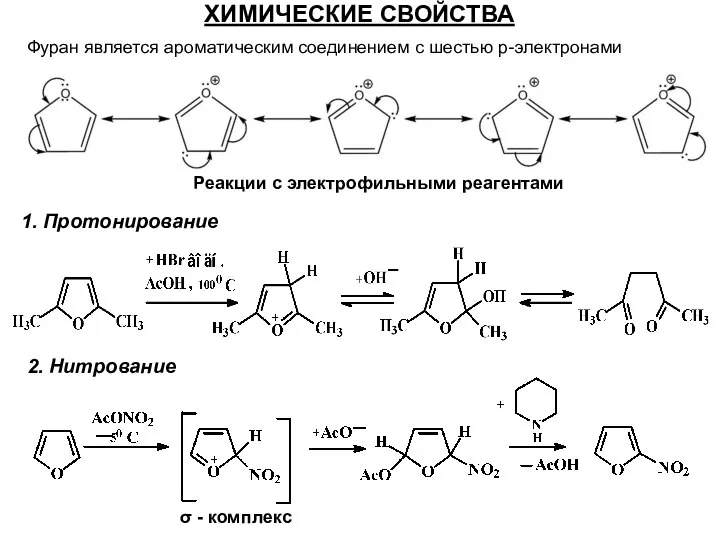
- 42. ХИМИЧЕСКИЕ СВОЙСТВА 1. Протонирование 2. Нитрование Фуран является ароматическим соединением с шестью p-электронами σ - комплекс
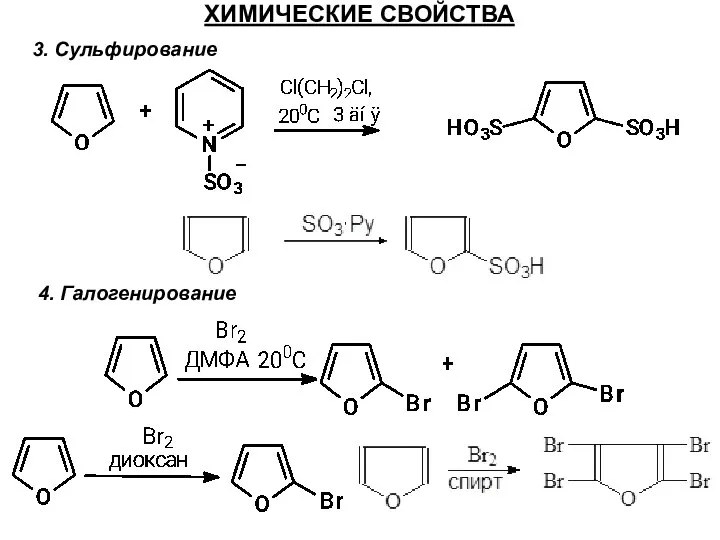
- 43. ХИМИЧЕСКИЕ СВОЙСТВА 3. Сульфирование 4. Галогенирование
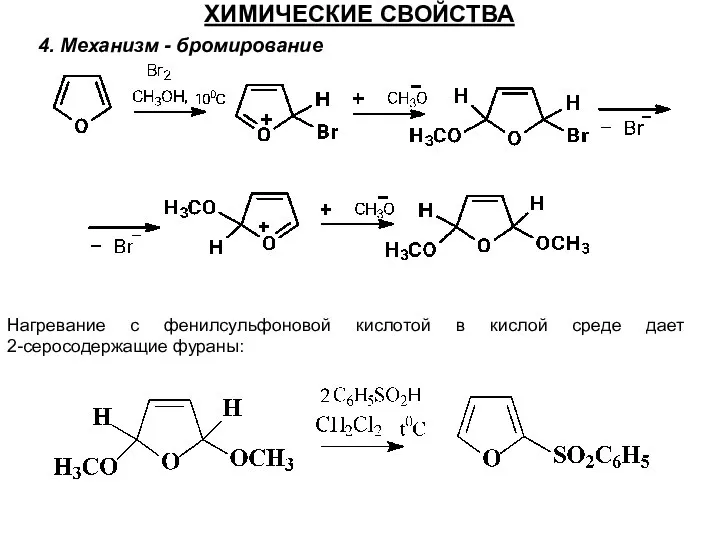
- 44. ХИМИЧЕСКИЕ СВОЙСТВА 4. Механизм - бромирование Нагревание с фенилсульфоновой кислотой в кислой среде дает 2-серосодержащие фураны:
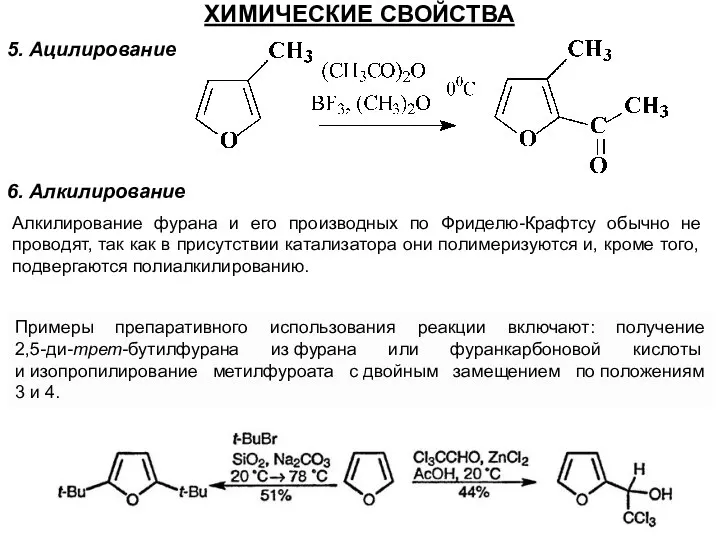
- 45. 5. Ацилирование ХИМИЧЕСКИЕ СВОЙСТВА 6. Алкилирование Алкилирование фурана и его производных по Фриделю-Крафтсу обычно не проводят,
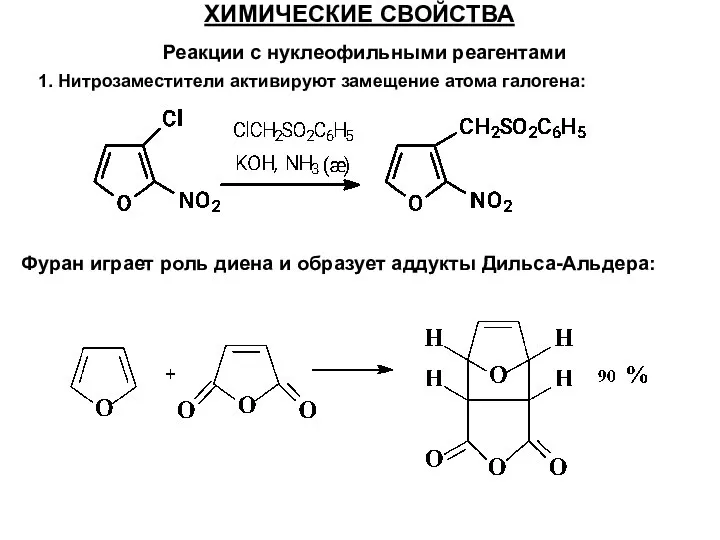
- 46. Реакции с нуклеофильными реагентами ХИМИЧЕСКИЕ СВОЙСТВА 1. Нитрозаместители активируют замещение атома галогена: Фуран играет роль диена
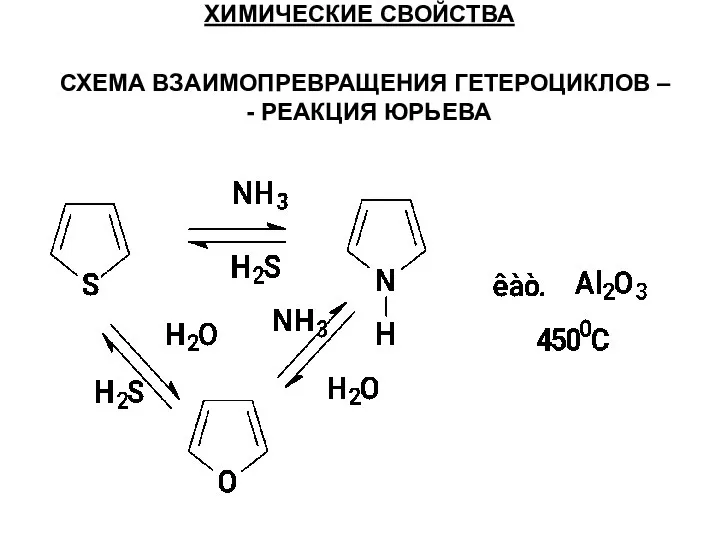
- 47. ХИМИЧЕСКИЕ СВОЙСТВА СХЕМА ВЗАИМОПРЕВРАЩЕНИЯ ГЕТЕРОЦИКЛОВ – - РЕАКЦИЯ ЮРЬЕВА
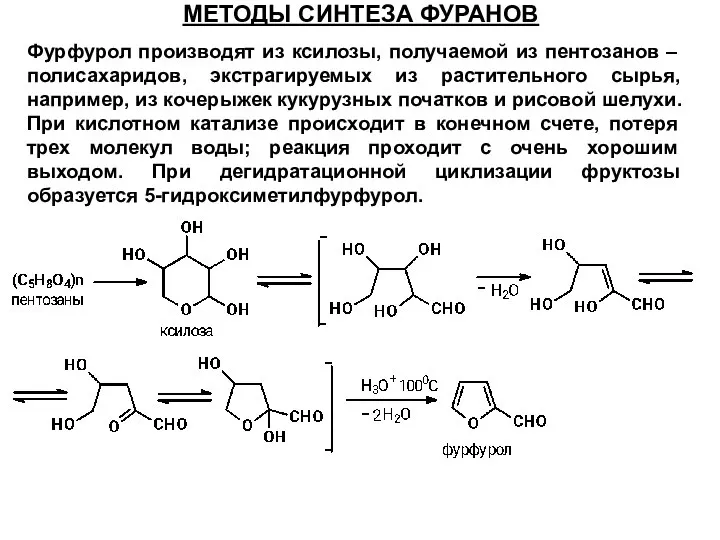
- 48. МЕТОДЫ СИНТЕЗА ФУРАНОВ Фурфурол производят из ксилозы, получаемой из пентозанов – полисахаридов, экстрагируемых из растительного сырья,
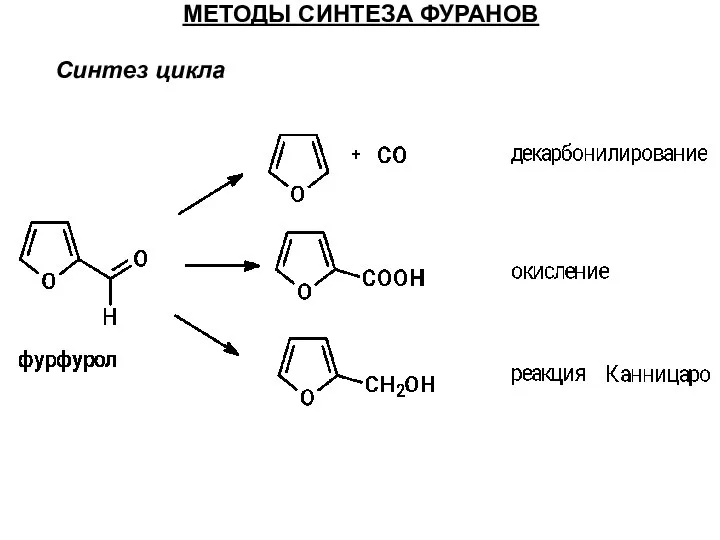
- 49. Синтез цикла МЕТОДЫ СИНТЕЗА ФУРАНОВ
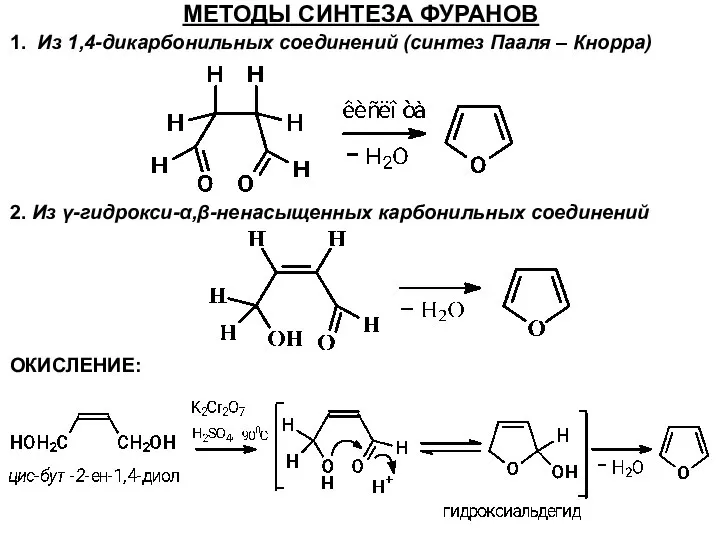
- 50. МЕТОДЫ СИНТЕЗА ФУРАНОВ 1. Из 1,4-дикарбонильных соединений (синтез Пааля – Кнорра) 2. Из γ-гидрокси-α,β-ненасыщенных карбонильных соединений
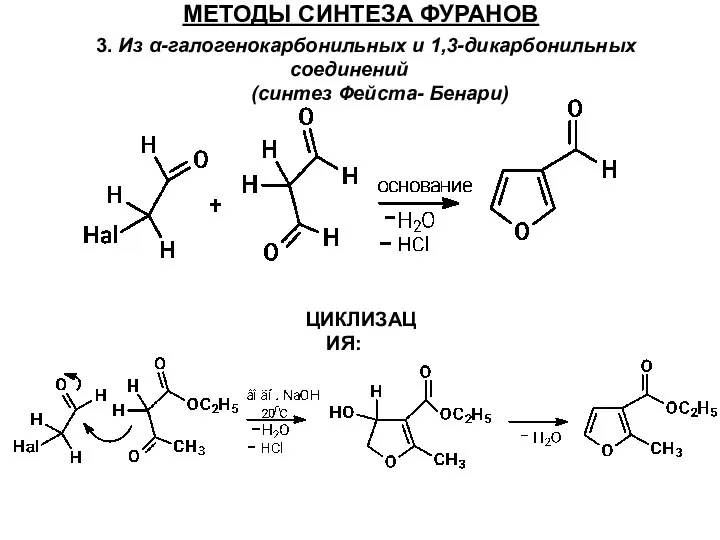
- 51. МЕТОДЫ СИНТЕЗА ФУРАНОВ 3. Из α-галогенокарбонильных и 1,3-дикарбонильных соединений (синтез Фейста- Бенари) ЦИКЛИЗАЦИЯ:
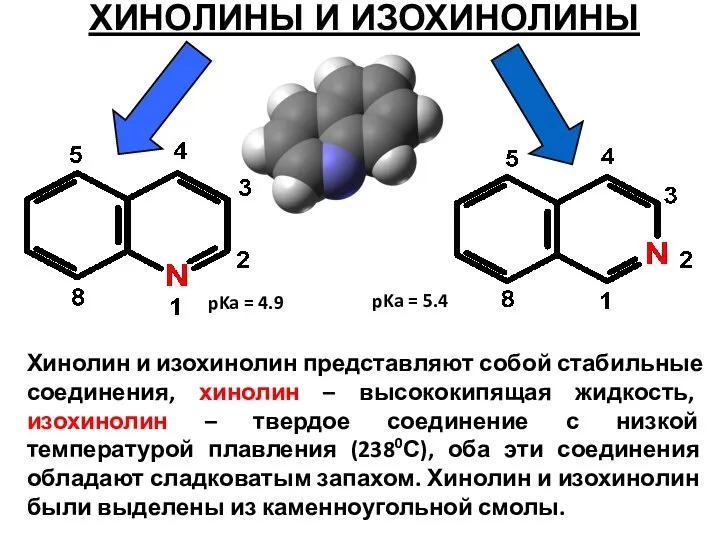
- 52. ХИНОЛИНЫ И ИЗОХИНОЛИНЫ Хинолин и изохинолин представляют собой стабильные соединения, хинолин – высококипящая жидкость, изохинолин –
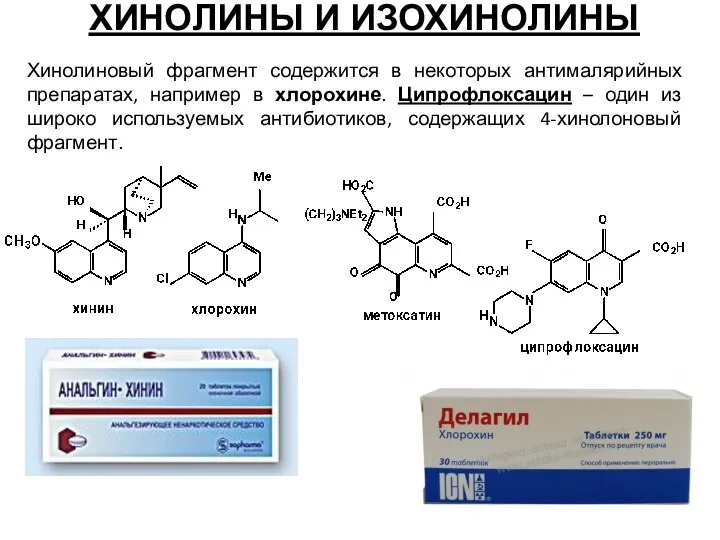
- 53. ХИНОЛИНЫ И ИЗОХИНОЛИНЫ Хинолиновый фрагмент содержится в некоторых антималярийных препаратах, например в хлорохине. Ципрофлоксацин – один
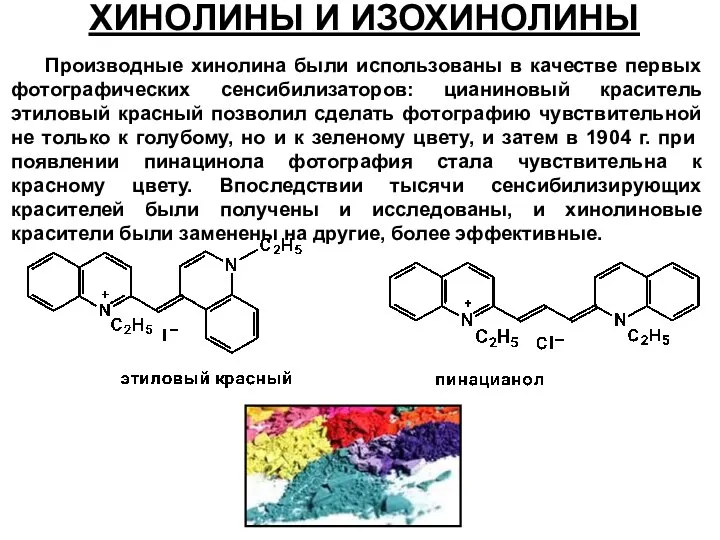
- 54. Производные хинолина были использованы в качестве первых фотографических сенсибилизаторов: цианиновый краситель этиловый красный позволил сделать фотографию
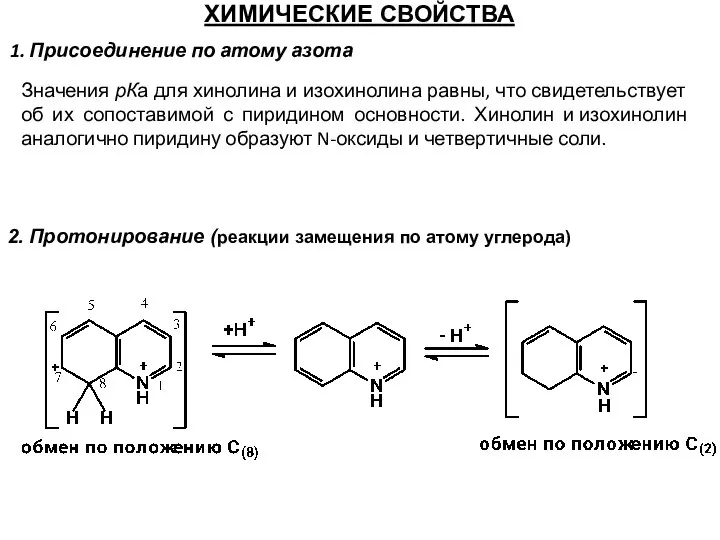
- 55. ХИМИЧЕСКИЕ СВОЙСТВА 1. Присоединение по атому азота 2. Протонирование (реакции замещения по атому углерода) Значения рКа
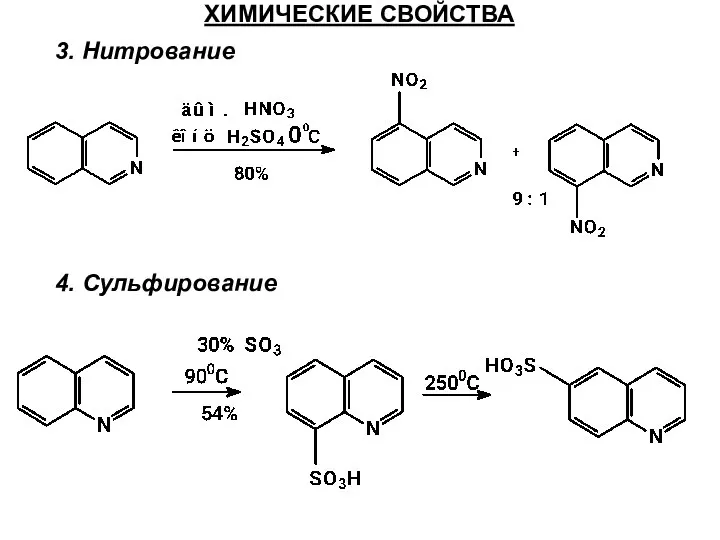
- 56. ХИМИЧЕСКИЕ СВОЙСТВА 3. Нитрование 4. Сульфирование
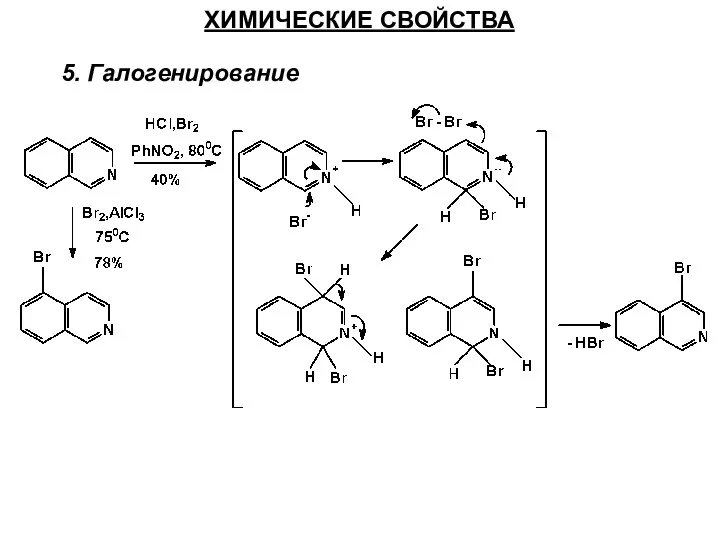
- 57. ХИМИЧЕСКИЕ СВОЙСТВА 5. Галогенирование
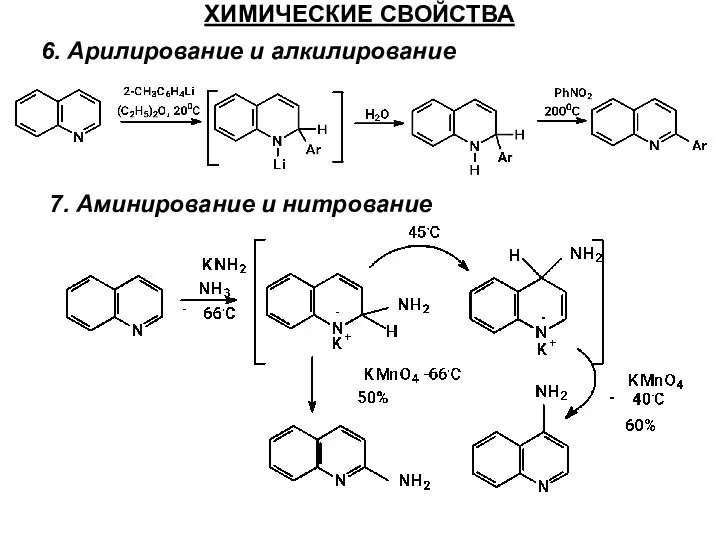
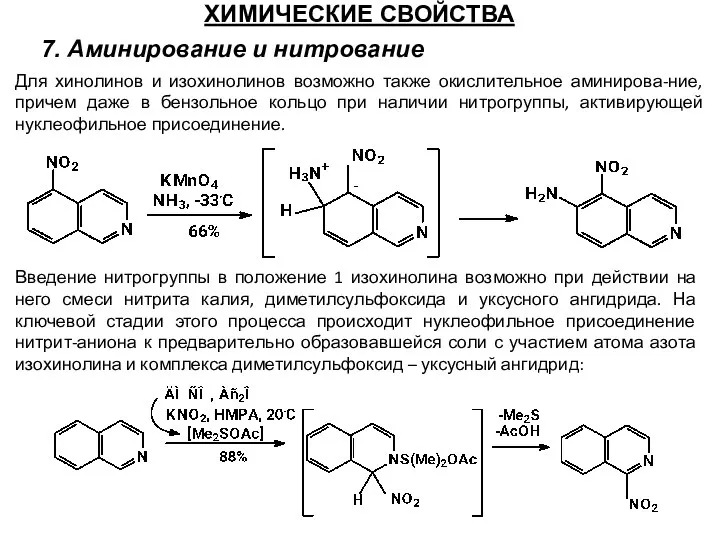
- 58. ХИМИЧЕСКИЕ СВОЙСТВА 6. Арилирование и алкилирование 7. Аминирование и нитрование
- 59. ХИМИЧЕСКИЕ СВОЙСТВА 7. Аминирование и нитрование Для хинолинов и изохинолинов возможно также окислительное аминирова-ние, причем даже
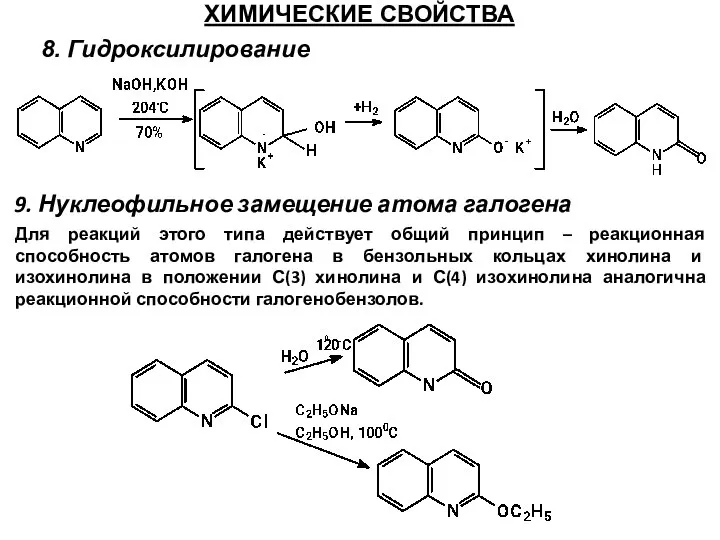
- 60. ХИМИЧЕСКИЕ СВОЙСТВА 8. Гидроксилирование 9. Нуклеофильное замещение атома галогена Для реакций этого типа действует общий принцип
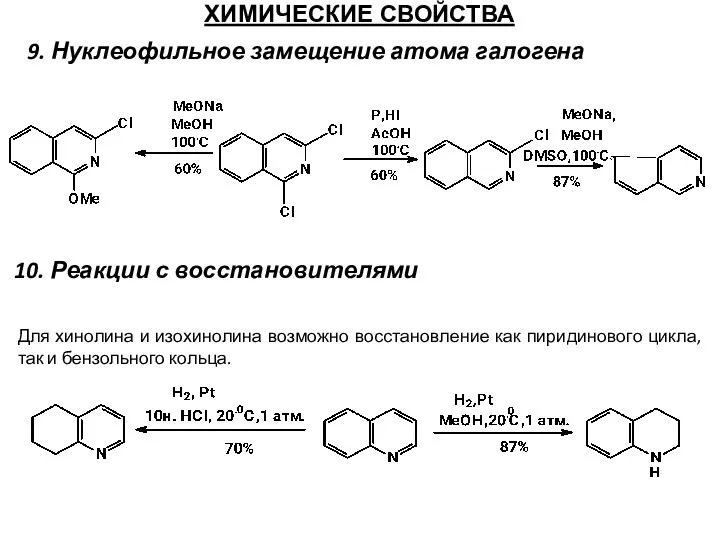
- 61. ХИМИЧЕСКИЕ СВОЙСТВА 9. Нуклеофильное замещение атома галогена 10. Реакции с восстановителями Для хинолина и изохинолина возможно
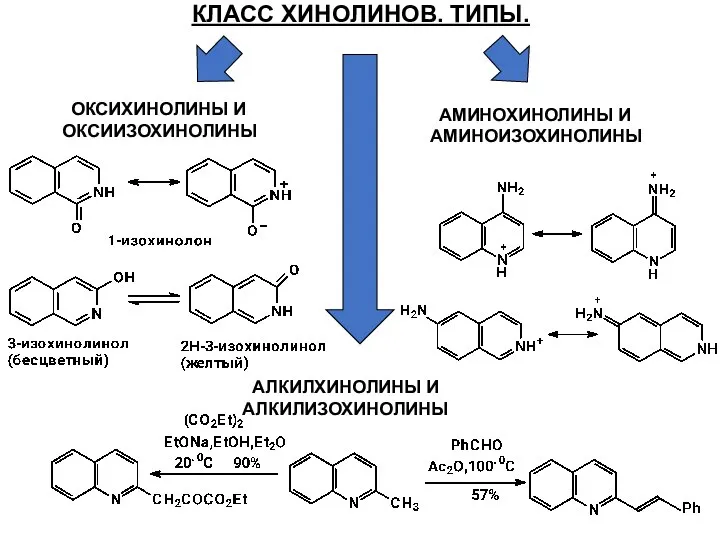
- 62. КЛАСС ХИНОЛИНОВ. ТИПЫ. ОКСИХИНОЛИНЫ И ОКСИИЗОХИНОЛИНЫ АМИНОХИНОЛИНЫ И АМИНОИЗОХИНОЛИНЫ АЛКИЛХИНОЛИНЫ И АЛКИЛИЗОХИНОЛИНЫ
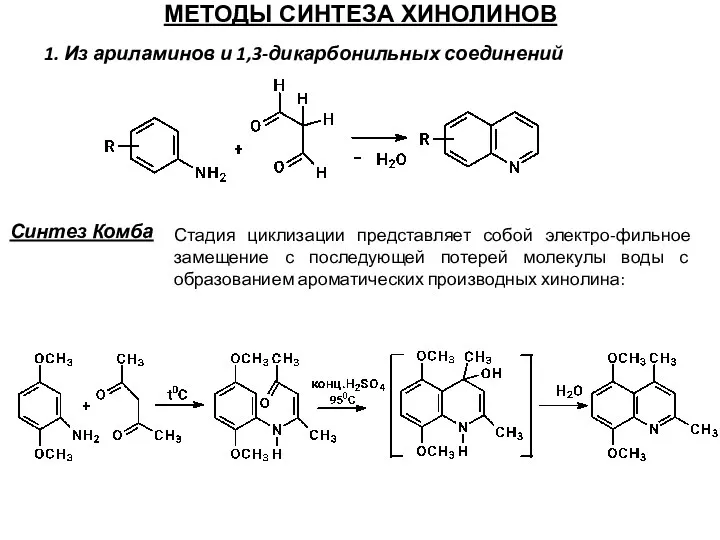
- 63. МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ 1. Из ариламинов и 1,3-дикарбонильных соединений Синтез Комба Стадия циклизации представляет собой электро-фильное
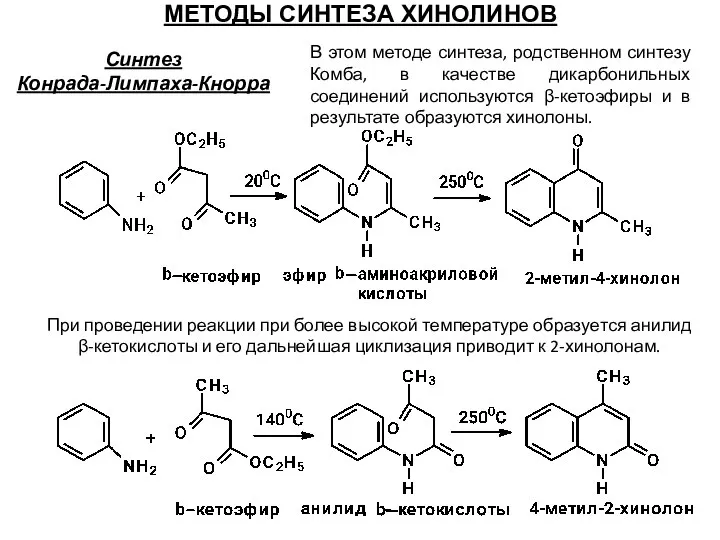
- 64. Синтез Конрада-Лимпаха-Кнорра МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ В этом методе синтеза, родственном синтезу Комба, в качестве дикарбонильных соединений
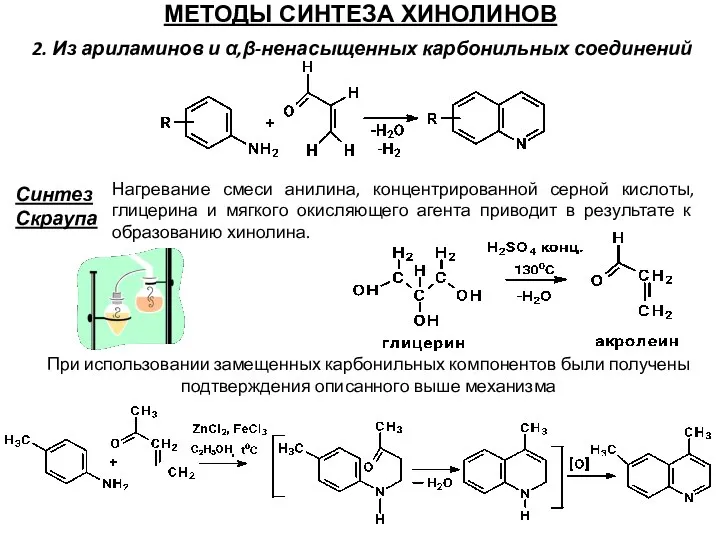
- 65. МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ 2. Из ариламинов и α,β-ненасыщенных карбонильных соединений Синтез Скраупа Нагревание смеси анилина, концентрированной
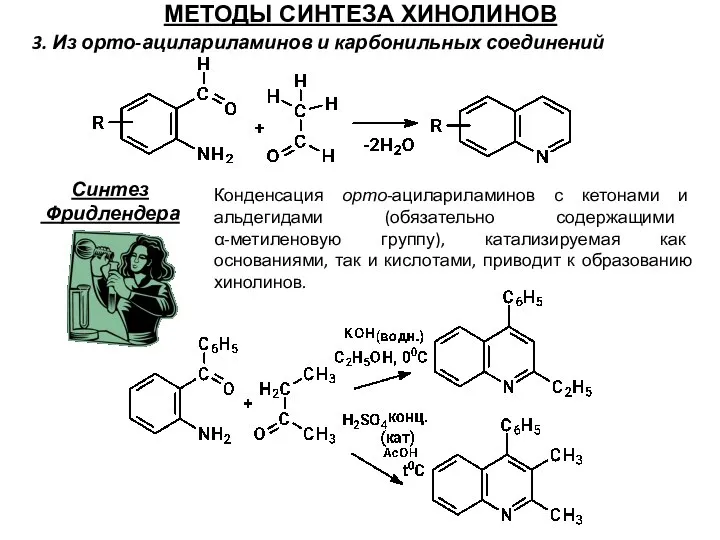
- 66. МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ 3. Из орто-ацилариламинов и карбонильных соединений Синтез Фридлендера Конденсация орто-ацилариламинов с кетонами и
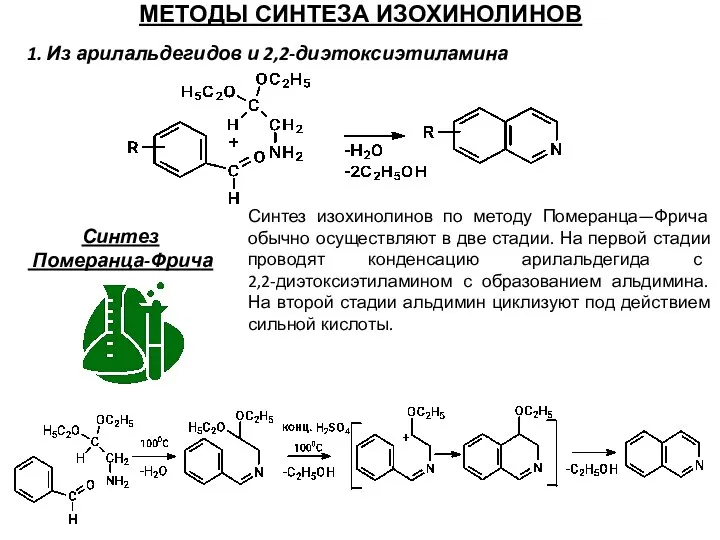
- 67. МЕТОДЫ СИНТЕЗА ИЗОХИНОЛИНОВ 1. Из арилальдегидов и 2,2-диэтоксиэтиламина Синтез Померанца-Фрича Синтез изохинолинов по методу Померанца—Фрича обычно
- 69. Скачать презентацию





 Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Физическая и коллоидная химия
Физическая и коллоидная химия Александр Михайлович БУТЛЕРОВ Презентация учителя химии школы №122 Центрального р-на Санкт-Петербурга Поспеловой Светланы Ви
Александр Михайлович БУТЛЕРОВ Презентация учителя химии школы №122 Центрального р-на Санкт-Петербурга Поспеловой Светланы Ви Водородная вода
Водородная вода Альдегиды и кетоны
Альдегиды и кетоны «Чорне золото» Виконала роботу Учениця 11-а класу Макарівського НВК Заріцька Вікторія
«Чорне золото» Виконала роботу Учениця 11-а класу Макарівського НВК Заріцька Вікторія  Новогаленовые. Максимально очищенные экстракционные препараты
Новогаленовые. Максимально очищенные экстракционные препараты Металлорудные ресурсы
Металлорудные ресурсы Гетерогенные процессы и равновесия
Гетерогенные процессы и равновесия Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно
Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно Электролиз
Электролиз Реакционная способность фенольных антиоксидантов при взаимодействии с пероксирадикалами
Реакционная способность фенольных антиоксидантов при взаимодействии с пероксирадикалами Первичная переработка-ХТТ и В
Первичная переработка-ХТТ и В Строение атома. (8 класс)
Строение атома. (8 класс) Задачи по теме Энергетический обмен
Задачи по теме Энергетический обмен Динамика фотоионизации атомов благородных газов между первым и вторым порогом ионизации
Динамика фотоионизации атомов благородных газов между первым и вторым порогом ионизации Углерод и его соединения
Углерод и его соединения Органічне добриво
Органічне добриво Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Гидролиз солей
Гидролиз солей Кристаллизации металлов. Методы исследования металлов
Кристаллизации металлов. Методы исследования металлов Предмет органической химии
Предмет органической химии Идентификация органических соединений
Идентификация органических соединений Получение фосфорной кислоты
Получение фосфорной кислоты Минералы натрия
Минералы натрия Неметаллы: общая характеристика
Неметаллы: общая характеристика Ароматичні вуглеводні Арени Підготував Учень 11-А класу Пазуханич Руслан
Ароматичні вуглеводні Арени Підготував Учень 11-А класу Пазуханич Руслан  Анализ карбоновых кислот и их производных
Анализ карбоновых кислот и их производных