Содержание
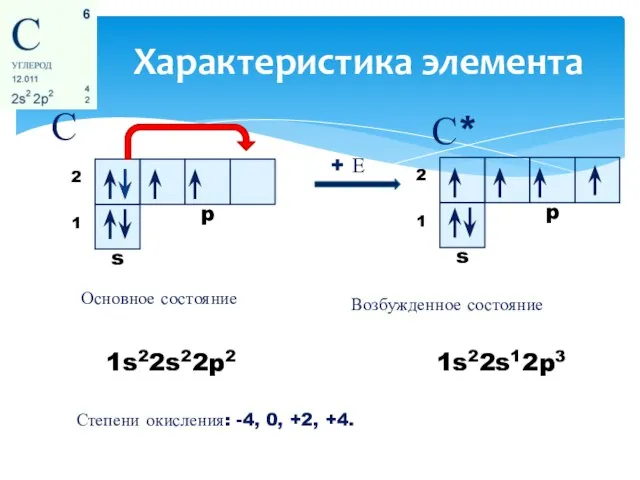
- 2. Характеристика элемента С С* 1s22s22p2 1s22s12p3 Основное состояние + Е Возбужденное состояние Степени окисления: -4, 0,
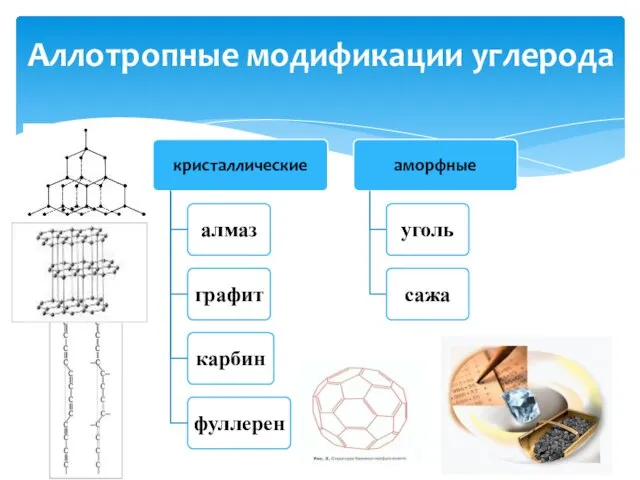
- 3. Аллотропные модификации углерода
- 4. При разложении древесины без доступа воздуха и при обугливании органических соединений образуется углерод (сажа). конц.Н2SO4 C6Н12О6
- 5. 1) с металлами образует карбиды 4Al+3C=Al4C3 (при нагревании) Из карбида алюминия получают метан Al4C3 +12H2O =4Al(OH)3+
- 6. 3) горит в кислороде с выделением большого количества тепла 2C + O2 = 2CO + Q
- 7. C + 4 НNO3 = CO2 + 4NО2 + 2Н2O конц. C + 2 Н2SO4 =
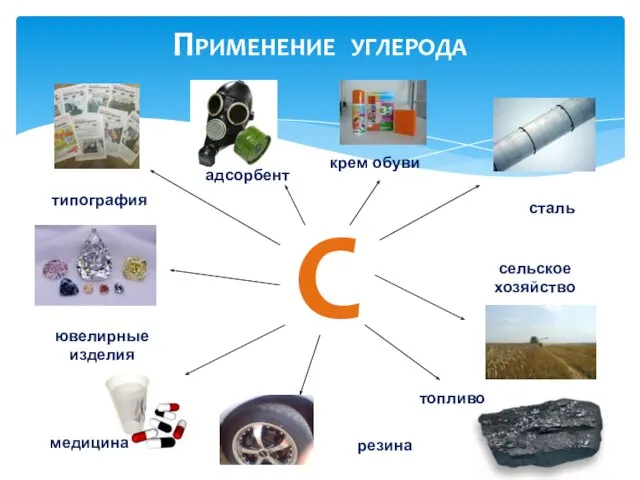
- 8. С сталь сельское хозяйство топливо медицина типография ювелирные изделия адсорбент резина крем обуви Применение углерода
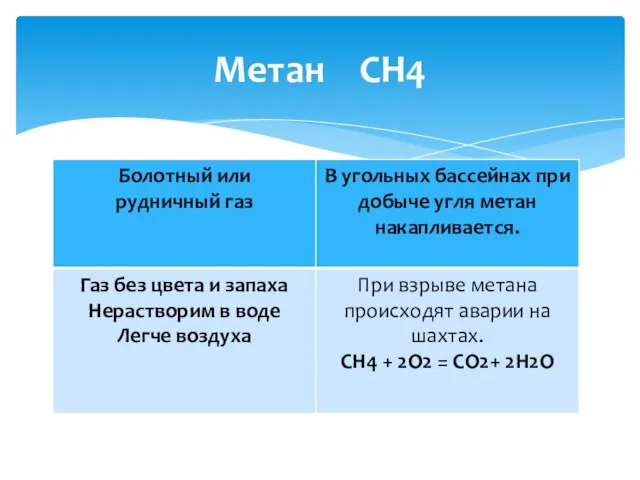
- 9. Метан СН4
- 11. несолеобразующий кислотный СО2 + 2 NaОН = Na2CO3 + H2O СО2 + СаО = СаСО3 восстановитель
- 12. H2CO3 – очень слабая и неустойчивая кислота, разлагается при кипячении. Диссоциация: H2CO3 Н+ + HCO3 -
- 13. Соли: средние – карбонаты Nа2СО3, СаСО3 и кислые – гидрокарбонаты NаНСО3, Са(НСО3)2 1) разлагаются при нагревании:
- 14. Карбонаты и гидрокарбонаты легко превращаются друг в друга. При этом в природе образуются причудливые сталактиты и
- 15. Соли угольной кислоты Гидрокарбонат натрия – NaHCO3 , питьевая, или пищевая сода Добавляется в кондитерские изделия,
- 16. Соли угольной кислоты Карбонат калия - K2CO3 – поташ Применяется в производстве тугоплавкого стекла, жидкого мыла.
- 17. Высший оксид ЭО2 - СО2, гидроксид Н2ЭО3 - Н2СО3 Ответ: А ______________ Ответ: А Высший оксид
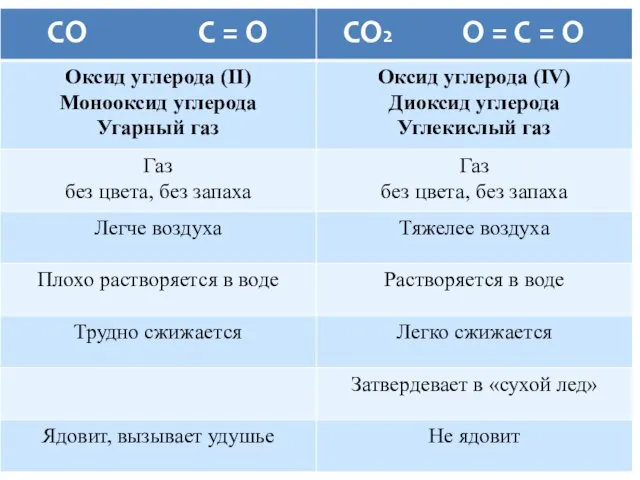
- 18. Ответ: В. __________________ С раствором NaOH не прореагировал угарный газ СО. Мr (СО) = 28 Ответ:
- 19. Средние соли – карбонаты, кислые соли - гидрокарбонаты Ответ: С. ___________________ Водный раствор хлороводорода – соляная
- 20. Карбонатная жесткость обусловлена присутствием гидрокарбонатами кальция и магния Ответ: Е _______________ Ответ: D
- 21. СО2 + 2КОН = К2СО3 + Н2О СО2 + 2К+ + 2ОН- = 2К+ + СО32-
- 29. Решение без расчетов. Возможно образование солей: Nа2СО3 или NаНСО3. В обоих случаях среда растворов солей щелочная.
- 30. 4,48 л 2,24 л х л 2CO + О2 = 2СО2 2 л 1 л 2
- 31. СО2 + 2Мg = 2МgО + С 2С + Са = СаС2 CaC2 + 2H2O= Ca(OH)2
- 33. Скачать презентацию

























 Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины
Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины Углерод и кремний
Углерод и кремний The development of nanoporous hydrogen storages
The development of nanoporous hydrogen storages Гидролиз неорганических соединений
Гидролиз неорганических соединений Основные понятия и законы химии
Основные понятия и законы химии Тема: Мониторинг воды и осадков в разное время года. Творческое название проекта: «Пить или не пить - вот в чем вопрос» Авторы:Коньк
Тема: Мониторинг воды и осадков в разное время года. Творческое название проекта: «Пить или не пить - вот в чем вопрос» Авторы:Коньк Процессы, происходящие при плавке и литье металлов
Процессы, происходящие при плавке и литье металлов Физиология системы крови. Физико-химические свойства крови
Физиология системы крови. Физико-химические свойства крови Презентация по Химии "Молекула в расчетных методах" - скачать смотреть
Презентация по Химии "Молекула в расчетных методах" - скачать смотреть  Мягкие лекарственные формы. Мази, капсулы, суппозитории, пластыри
Мягкие лекарственные формы. Мази, капсулы, суппозитории, пластыри Энергетические условия и механизм процесса кристаллизации
Энергетические условия и механизм процесса кристаллизации Устойчивость и коагуляция коллоидных растворов
Устойчивость и коагуляция коллоидных растворов Методы исследования химического состава нефти и продуктов ее переработки
Методы исследования химического состава нефти и продуктов ее переработки Строение газообразных, жидких, твердых тел
Строение газообразных, жидких, твердых тел Глауконит
Глауконит Природні джерела вуглеводнів
Природні джерела вуглеводнів Фосфор. Строение и свойства
Фосфор. Строение и свойства Диаграммы состояния двухкомпонентных сплавов
Диаграммы состояния двухкомпонентных сплавов Домашний эксперимент № 7 по химии Цветные опыты - на стыке двух наук
Домашний эксперимент № 7 по химии Цветные опыты - на стыке двух наук Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Презентация Витамин С
Презентация Витамин С Спирты. Химические свойства
Спирты. Химические свойства Полимерлену. Полимерлердің түзілу әдістері
Полимерлену. Полимерлердің түзілу әдістері Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья
Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья Решение задач на нахождение молекулярной формулы органических веществ
Решение задач на нахождение молекулярной формулы органических веществ Презентация 2 ПС ПЗ (1)
Презентация 2 ПС ПЗ (1) Химическое сопротивление алюминий и его сплавов
Химическое сопротивление алюминий и его сплавов Илік заттар. Тітіркендіруші заттар. Қапталғыш заттар, адсорбциялаушы заттар
Илік заттар. Тітіркендіруші заттар. Қапталғыш заттар, адсорбциялаушы заттар