Содержание
- 2. Химическая кинетика – учение о скорости химических реакций и факторах, влияющих на неё; Химическая реакция –
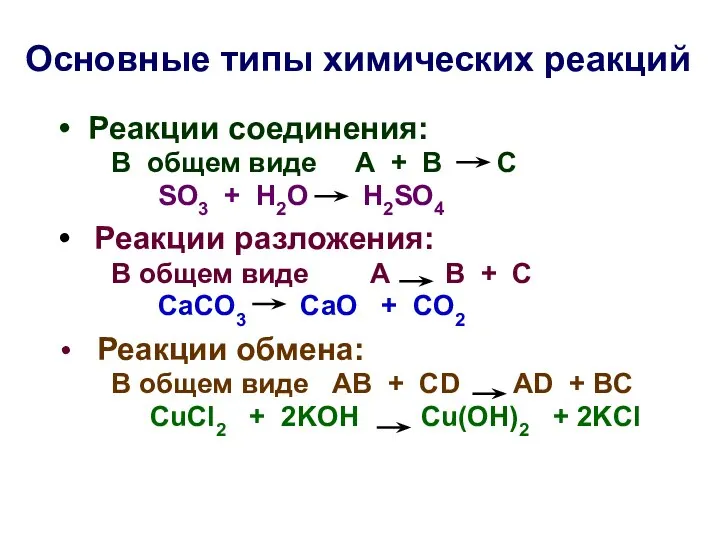
- 3. Основные типы химических реакций Реакции соединения: В общем виде А + В С SO3 + H2O
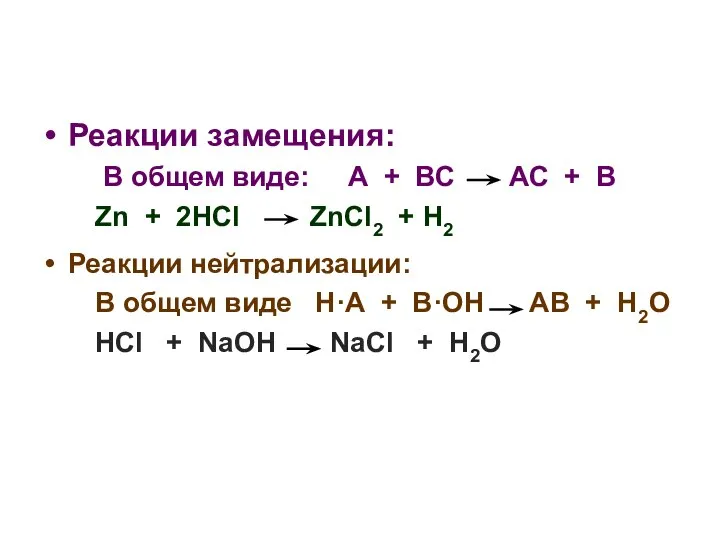
- 4. Реакции замещения: В общем виде: А + ВС АС + В Zn + 2HCl ZnCl2 +
- 5. Обязательные условия протекания химических реакций Столкновения молекул; Наличие у молекул в момент столкновения повышенного запаса энергии;
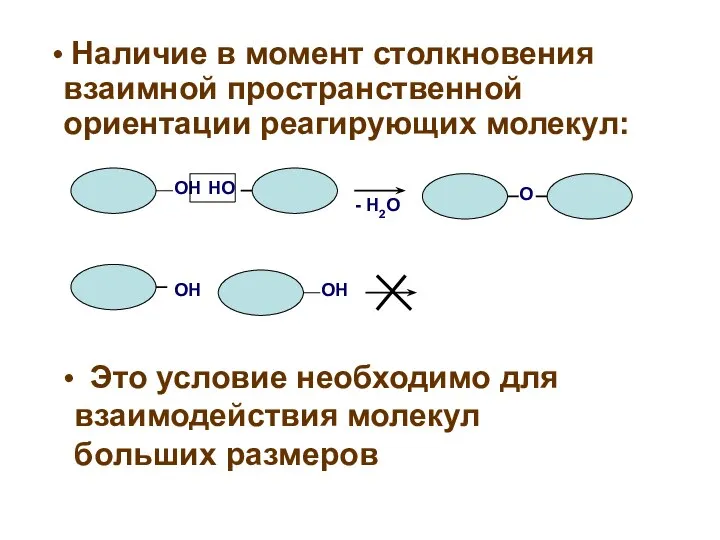
- 6. ОН НО О - Н2О ОН ОН Наличие в момент столкновения взаимной пространственной ориентации реагирующих молекул:
- 7. Скорость химической реакции Скорость химической реакции показывает какое количество молекул вступает в реакцию или образуется за
- 8. Зависимость скорости реакции от концентрации реагирующих веществ Эту зависимость описывает закон действующих масс: скорость химической реакции
- 9. Зависимость скорости химической реакции от температуры С повышением температуры скорость химических реакций возрастает, так как увеличивается
- 10. Температурный коэффициент Вант-Гоффа Температурный коэффициент Вант-Гоффа указывает во сколько раз возрастает скорость конкретной реакции при увеличении
- 11. Зная величину температурного коэффициента можно рассчитать скорость реакции при любой температуры; Для этого достаточно определить скорость
- 12. Катализ Катализ – повышение скорости химической реакции под действием вещества, которое не является участником данной реакции;
- 13. Для любого катализа характерны следующие закономерности: В процессе химической реакции катализатор подвергается изменениям, из одной формы
- 14. Катализ гомогенный гетерогенный В случае гомогенного катализа все его участники: катализатор, исходные и конечные продукты реакции
- 15. Гомогенный катализ Химическая реакция осуществляется более сложным, обходным путем; Катализатор вступает в реакции с исходными веществами,
- 16. Все промежуточные реакции, протекающие с участием катализатора, имеют низкую величину энергии активации и поэтому у них
- 17. Гетерогенный катализ Гетерогенный катализатор является твердым телом с большой поверхностью вследствие пористости (губчатая платина, активированный уголь
- 18. За счет сорбции большого количества молекул реагирующих веществ на поверхности катализатора создается повышенная локальная (местная) концентрация
- 19. Необратимые химические реакции Необратимые химические реакции встречаются не часто; Условия необратимости реакций: Выпадение конечных продуктов в
- 20. Обратимые химические реакции Большинство химических реакций являются обратимыми и протекают в двух направлениях; А + В
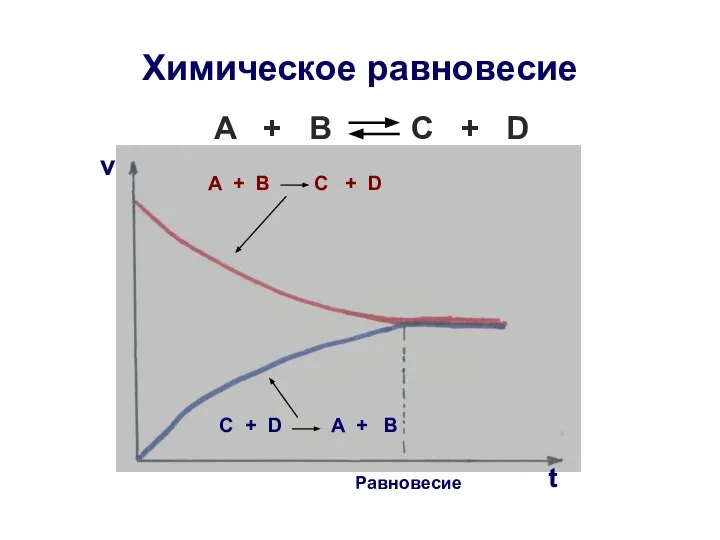
- 21. Химическое равновесие A + B C + D А + В C + D С +
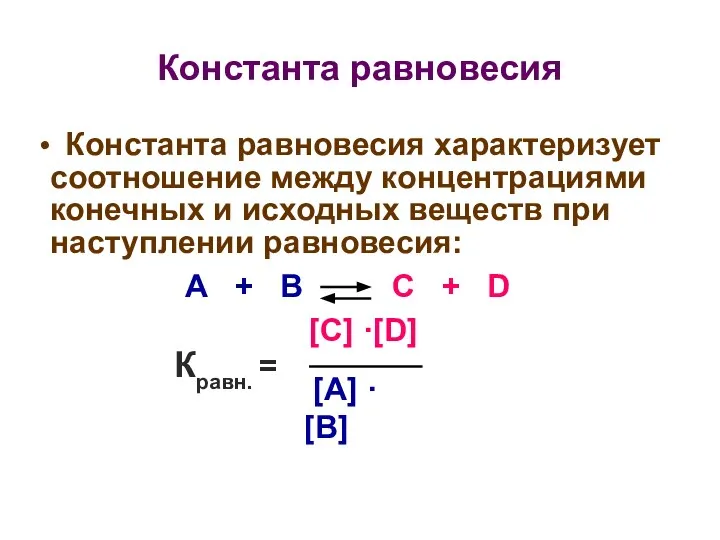
- 22. Константа равновесия Константа равновесия характеризует соотношение между концентрациями конечных и исходных веществ при наступлении равновесия: А
- 23. Услoвия равновесия Прямая и обратная стадии протекают с одинаковой скоростью: V1 = V2 Концентрации исходных и
- 24. A + B C + D + Q Температура не изменяется t° = сonst N2 +
- 25. Принцип (правило) Ле Шателье При воздействие на обратимую химическую реакцию, находящуюся в равновесии, какого-либо фактора повышается
- 26. А + В С + D Дополнительное поступление в реакционную среду исходных веществ (A,B) или удаление
- 27. A + B C + D + Q При нагревании повышается скорость эндотермической реакции, так как
- 28. N2 + 3H2 2NH3 При повышении давления повышается скорость той стадии, которая приводит у уменьшению объема,
- 29. Тест 1 Константой химической реакции является: а) скорость реакции б) температура в) концентрация реагирующих веществ г)
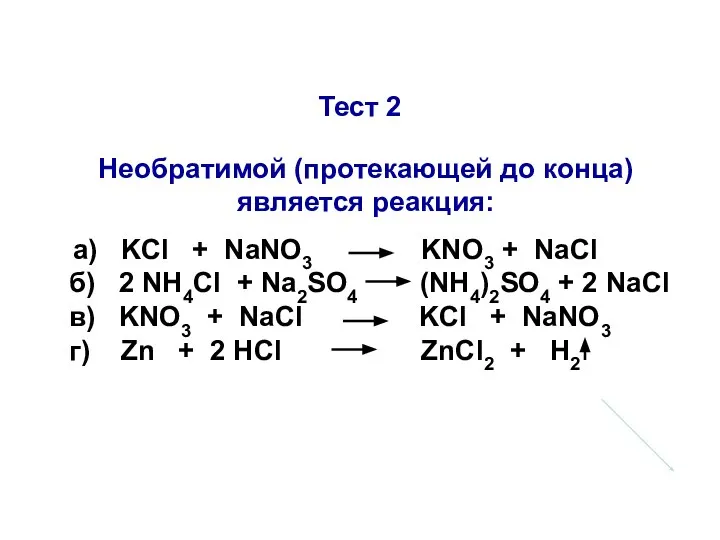
- 30. Тест 2 Необратимой (протекающей до конца) является реакция: а) KCl + NaNO3 KNO3 + NaCl б)
- 31. Тест 3 Температурный коэффициент Вант-Гоффа показывает во сколько раз увеличивается скорость реакции при повышении температуры: а)
- 32. Тест 4 За 5 мин. концентрация реагирующих веществ снизилась с 10 моль/л до 5 моль/л. Скорость
- 33. Тест 5 При 20ºС химическая реакция с температурным коэффициентом Вант-Гоффа, равным 3, полностью протекает за 18
- 34. Тест 6 Для повышения скорости химической реакции (γ = 2) в 8 раз температуру необходимо повысить
- 35. Следующая лекция 12 сентября (понедельник) в ауд. 419 в 12 час. Не опаздывать!
- 37. Скачать презентацию




























 Методы обеззараживания воды
Методы обеззараживания воды Аттестационная работа. Методика исследовательской деятельности учащихся. Химическое знание, 10 -11 классы
Аттестационная работа. Методика исследовательской деятельности учащихся. Химическое знание, 10 -11 классы Основные классы неорганических и органических соединений
Основные классы неорганических и органических соединений Презентация по Химии "Кристаллические решетки" - скачать смотреть _
Презентация по Химии "Кристаллические решетки" - скачать смотреть _ Обмен отдельных аминокислот. Образование аммиака и пути его обезвреживания в организме. Лекция 1
Обмен отдельных аминокислот. Образование аммиака и пути его обезвреживания в организме. Лекция 1 Аналитический контроль качества химических соединений.
Аналитический контроль качества химических соединений. Кремний – бог неорганической природы
Кремний – бог неорганической природы Кислотно-основное титрование
Кислотно-основное титрование Презентация по химии на тему: «Мёд»
Презентация по химии на тему: «Мёд»  Алмазы, искусственный и естественный рост
Алмазы, искусственный и естественный рост Екологія води Алєксєєнко, Жуковська
Екологія води Алєксєєнко, Жуковська  Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Значення хімічних процесів у природі
Значення хімічних процесів у природі Цемент. (9 класс)
Цемент. (9 класс) Глина. Минералы, содержащиеся в глинах
Глина. Минералы, содержащиеся в глинах Метаболизм нуклеотидов
Метаболизм нуклеотидов Презентация по Химии "8 класс Обобщение знаний по теме СЛОЖНЫЕ ВЕЩЕСТВА" - скачать смотреть бесплатно
Презентация по Химии "8 класс Обобщение знаний по теме СЛОЖНЫЕ ВЕЩЕСТВА" - скачать смотреть бесплатно Презентация по Химии "Уран" - скачать смотреть
Презентация по Химии "Уран" - скачать смотреть  ОВР в органической химии Автор: Тятин Павел Владимирович, 11М класс, МОУ лицей №6 Руководитель: Дробот Светлана Сергеевна , учит
ОВР в органической химии Автор: Тятин Павел Владимирович, 11М класс, МОУ лицей №6 Руководитель: Дробот Светлана Сергеевна , учит Умный йод
Умный йод Ядовитые технические жидкости на современном этапе
Ядовитые технические жидкости на современном этапе Презентация по Химии "Жуёшь, жуёшь, не пережуёшь" - скачать смотреть
Презентация по Химии "Жуёшь, жуёшь, не пережуёшь" - скачать смотреть  Подкласс Иносиликаты (цепочечные/ленточные силикаты)
Подкласс Иносиликаты (цепочечные/ленточные силикаты) Поліметилметакрилат
Поліметилметакрилат Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Полиэтилен высокого давления
Полиэтилен высокого давления Молекулярная биология. Белки нервной системы
Молекулярная биология. Белки нервной системы Тела и вещества
Тела и вещества