Содержание
- 2. Основные типы процессов протекания химических реакций в реакторе Порядок и молекулярность реакции Элементы формальной кинетики Простая
- 3. Две параллельные реакции простого порядка Последовательные реакции Обратимые реакции первого порядка Зависимость скорости от температуры Энергия
- 4. Химическая кинетика — наука о скоростях химических реакций. Химическая кинетика изучает законы протекания химических реакций во
- 5. На скорость химической реакции оказывают влияние все условия ее протекания: природа реагирующих веществ, их фазовое состояние,
- 6. Химические процессы обычно осуществляются двумя способами: , 1) статическим — в замкнутых закрытых реакторах при постоянном
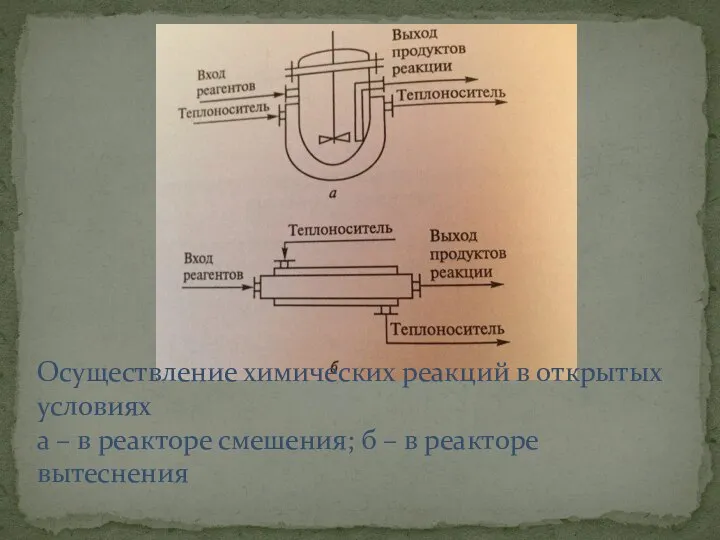
- 7. Осуществление химических реакций в открытых условиях а – в реакторе смешения; б – в реакторе вытеснения
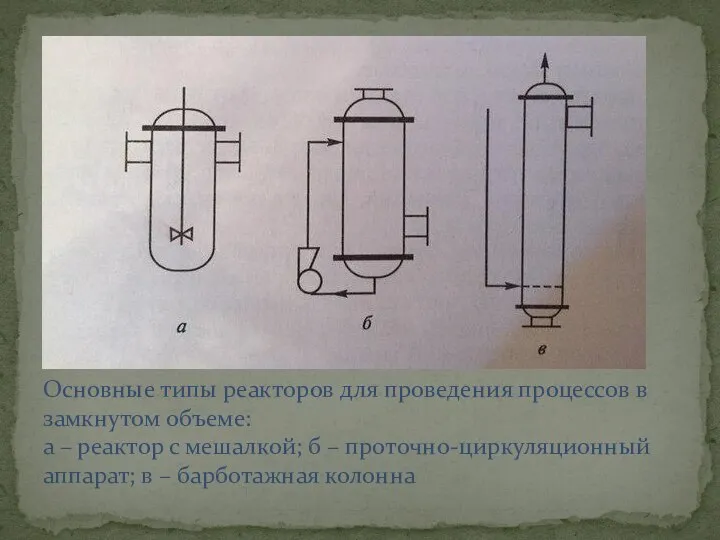
- 8. Основные типы реакторов для проведения процессов в замкнутом объеме: а – реактор с мешалкой; б –
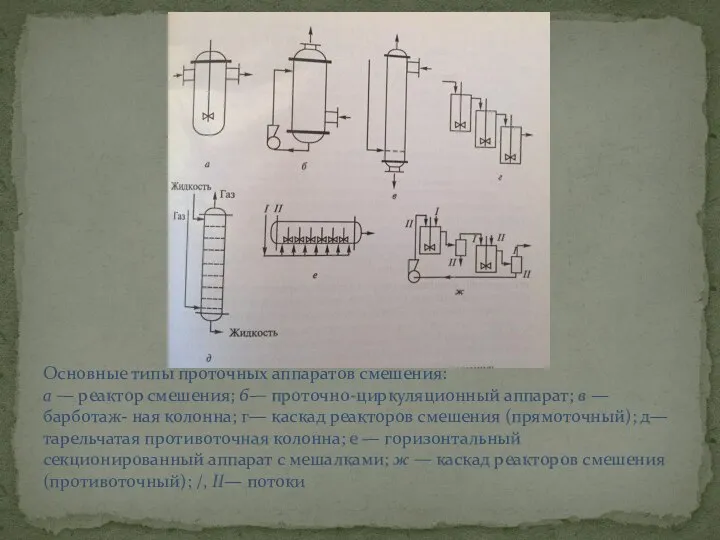
- 9. Основные типы проточных аппаратов смешения: а — реактор смешения; б— проточно-циркуляционный аппарат; в — барботаж- ная
- 10. Закономерности кинетики химических процессов существенно зависят от фазового состава системы. Поэтому различают: химические процессы, протекающие в
- 11. Основные типы процессов протекания химических реакций в реакторе
- 12. Основным законом химической кинетики является закон действующих масс Гульдберга и Вааге (1867 г.): скорость элементарной химической
- 13. Константа скорости химической реакции к зависит от температуры и природы реагирующих веществ, но не зависит от
- 14. Для нахождения молекулярности реакции часто достаточно знать коэффициенты в уравнении процесса. Однако сам процесс может складываться
- 15. Таким образом, приведенная реакция А + 2В = АВ2 является не тримолекулярной, а бимолекулярной. Как бимолекулярная
- 16. Эта реакция осуществляется в две стадии: N205 = N203 + 02 N203 + N205 = 4N02
- 17. Основное уравнение химической кинетики — закон действующих масс — дает возможность математического описания кинетики различных процессов
- 18. Реакция первого порядка может быть записана в общем виде: аA→продукты Примером такой реакции может служить реакция
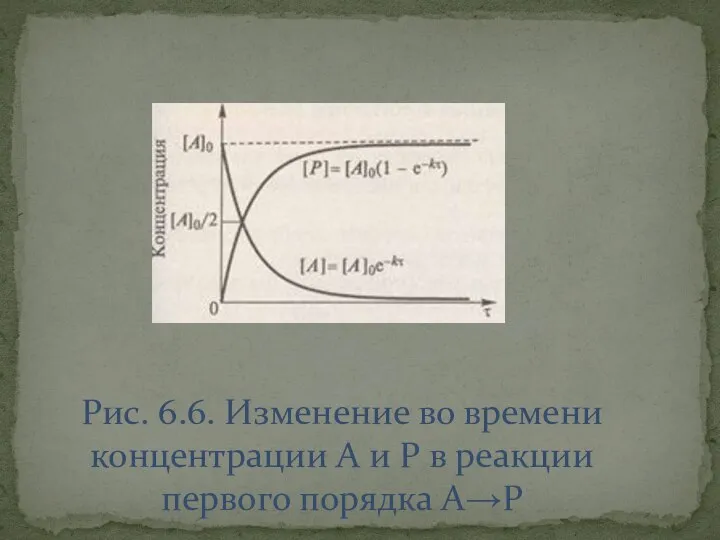
- 19. Рис. 6.6. Изменение во времени концентрации A и P в реакции первого порядка A→P
- 20. Простая реакция второго порядка может протекать по двум кинетическим схемам: 2A → P и А1 +
- 21. d[A]/dt = -к[А]2 Интегрирование этого уравнения приводит к выражению: 1 /[А] - 1/[A]0 = 2kt. (6.3)
- 22. Константу скорости можно вычислить, подставляя экспериментальные значения [А] при разных значениях времени t в преобразованное уравнение:
- 23. Две параллельные реакции первого порядка
- 24. Реагент А превращается в Р через промежуточный продукт В. Кинетический анализ зависит от соотношения реакционной способности
- 25. 2.k1 [В] [А]0 = [А] + [В] + [Р] упрощается, так как мы можем пренебречь концентрацией
- 26. Последовательные реакции
- 28. Обратимая реакция первого порядка
- 29. Зависимость скорости реакции от температуры Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет,
- 30. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции: ,где k — константа скорости
- 32. Скачать презентацию















![d[A]/dt = -к[А]2 Интегрирование этого уравнения приводит к выражению: 1 /[А]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1347006/slide-20.jpg)
![Константу скорости можно вычислить, подставляя экспериментальные значения [А] при разных значениях](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1347006/slide-21.jpg)


![2.k1 [В] [А]0 = [А] + [В] + [Р] упрощается, так](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1347006/slide-24.jpg)





 Реакции координированных лигандов
Реакции координированных лигандов Процессы коксования
Процессы коксования Кам’яне вугілля, продукти його переробки
Кам’яне вугілля, продукти його переробки ЗАСТОСУВАННЯ РІДКИХ КРИСТАЛІВ Виконала учениця 10 класу Гаєвська Зоряна
ЗАСТОСУВАННЯ РІДКИХ КРИСТАЛІВ Виконала учениця 10 класу Гаєвська Зоряна  Грубодисперсные системы. Эмульсии
Грубодисперсные системы. Эмульсии Практика по химии
Практика по химии Липиды. Классификация липидов
Липиды. Классификация липидов Презентація на тему: “Життя та творчість Д.І.Менделєєва”
Презентація на тему: “Життя та творчість Д.І.Менделєєва”  Обобщающий урок по теме «Неметаллы» 9 класс
Обобщающий урок по теме «Неметаллы» 9 класс Аминокислоты – структурные единицы белков
Аминокислоты – структурные единицы белков Комплексные соединения
Комплексные соединения p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены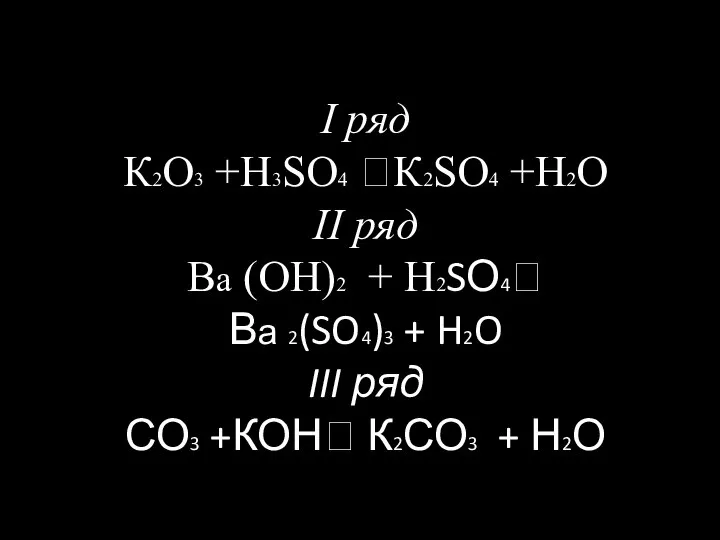 I ряд К2О3 +Н3SO4 К2SO4 +Н2О II ряд Ва (ОН)2 + Н2SО4 Ва 2(SO4)3 + H2O III ряд СО3 +КОН К2СО3 + Н2О
I ряд К2О3 +Н3SO4 К2SO4 +Н2О II ряд Ва (ОН)2 + Н2SО4 Ва 2(SO4)3 + H2O III ряд СО3 +КОН К2СО3 + Н2О Периодический закон. Строение атома
Периодический закон. Строение атома Геометрия молекул
Геометрия молекул Альдегиды и кетоны
Альдегиды и кетоны Коллоидная химия наночастиц
Коллоидная химия наночастиц Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Школа экспериментов
Школа экспериментов Общая характеристика элементов IIIA-группы. Бор. Алюминий
Общая характеристика элементов IIIA-группы. Бор. Алюминий Урок в 7 класі КЗ Верхівцевського НВК учитель хімії Кукса Н.М.
Урок в 7 класі КЗ Верхівцевського НВК учитель хімії Кукса Н.М.  Химический процесс. Практические занятия
Химический процесс. Практические занятия Основы биоэнергетики. (Лекция 12)
Основы биоэнергетики. (Лекция 12) Углерод. Нахождение в природе
Углерод. Нахождение в природе Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Силикатная промышленность
Силикатная промышленность Реологические свойства полимеров
Реологические свойства полимеров Физическая и коллоидная химия
Физическая и коллоидная химия