Содержание
- 2. Виды химической связи ковалентная ионная металлическая водородная
- 3. Ковалентная связь и механизмы ее образования Механизмы образования ковалентной связи Выделяют два механизма образования ковалентной связи:
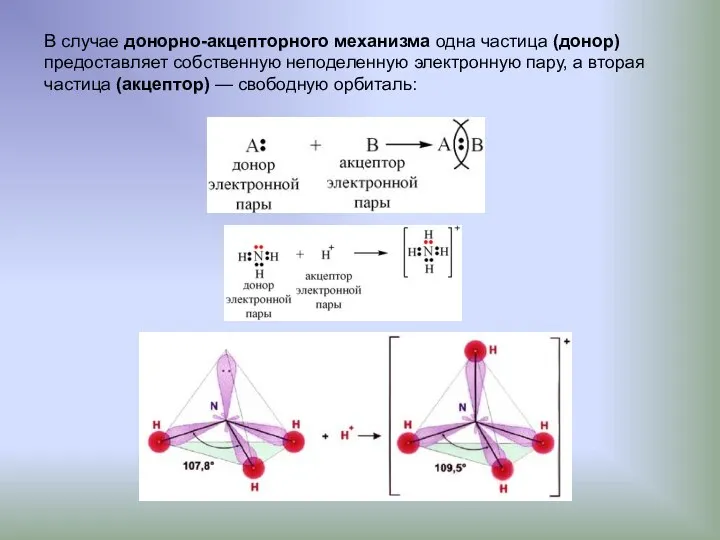
- 4. В случае донорно-акцепторного механизма одна частица (донор) предоставляет собственную неподеленную электронную пару, а вторая частица (акцептор)
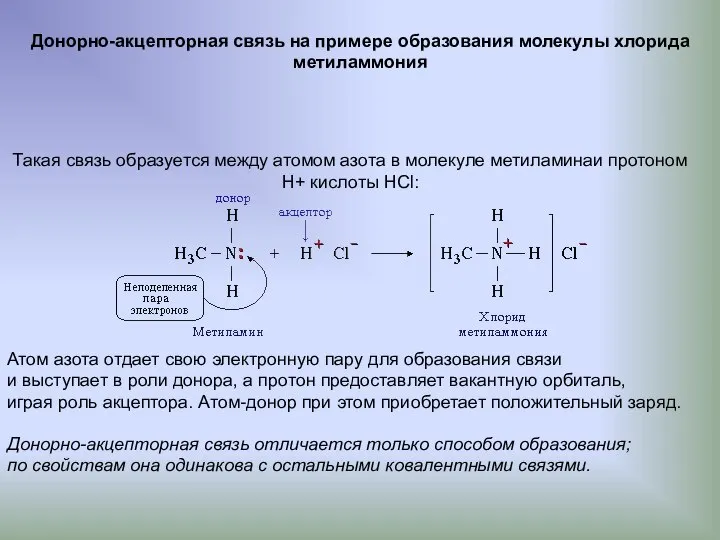
- 5. Донорно-акцепторная связь на примере образования молекулы хлорида метиламмония Такая связь образуется между атомом азота в молекуле
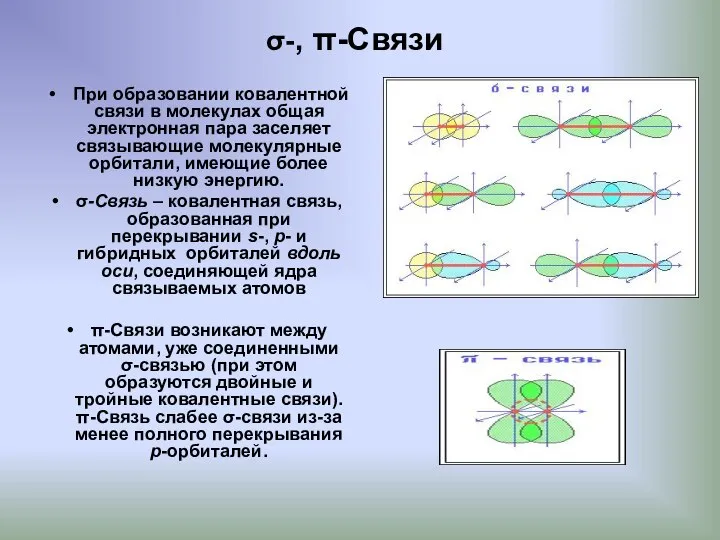
- 6. σ-, π-Связи При образовании ковалентной связи в молекулах общая электронная пара заселяет связывающие молекулярные орбитали, имеющие
- 7. Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. σ-Связь прочнее π-связи; по
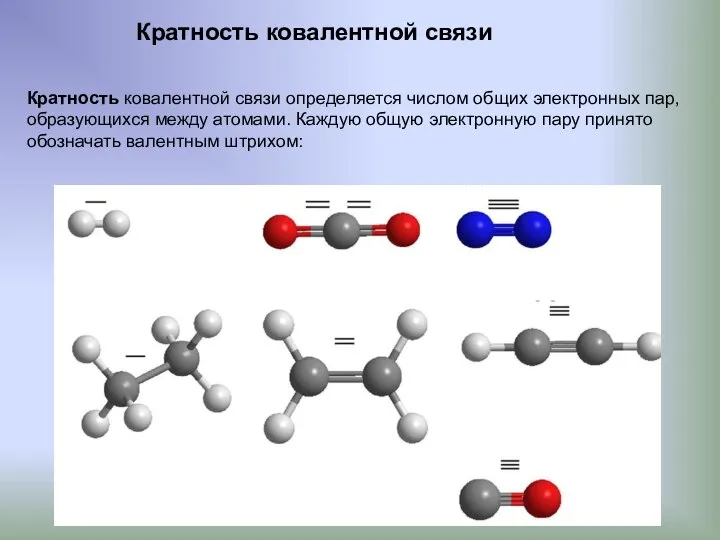
- 8. Кратность ковалентной связи Кратность ковалентной связи определяется числом общих электронных пар, образующихся между атомами. Каждую общую
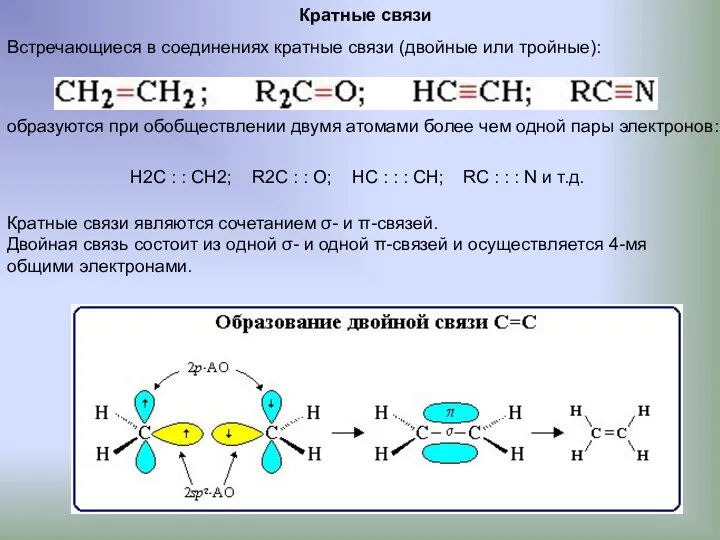
- 9. Кратные связи Встречающиеся в соединениях кратные связи (двойные или тройные): образуются при обобществлении двумя атомами более
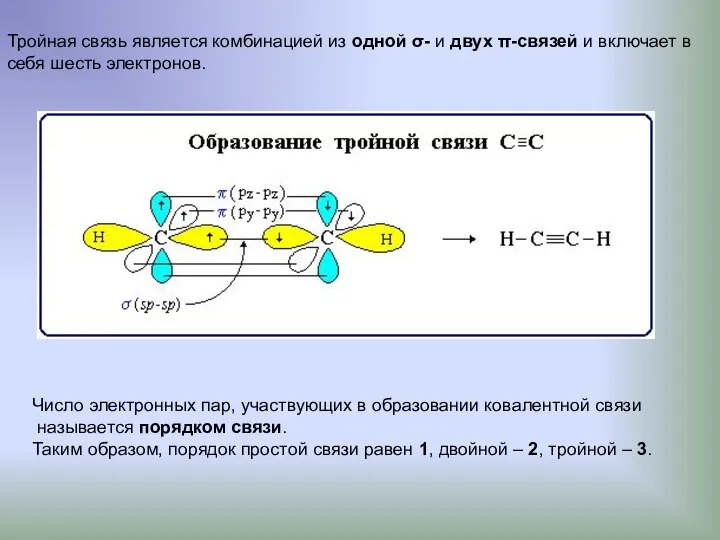
- 10. Тройная связь является комбинацией из одной σ- и двух π-связей и включает в себя шесть электронов.
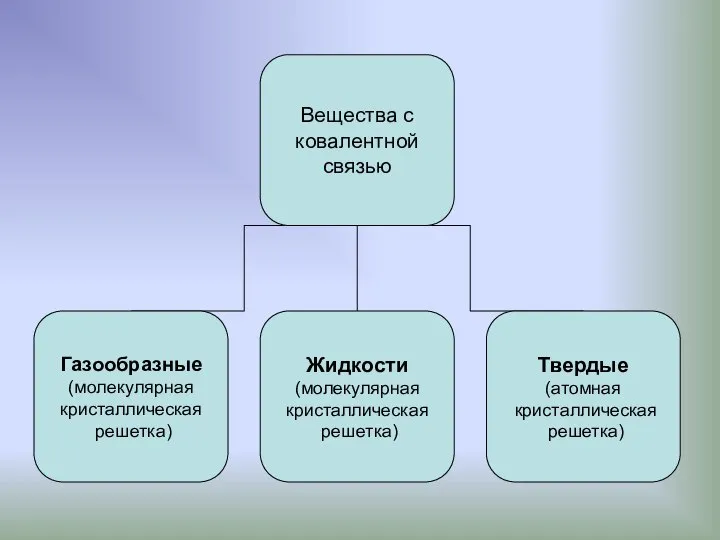
- 11. Характеристики ковалентной связи Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент.
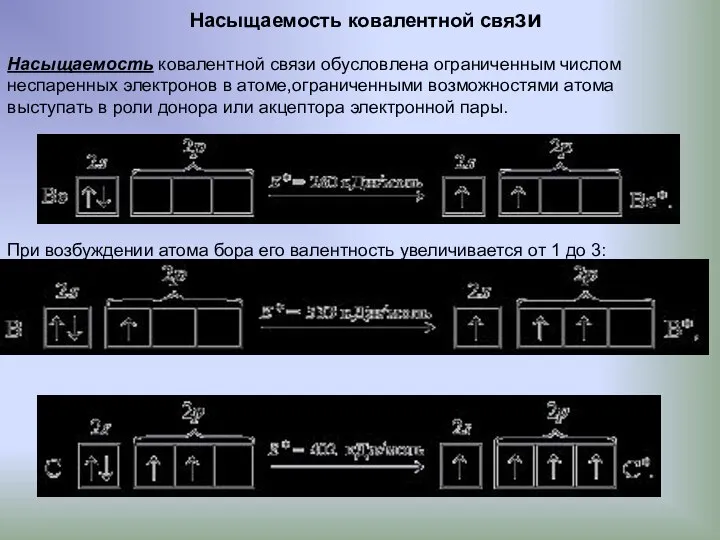
- 12. Насыщаемость ковалентной связи Насыщаемость ковалентной связи обусловлена ограниченным числом неспаренных электронов в атоме,ограниченными возможностями атома выступать
- 13. Направленность ковалентной связи Направленность ковалентной связи обусловлена определенным пространственным расположением электронных орбиталей взаимодействующих атомов. Так, угол
- 14. Условия неполярности молекулы высокая симметричность (наличие более двух осей симметрии) отсутствие неподеленных электронных пар у центрального
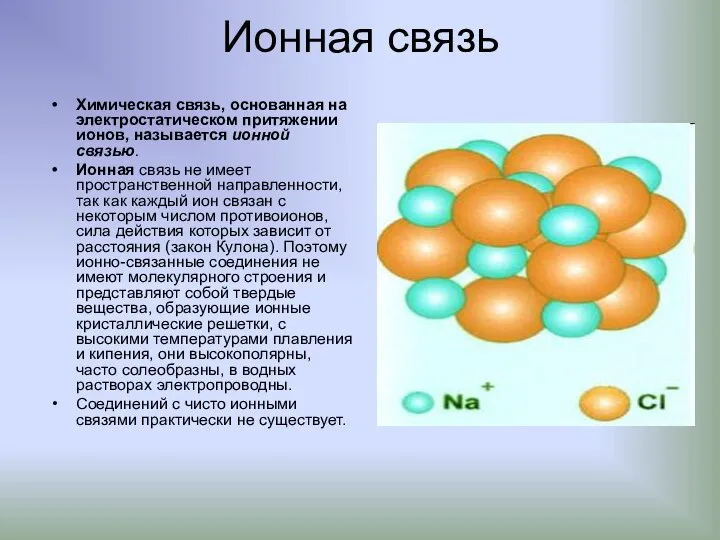
- 16. Ионная связь Химическая связь, основанная на электростатическом притяжении ионов, называется ионной связью. Иoннaя связь не имеет
- 17. Металлическая связь Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние
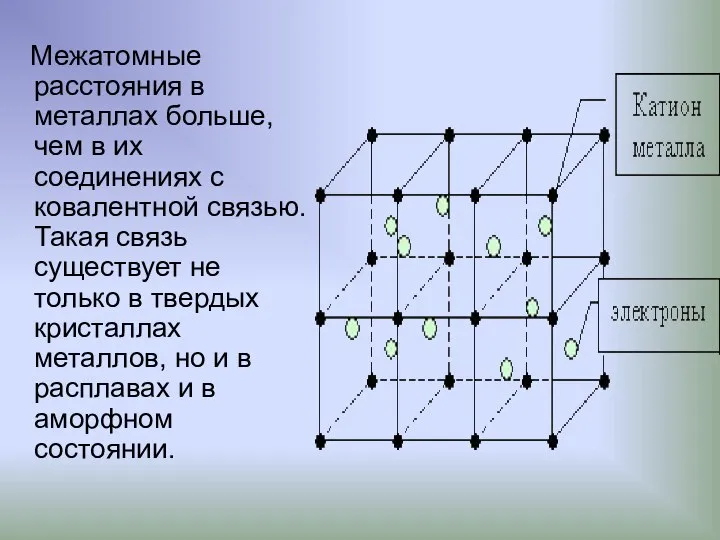
- 18. Межатомные расстояния в металлах больше, чем в их соединениях с ковалентной связью. Такая связь существует не
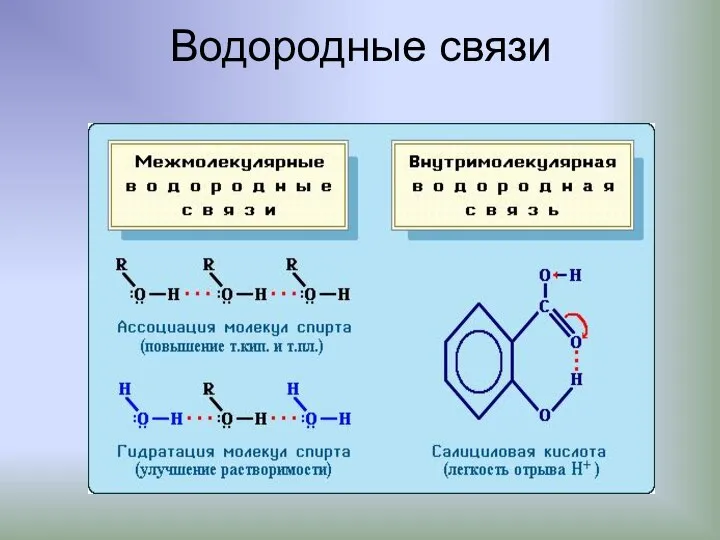
- 20. Водородные связи
- 21. Водородные связи (Н-связи) Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), испытывает
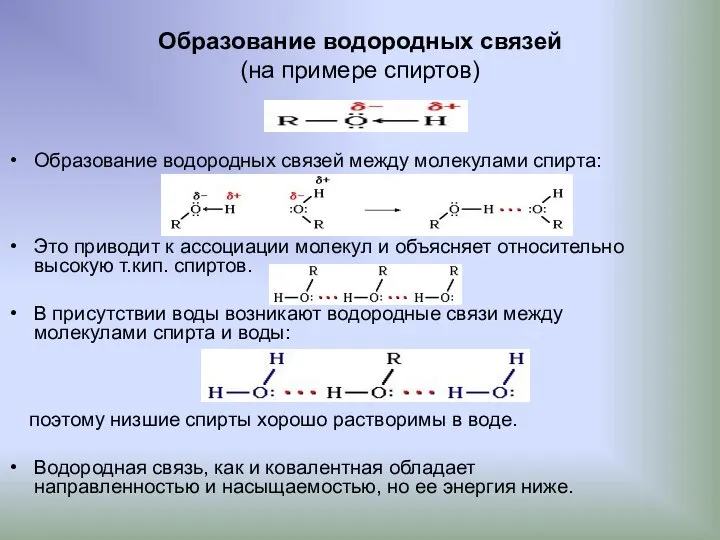
- 22. Образование водородных связей (на примере спиртов) Образование водородных связей между молекулами спирта: Это приводит к ассоциации
- 24. Скачать презентацию









 Зелёная химия
Зелёная химия Электролитическая диссоциация
Электролитическая диссоциация Биохимия. Введение
Биохимия. Введение «Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г
«Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г Презентация по Химии "Прославившиеся ученые Саратовской области" - скачать смотреть
Презентация по Химии "Прославившиеся ученые Саратовской области" - скачать смотреть  Углеводы. Строение и функции
Углеводы. Строение и функции Кинетика ферментативного катализа. (Лекция 5)
Кинетика ферментативного катализа. (Лекция 5) Разноцветные кристаллы
Разноцветные кристаллы Периодическая Система Д. И. Менделеева в свете учения о строении атома
Периодическая Система Д. И. Менделеева в свете учения о строении атома Ферменты. Свойства ферментов
Ферменты. Свойства ферментов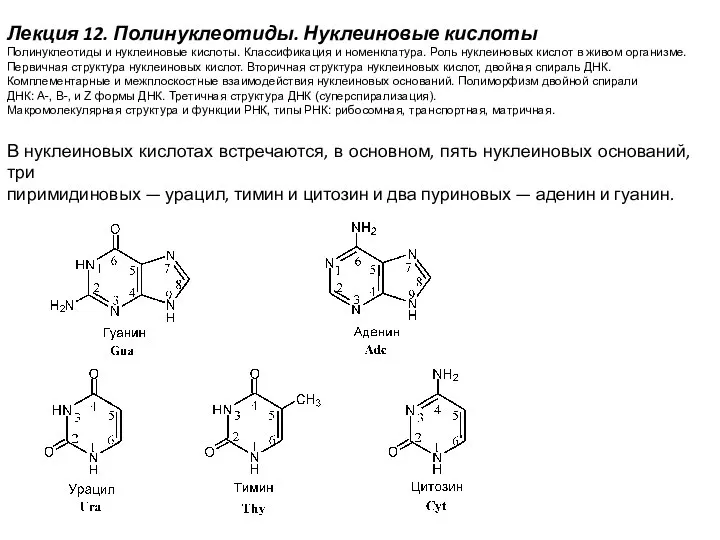 Полинуклеотиды. Нуклеиновые кислоты
Полинуклеотиды. Нуклеиновые кислоты Методи визначення питомої поверхні
Методи визначення питомої поверхні Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде
Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Химия функциональных материалов. Адсорбционные материалы. Цеолиты
Химия функциональных материалов. Адсорбционные материалы. Цеолиты Бор (Borum)
Бор (Borum) Биополимеры. Классификация полисахаридов (гликаны)
Биополимеры. Классификация полисахаридов (гликаны) Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Воздух - источник жизни на земле. (3 класс)
Воздух - источник жизни на земле. (3 класс) Металлы в природе. Общие способы их получения.
Металлы в природе. Общие способы их получения. Задача о смесях
Задача о смесях МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА.
МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА. Индивидуальные задания для самостоятельной работы студентов нехимических специальностей
Индивидуальные задания для самостоятельной работы студентов нехимических специальностей Процессы технологии природных энергоносителей и углеродных материалов
Процессы технологии природных энергоносителей и углеродных материалов Технология поликристаллического кремния. Его применение
Технология поликристаллического кремния. Его применение Липидтер, жіктелуі (қарапайым және күрделі липидтер), қызметі, май қышқылдары
Липидтер, жіктелуі (қарапайым және күрделі липидтер), қызметі, май қышқылдары Презентация по Химии "Металлы. Типы сплавов" - скачать смотреть
Презентация по Химии "Металлы. Типы сплавов" - скачать смотреть  Скорость химических реакций Разработка урока по химии 11 класс
Скорость химических реакций Разработка урока по химии 11 класс