Содержание
- 2. Химическая термодинамика рассматривает энергетические аспекты различных процессов и определяет условия их самопроизвольного протекания.
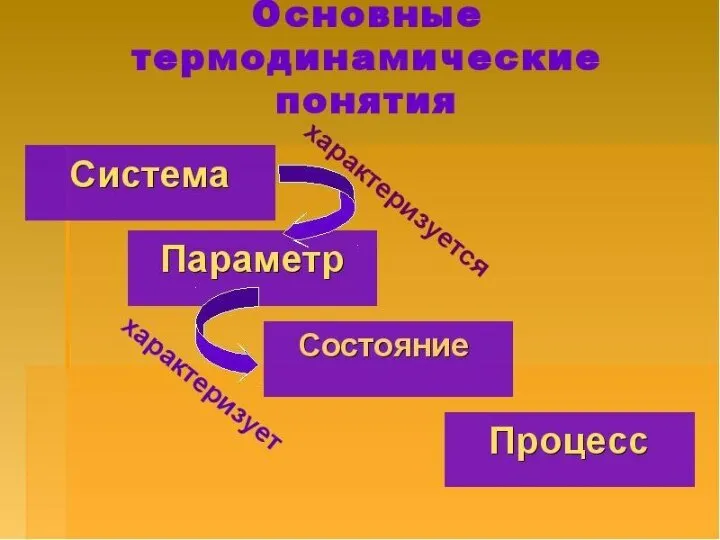
- 4. – это все, что находится в прямом или косвенном контакте с системой. Окружающая среда Система –
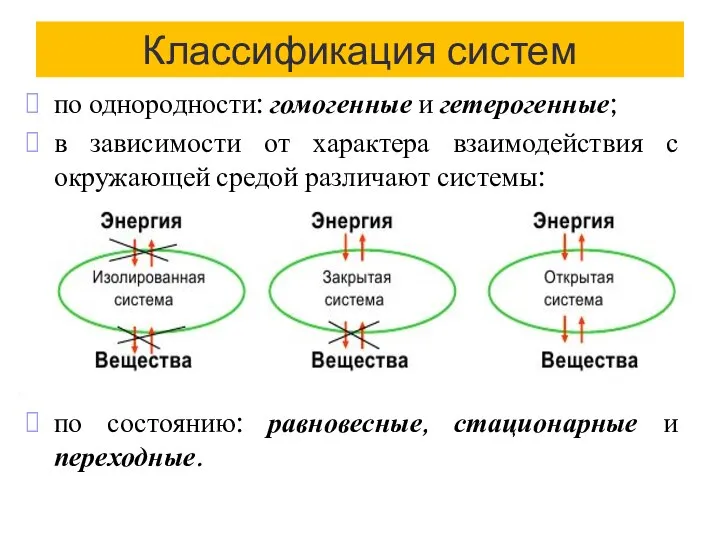
- 5. Классификация систем по однородности: гомогенные и гетерогенные; в зависимости от характера взаимодействия с окружающей средой различают
- 6. Т/д равновесное состояние - const всех свойств во времени и отсутствие потока вещества и энергии в
- 7. Совокупность всех физических и химических свойств системы называют состоянием системы. Его характеризуют термодинамическими параметрами, которые бывают:
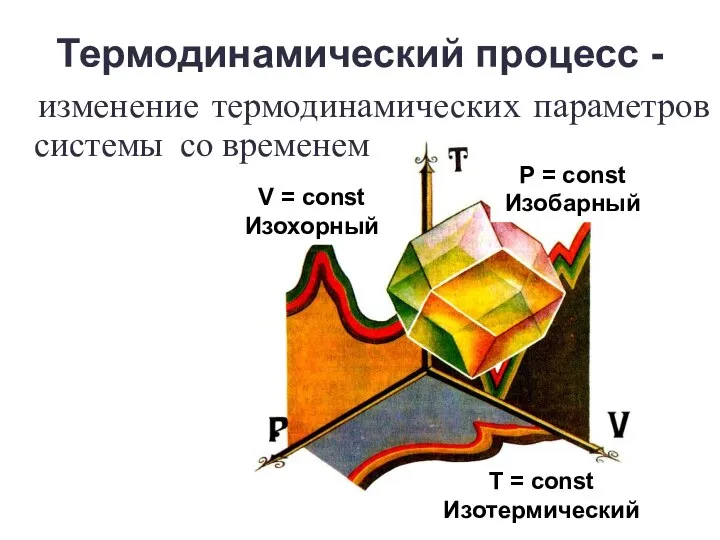
- 8. Термодинамический процесс - изменение термодинамических параметров системы со временем
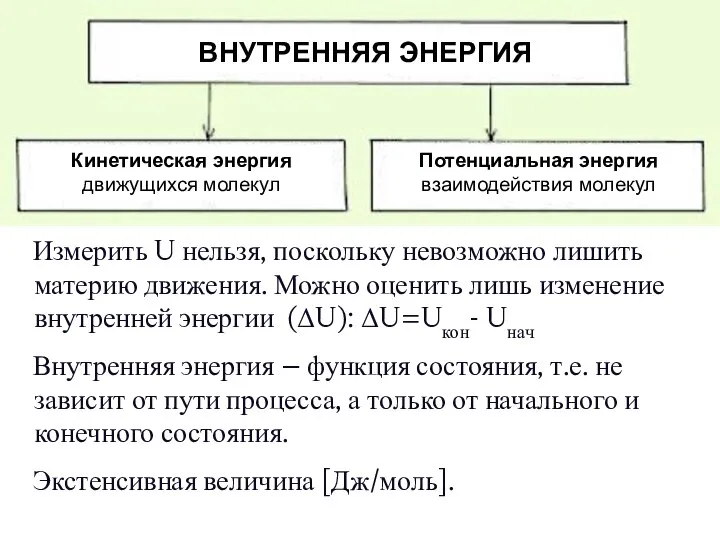
- 9. Измерить U нельзя, поскольку невозможно лишить материю движения. Можно оценить лишь изменение внутренней энергии (ΔU): ΔU=Uкон-
- 10. Теплота и работа Теплота (Q) - хаотический вид передачи энергии Работа (W) – направленный вид передачи
- 11. Первое начало термодинамики
- 12. Формулировки 2.Энергия изолированной системы постоянна. 3. Вечный двигатель I рода невозможен, т.е. машина, производящая работу без
- 13. Математический вид: Q=ΔU + W= ΔU + pΔV Количество теплоты, подведенное к системе, идет на изменение
- 14. Первый закон термодинамики в применении к некоторым процессам Изотермические процессы (Т = const): U = const,
- 15. Закон Гесса Тепловой эффект реакции не зависит от пути процесса ,а зависит только начальным и конечным
- 16. Следствия из закона Гесса 1. ΔНр-ии =∑νΔH0обр(прод) - ∑νΔH0обр(исх) Стандартной энтальпией образования (ΔH0обр ) - тепловой
- 17. 2. ΔНр-ии= ∑νΔ H0сгор(исх) - ∑νΔH0сгор (прод) Стандартная энтальпия сгорания (ΔH0сгор ) - тепловой эффект (изменение
- 18. Второе начало термодинамики
- 19. I закон термодинамики дает данные лишь о тепловыделении и говорит о превращении одной формы энергии в
- 20. Формулировки второго закона термодинамики Теплота не может самопроизвольно переходить от более холодного тела к более горячему
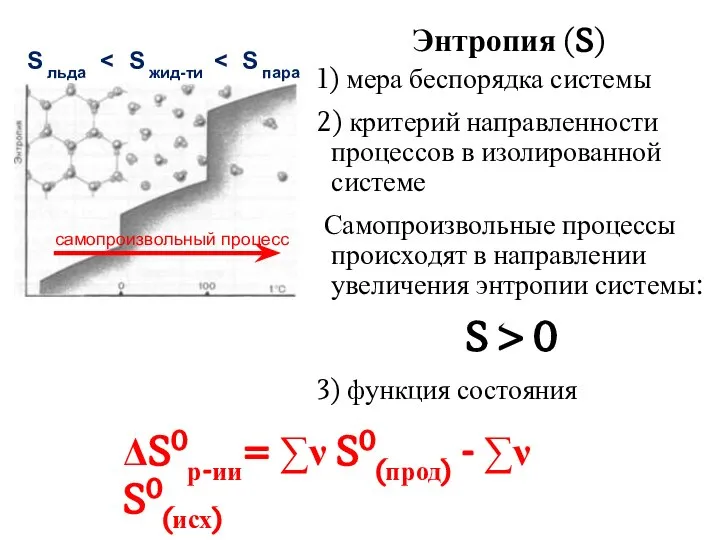
- 21. Энтропия (S) 1) мера беспорядка системы 2) критерий направленности процессов в изолированной системе Самопроизвольные процессы происходят
- 22. Термодинамические потенциалы критерии направленности процессов в открытой и закрытой системах: энергия Гиббса энергия Гельмгольца Расчет энергии
- 23. Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называются экзергоническими реакциями. Биохимические реакции, сопровождающиеся увеличением энергии Гиббса, называются
- 25. Скачать презентацию

















 Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Алюминий
Алюминий  Нефть. Состав и свойства
Нефть. Состав и свойства Презентация по Химии "Мило. Синтетичні миючі засоби." - скачать смотреть бесплатно
Презентация по Химии "Мило. Синтетичні миючі засоби." - скачать смотреть бесплатно Вода. Уникальная и неповторимая
Вода. Уникальная и неповторимая Разбор сложных заданий ЕГЭ по химии
Разбор сложных заданий ЕГЭ по химии Элемент иттербий
Элемент иттербий Биологические мембраны. Структурная организация
Биологические мембраны. Структурная организация Коллигативные свойства растворов
Коллигативные свойства растворов Классификация кристаллов по силам связи
Классификация кристаллов по силам связи Геохимия щелочных пикробазальтов хребта Хэнтэй
Геохимия щелочных пикробазальтов хребта Хэнтэй Биотрансформация ядов
Биотрансформация ядов Метаморфические породы
Метаморфические породы Элементы титан и хром
Элементы титан и хром Пластмассы полимеризационного и поликонденсационного получения. Группа № Анисимов Роман Соловьева Алеся Столбов Никита У
Пластмассы полимеризационного и поликонденсационного получения. Группа № Анисимов Роман Соловьева Алеся Столбов Никита У Йод. Йодтың ашылуы
Йод. Йодтың ашылуы ВПР Окружающий мир 4 класс
ВПР Окружающий мир 4 класс  Химический дискуссионный клуб. Викторина
Химический дискуссионный клуб. Викторина Иерархия основных классов технологических процессов. Выражение составов фаз
Иерархия основных классов технологических процессов. Выражение составов фаз Анаэробный обмен углеводов (Лекция №8)
Анаэробный обмен углеводов (Лекция №8) Альдегиды
Альдегиды Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Химия нефти и газа
Химия нефти и газа Формы кристаллов и агрегаты
Формы кристаллов и агрегаты Степень окисления
Степень окисления Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения
Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения Полярография және оның фармацияда қолданылуы
Полярография және оның фармацияда қолданылуы Оцтовокисле бродіння
Оцтовокисле бродіння