Содержание
- 2. Подумай и ответь H2O HCl AlH3 Почему водород занимает разное положение? От чего зависит количество атомов
- 3. Степень окисления. Правила определения степеней окисления элементов
- 4. Степень окисления (СО) – это условный заряд, возникающий на атоме в результате сдвига электронов от менее
- 5. Правила определения СО Элемент в простом веществе имеет нулевую степень окисления, например H20, К0 ; Все
- 6. Кислород имеет степень окисления (-2) Н2О-2 . Исключения: 1)соединения кислорода со фтором O+2F2-1: (+2); 2)в пероксидах
- 7. Остальные атомы химических элементов имеют переменные СО, например: Fe+2O-2 и Fe +32O3-2
- 8. Бинарные соединения Бинарные соединения – это соединения, в состав которых входят атомы двух х.э. (би –
- 9. Посчитаем вместе: Расставьте степени окисления элементов в каждом веществе. CaO H2S SO2 Cu2O NaCl H2SO4
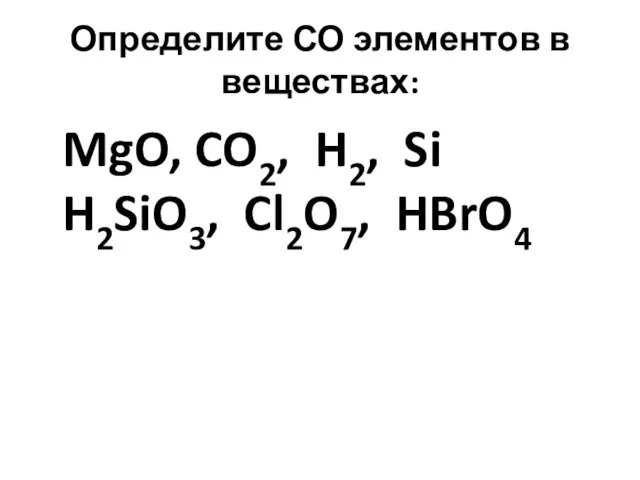
- 14. Определите СО элементов в веществах: MgO, CO2, H2, Si H2SiO3, Cl2O7, HBrO4
- 16. Скачать презентацию








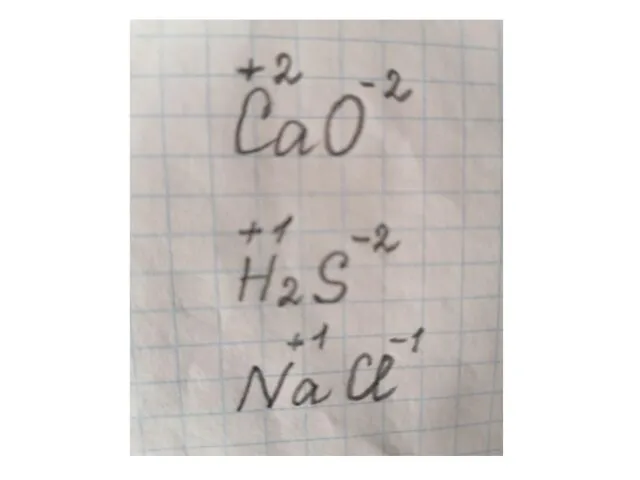
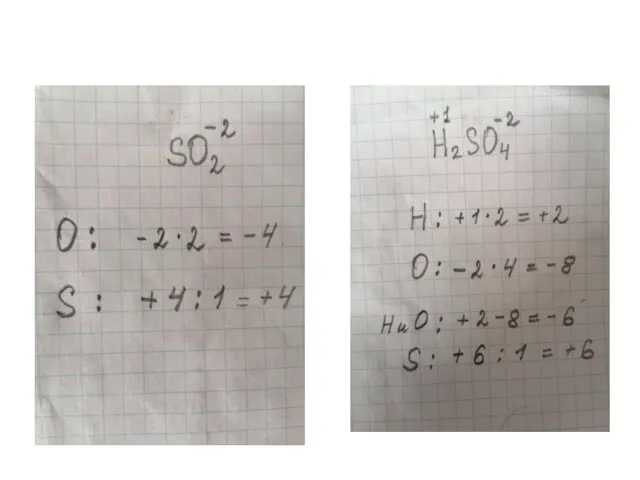
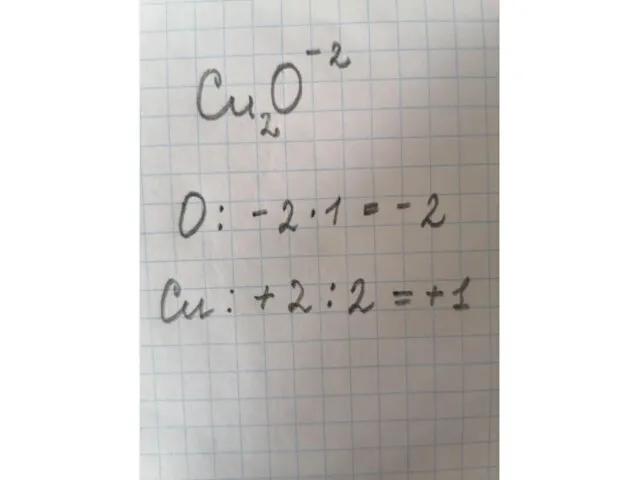

 Коррозия материалов
Коррозия материалов Каучук Органическая химия 10 класс. Школьная коллекция
Каучук Органическая химия 10 класс. Школьная коллекция Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Динамическая биохимия. Биологическое окисление. (Лекция 8)
Динамическая биохимия. Биологическое окисление. (Лекция 8) Неметаллические материалы
Неметаллические материалы Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Презентация по Химии "Химия. Щелочные металлы" - скачать смотреть
Презентация по Химии "Химия. Щелочные металлы" - скачать смотреть  Управління якістю лікарських засобів у фармацевтичній галузі
Управління якістю лікарських засобів у фармацевтичній галузі d-элементы
d-элементы Презентация по химии Руды металлов
Презентация по химии Руды металлов  Вариации химического состава почек берез дендрария Санкт-Петербургской лесотехнической академии
Вариации химического состава почек берез дендрария Санкт-Петербургской лесотехнической академии "We know it only takes one critically short telomere to make a cell die, so it's clear that the more really short telomeres a person has the faster problems will develop.“ Carol Greider Образ жизни и длина теломер
"We know it only takes one critically short telomere to make a cell die, so it's clear that the more really short telomeres a person has the faster problems will develop.“ Carol Greider Образ жизни и длина теломер Приготовили Прожеева Н, Казаченко Л.
Приготовили Прожеева Н, Казаченко Л. Липиды. Общая характеристика липидов
Липиды. Общая характеристика липидов Етиловий спирт та його вплив на організм людини
Етиловий спирт та його вплив на організм людини Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Хлор. Отравления хлором
Хлор. Отравления хлором Бензол и его свойства
Бензол и его свойства Уравнение состояния идеального газа
Уравнение состояния идеального газа Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов
Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов Презентація на тему: Каучук. Історія його відкриття
Презентація на тему: Каучук. Історія його відкриття  Гума
Гума  Моносахариды. Изомерия моносахаридов
Моносахариды. Изомерия моносахаридов Простые вещества, металлы
Простые вещества, металлы МОУ «Каратунская СОШ с углубленным изучением отдельных предметов» Выполнила : учитель химии второй квалификационной категор
МОУ «Каратунская СОШ с углубленным изучением отдельных предметов» Выполнила : учитель химии второй квалификационной категор Использование химии в медицине
Использование химии в медицине Бальзам-ополаскиватель для волос
Бальзам-ополаскиватель для волос Атом. Будова атома
Атом. Будова атома