Содержание
- 2. Экзотермические реакции К экзотермическим реакциям относят: Реакции горения, сопровождающиеся выделением света и тепла: 2Mg + O2
- 3. Эндотермические реакции К эндотермическим реакциям относят: Реакции разложения, которые практически всегда протекают с поглощением тепла: CaCO3
- 4. Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. Что такое скорость
- 5. Факторы,влияющие на скорость химической реакции
- 6. «Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении
- 7. Правило Я.Х. Вант-Гоффа «Повышение температуры на каждые 10 ∙С приводит к увеличению скорости реакции в 2-4
- 8. Этот фактор характерен только для гетерогенных реакций. Чем больше площадь соприкосновения реагирующих веществ, тем быстрее протекает
- 9. Катализатор-это вещество, которое ускоряет химическую реакцию, но само при этом не расходуется. 2H2O2 = 2H2O +
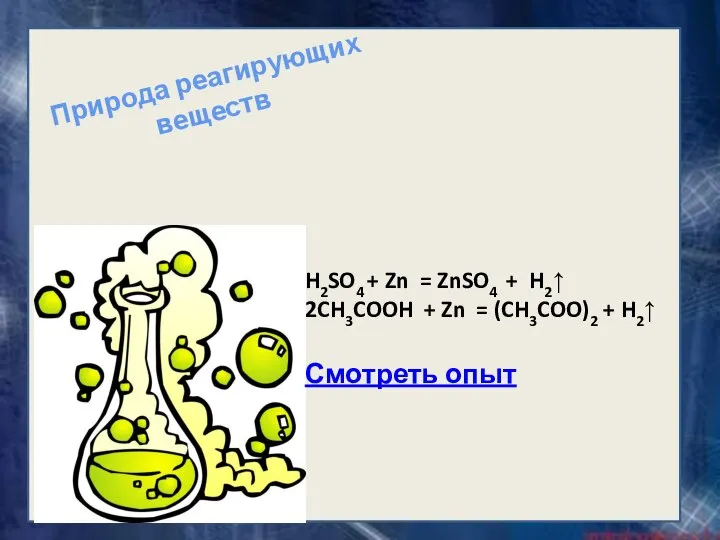
- 10. H2SO4 + Zn = ZnSO4 + H2↑ 2CH3COOH + Zn = (CH3COO)2 + H2↑ Смотреть опыт
- 11. Химические реакции По направлению все химические реакции можно разделить на 2 группы: Необратимыми называют химические реакции,
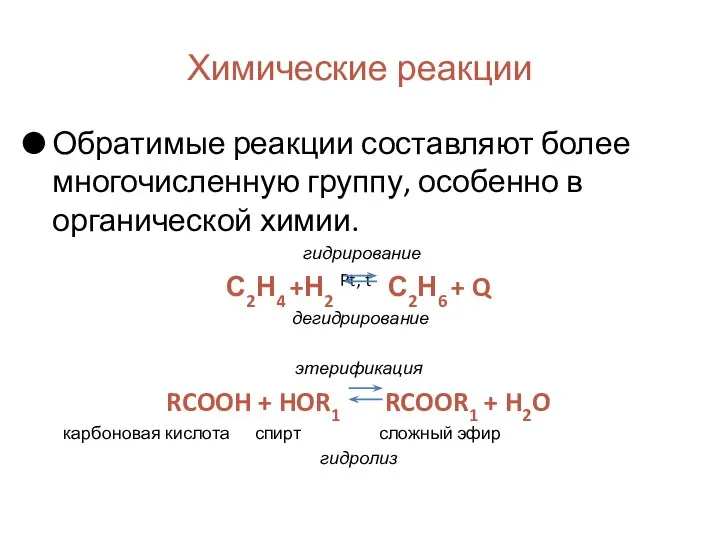
- 12. Химические реакции Обратимые реакции составляют более многочисленную группу, особенно в органической химии. гидрирование С2Н4 +Н2 Pt,
- 13. Химическое равновесие Концентрация реагирующих веществ с течением времени уменьшается, а концентрация продуктов реакции увеличивается. Поэтому скорость
- 14. Химическое равновесие В состоянии химического равновесия количественное соотношение между реагирующими веществами и продуктами реакции остается постоянным:
- 15. Смещение химического равновесия 1. Изменение температуры. Правило. При увеличении температуры равновесие сместится в сторону эндотермической реакции
- 16. Смещение химического равновесия 2. Изменение давление (оказывает влияние только на те системы. где хотя бы одно
- 17. Смещение химического равновесия 3. Изменение концентрации. Правило. При увеличении концентрации вещества равновесие смещается в сторону его
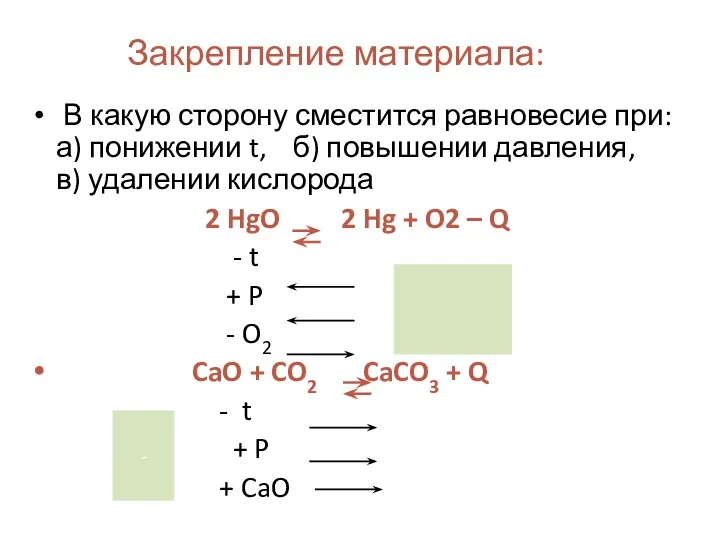
- 18. Закрепление материала: В какую сторону сместится равновесие при: а) понижении t, б) повышении давления, в) удалении
- 20. Скачать презентацию














 Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики Физический процесс и химическая реакция.
Физический процесс и химическая реакция. Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Классы неорганических веществ
Классы неорганических веществ Строение газообразных, жидких, твердых тел
Строение газообразных, жидких, твердых тел Тепловая обработка металлов. Особенности роста кристаллов при фазовых превращениях в твердом состоянии
Тепловая обработка металлов. Особенности роста кристаллов при фазовых превращениях в твердом состоянии Кристалічні тіла
Кристалічні тіла Углерод. Металлы
Углерод. Металлы «Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань  Этанол (этиловый спирт)
Этанол (этиловый спирт) Пиролиз. Паровой крекинг углеводородов
Пиролиз. Паровой крекинг углеводородов Кристаллография и основы кристаллохимии. Лекция 5
Кристаллография и основы кристаллохимии. Лекция 5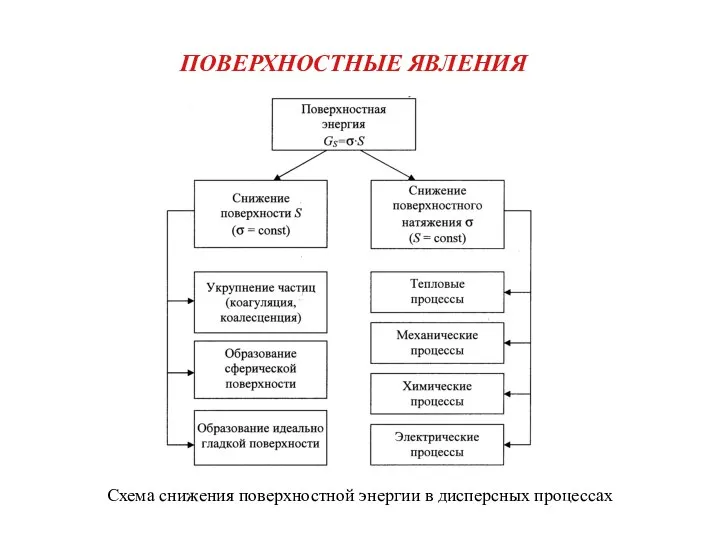 Поверхностные явления
Поверхностные явления Презентация по Химии "«Щелочные металлы»" - скачать смотреть
Презентация по Химии "«Щелочные металлы»" - скачать смотреть  Комплексные соединения
Комплексные соединения Биогенные p-элементы
Биогенные p-элементы Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть
Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть  Ферменты. Функции белков
Ферменты. Функции белков Химия биогенных элементов. Лекция 14
Химия биогенных элементов. Лекция 14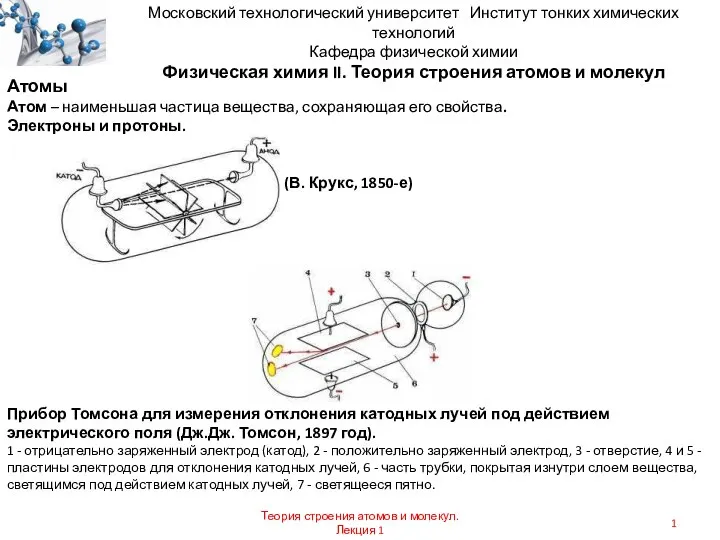 Теория строения атомов и молекул
Теория строения атомов и молекул Первоначальные химические понятия
Первоначальные химические понятия Белки. Строение аминокислот
Белки. Строение аминокислот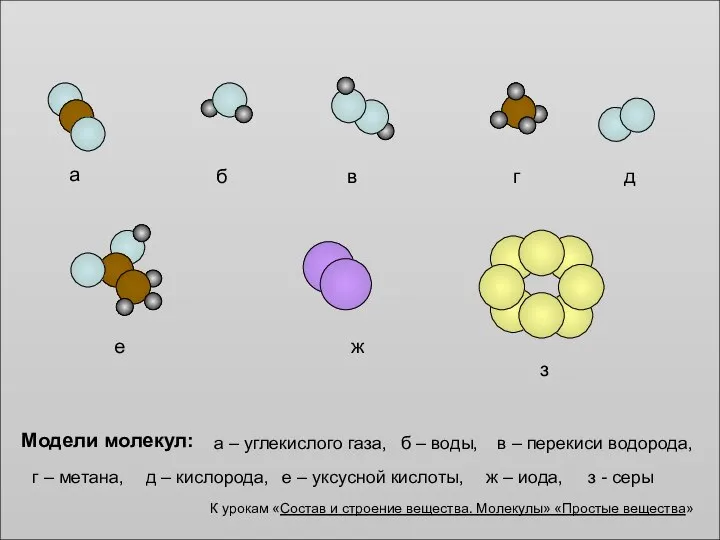 Состав и строение вещества. Молекулы
Состав и строение вещества. Молекулы Решение задач. Органическая химия
Решение задач. Органическая химия Обмен простых белков. Пути обмена аминокислот. (Тема 5)
Обмен простых белков. Пути обмена аминокислот. (Тема 5)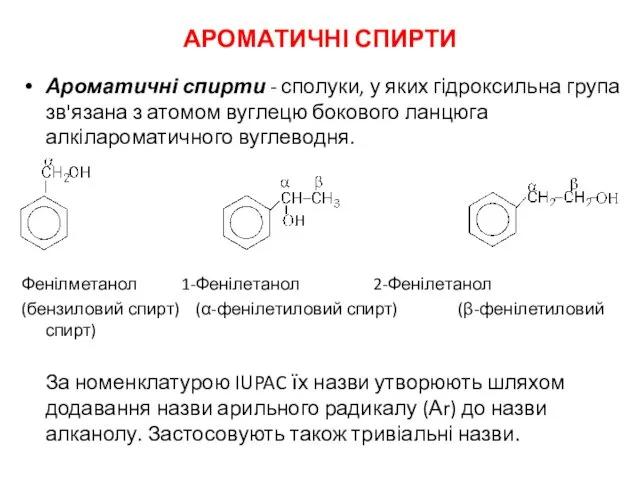 Ароматичні спирти
Ароматичні спирти Етанол (етиловий спирт, винний спирт)
Етанол (етиловий спирт, винний спирт) Индикаторы окислительно-восстановительного титрования. Их применение в анализе
Индикаторы окислительно-восстановительного титрования. Их применение в анализе