Содержание
- 2. Основные понятия и законы химии Окружающий нас мир Материя Энергия Поле Вещество Вещество – устойчивая совокупность
- 3. Из различных веществ построены окружающие нас тела. Тело – это все то, что имеет массу и
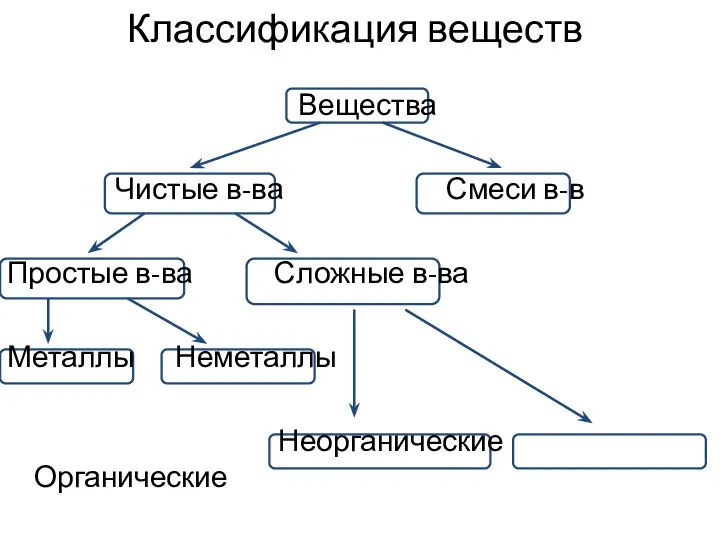
- 4. Классификация веществ Вещества Чистые в-ва Смеси в-в Простые в-ва Сложные в-ва Металлы Неметаллы Неорганические Органические
- 5. Чистое вещество (простое или сложное) состоит из одинаковых частиц – формульных единиц. Формульная единица – атом,
- 6. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Ион – электрозаряженная частица, образующаяся вследствие потери
- 7. Явления Физические явления Изменение формы или агрегатного состояния веществ, в результате которых не образуются новые вещества
- 8. Отличие смеси от хим. соед. состав смеси переменный, а химических соед. – постоянный; вещества, входящие в
- 9. Стехиометрические законы химии Закон сохранения массы веществ. Масса веществ, вступающих в реакцию, равна массе веществ, образующихся
- 10. Основные величины и единицы Абсолютная масса атома хим. эл-та (ma) – масса атома элемента, выраженная в
- 11. Относительная молекулярная масса (Mr) – безразмерная величина, показывающая, во сколько раз масса формульной единицы больше 1
- 12. Кол-во в-ва (n или ν(ню)) – физ. вел-на, введенная для оценки числа структурных единиц (атомы, молекулы,
- 13. Молярный объем (Vm) – отношение объема в-ва к кол-ву в-ва: Vm = V / n При
- 14. Выход продукта реакции (η) – это отношение практически полученного кол-ва в-ва (массы, объема) продукта к количеству
- 15. Газовые законы Закон Бойля – Мариотта – для данной массы газа при Т – const произведение
- 16. Уравнение Клапейрона – Менделеева: pV = nRT Закон объемных отношений газов – объемы вступающих в реакцию
- 17. Следствия из закона Авогадро Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объем. Один
- 18. Решение задач
- 21. Скачать презентацию

















 Строение, получение и применение полимеров
Строение, получение и применение полимеров Презентация Нефть и способы ее переработки
Презентация Нефть и способы ее переработки Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные
Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные Аттестаионная работа. Сахар. Изучаем и исследуем
Аттестаионная работа. Сахар. Изучаем и исследуем Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Презентация по Химии "Химическое загрязнение среды промышленностью." - скачать смотреть бесплатно
Презентация по Химии "Химическое загрязнение среды промышленностью." - скачать смотреть бесплатно Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно
Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно Влияние шампуня на состояние волос человека
Влияние шампуня на состояние волос человека Презентация по Химии "Комплексные соединения" - скачать смотреть
Презентация по Химии "Комплексные соединения" - скачать смотреть  Аналитическая химия и химический анализ. (Лекция 1)
Аналитическая химия и химический анализ. (Лекция 1) Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Гетерогенные и лигандообменные равновесия и процессы
Гетерогенные и лигандообменные равновесия и процессы Детонаційна стійкість бензину
Детонаційна стійкість бензину Имидазол. Получение, свойства, анализ, применение, условия хранения лекарственных препаратов производных имидазола
Имидазол. Получение, свойства, анализ, применение, условия хранения лекарственных препаратов производных имидазола Энергетика химических процессов. Энтропия и энергия Гиббса
Энергетика химических процессов. Энтропия и энергия Гиббса Химитариум. Погрузись в мир занимательной химии
Химитариум. Погрузись в мир занимательной химии Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Поверхностные явлении и дисперсные системы (коллоидная химия)
Поверхностные явлении и дисперсные системы (коллоидная химия) Производство топлив и масел
Производство топлив и масел Полимеры, пластмассы и товары на их основе
Полимеры, пластмассы и товары на их основе Альдегиды и кетоны
Альдегиды и кетоны Физико-химическая и механическая миграция
Физико-химическая и механическая миграция Свойства снега и льда (окружающий мир, 3 класс)
Свойства снега и льда (окружающий мир, 3 класс) Роль воды в жизни и хозяйстве
Роль воды в жизни и хозяйстве Магнитті қатты материалдар және оны техникада қолдану әдістері
Магнитті қатты материалдар және оны техникада қолдану әдістері Презентация Угольная кислота
Презентация Угольная кислота Кальцій і Магній
Кальцій і Магній  Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна
Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна