Содержание
- 2. Дисперсные системы Системы, в которых одно или несколько веществ в виде мелких частиц распределены в другом
- 3. Классификация дисперсных систем По размеру дисперсной фазы: 1. Истинные растворы. Размер частиц меньше 10-9 м (ионная
- 4. Классификация дисперсных систем
- 5. Растворы Раствор – многокомпонентная, однофазная, равновесная система переменного состава. Компонентами раствора являются растворитель (среда) и растворенное
- 6. Типы растворов Растворы делятся по концентрации на: Неконцентрированные (менее 1 моль/л) Концентрированные (1 моль/л и более)
- 7. Способы выражения концентрации раствора Массовая доля Молярная доля Объемная доля Молярная концентрация Молярная концентрация эквивалента (нормальность)
- 8. Массовая доля. Молярная доля. Объемная доля. Массовая доля (w)– отношение массы вещества к массе раствора: W
- 9. Молярная концентрация. Молярная концентрация эквивалента. Молярная концентрация (С) – показывает сколько моль вещества содержится в определенном
- 10. Моляльность. Титр. Моляльность (Cm) – показывает количество моль растворенного вещества в определенной массе растворителя(1кг): Cm =
- 11. Задание Рассчитать молярную долю, молярную концентрацию, молярную концентрацию эквивалента, моляльность и титр 20% по массе водного
- 12. Растворимость Способность одного вещества растворяться в другом при заданных условиях имеет количественное выражение, называемое растворимостью. Растворимость
- 13. Ненасыщенные растворы Если концентрация вещества в растворе при заданных условиях меньше его растворимости, то раствор является
- 14. Насыщенные растворы Насыщенным раствором называется такой раствор, который находится в динамическом равновесии с избытком растворяемого вещества:
- 15. Пересыщенные растворы Пересыщенным раствором называют раствор, концентрация которого больше растворимости. Получают такие растворы медленным и осторожным
- 16. Факторы, влияющие на растворимость. Природа веществ – подобное растворяется в подобном: Полярные вещества хорошо растворяются в
- 17. Физико-химическая природа процесса растворения. В процессе растворения происходит не только гомогенизация системы и разрушение связей в
- 18. Общие свойства растворов Вне зависимости от того, к какому типу принадлежит раствор, он всегда имеет так
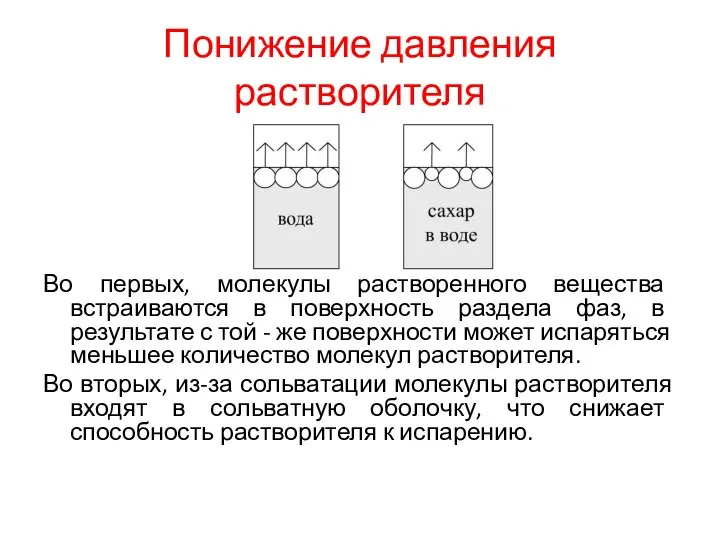
- 19. Понижение давления растворителя Во первых, молекулы растворенного вещества встраиваются в поверхность раздела фаз, в результате с
- 20. Первый закон Рауля Относительно понижение давления пара над растворителем равно молярной доли растворенного вещества. ΔP/P0 =
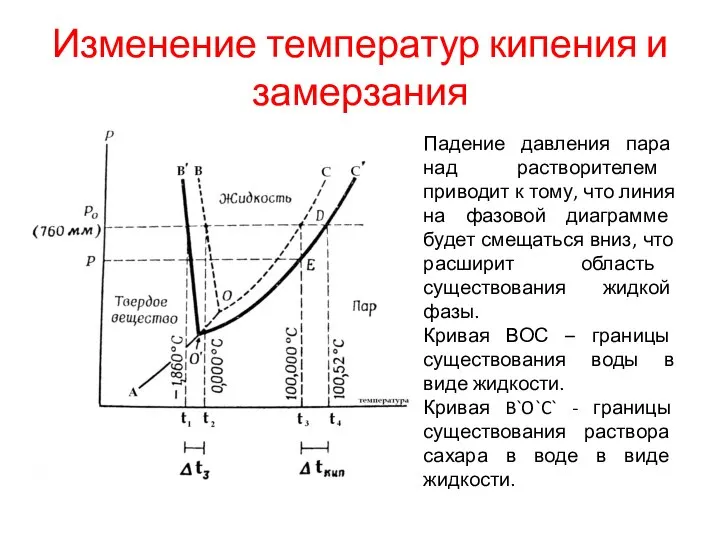
- 21. Изменение температур кипения и замерзания Падение давления пара над растворителем приводит к тому, что линия на
- 22. Второй закон Рауля Повышение температур кипения и кристаллизации растворов прямопропорционально моляльности растворов: ∆tкип = Кэб ·
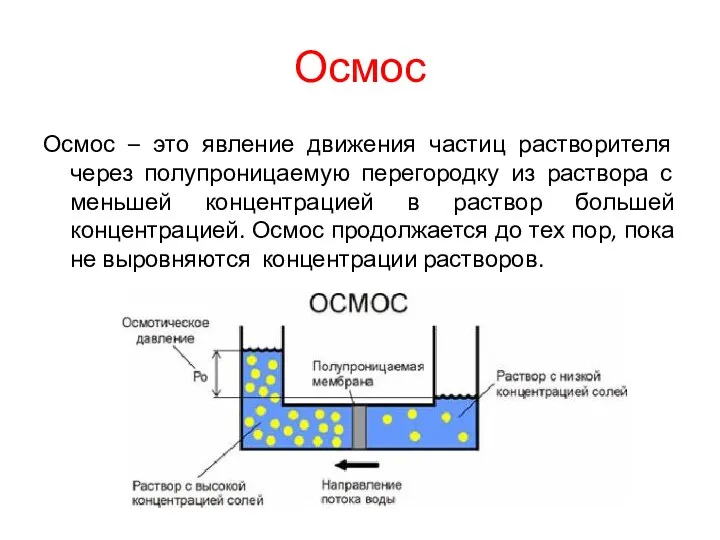
- 23. Осмос Осмос – это явление движения частиц растворителя через полупроницаемую перегородку из раствора с меньшей концентрацией
- 24. Осмотическое давление Осмотическое давление – это давление, которое необходимо приложить к системе, что бы осмос прекратился.
- 25. Осмос в биологии и технологиях Стенки клеток обладают свойствами полупроницаемых мембран, поэтому в любой ситуации, когда
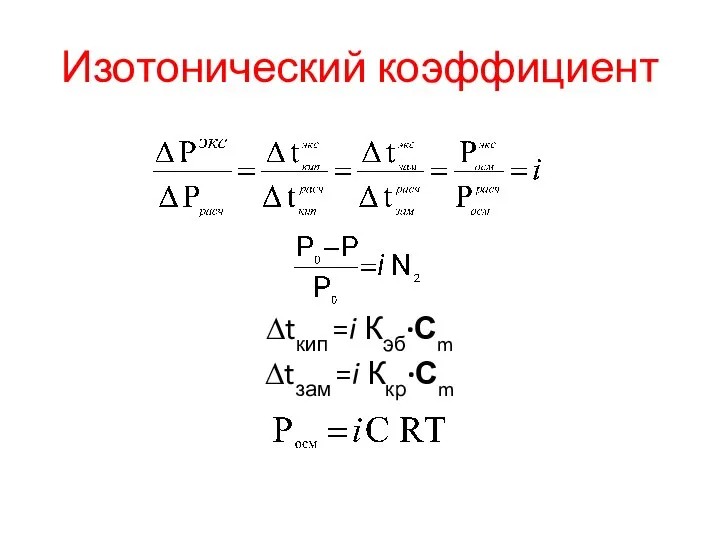
- 26. Изотонический коэффициент Коллигативные свойства определяются количеством растворенного вещества. В растворах электролитов (ионные растворы) из-за диссоциации вещества
- 27. Изотонический коэффициент ∆tкип =i Кэб·Сm ∆tзам =i Ккр·Сm .
- 28. Изотонический коэффициент Изотонический коэффициент показывает, во сколько раз частиц в растворе электролита больше, чем в растворе
- 30. Скачать презентацию























 Марганец, технеций, рений. VII группа, побочная подгруппа
Марганец, технеций, рений. VII группа, побочная подгруппа Классификация минералов. Описание физических свойств
Классификация минералов. Описание физических свойств Минералы земной коры
Минералы земной коры Биохимия эритроцитов, гемоглобина и лейкоцитов. Кровь. (Лекция 17)
Биохимия эритроцитов, гемоглобина и лейкоцитов. Кровь. (Лекция 17) Типы химических реакций. Класс «оксиды»
Типы химических реакций. Класс «оксиды» Дендример, или арборол
Дендример, или арборол Домашнее задание к занятию №3. 8 класс Химия
Домашнее задание к занятию №3. 8 класс Химия Кинетика химических реакций
Кинетика химических реакций Липиды. Классификация липидов
Липиды. Классификация липидов Галогены. Химические свойства
Галогены. Химические свойства Vitamins. Classification
Vitamins. Classification Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть
Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть  Строение гетероциклических соединений
Строение гетероциклических соединений Основы цитологии. Химический состав клетки.
Основы цитологии. Химический состав клетки. Пряности глазами химика
Пряности глазами химика Кислород. История открытия. Применение кислорода
Кислород. История открытия. Применение кислорода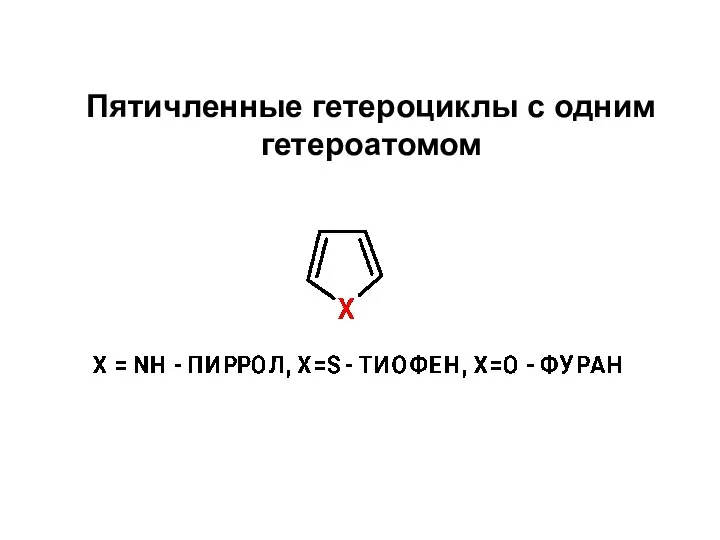 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Получение и свойства кислорода
Получение и свойства кислорода Задача №3: «Трансмутация». Команда: «Карбораны»
Задача №3: «Трансмутация». Команда: «Карбораны» ПОРТФОЛІО вчителя хімії та біології Турбівської загальноосвітньої школи І – ІІІ ступенів 2014 рік
ПОРТФОЛІО вчителя хімії та біології Турбівської загальноосвітньої школи І – ІІІ ступенів 2014 рік Презентация Природные синтетические красители и ароматизаторы
Презентация Природные синтетические красители и ароматизаторы Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Кремний
Кремний Альдегидтер және кетондар
Альдегидтер және кетондар Термический анализ
Термический анализ Амины. Азотсодержащие органические соединения
Амины. Азотсодержащие органические соединения Д.И. Менделеев и живопись - Презентация_
Д.И. Менделеев и живопись - Презентация_ Фильтрование. Лекция 5
Фильтрование. Лекция 5