Содержание
- 2. План лекции Эритроцит: особенности структуры, химического состава, метаболизма белков, жиров, углеводов. Гемоглобин и миоглобин: строение, функции,
- 3. Эритроциты форменные элементы крови образуются в костном мозге, циркулируют в крови около 100-120 дней, разрушаются макрофагами
- 5. ФУНКЦИИ ЭРИТРОЦИТОВ Газообмен: транспорт О2 и СО2 Регуляция КОС Адсорбция и транспорт на клеточной мембране различных
- 6. Строение эритроцита 60 % вода 40% сухой остаток 5 % - органические и неорганические вещества 95%
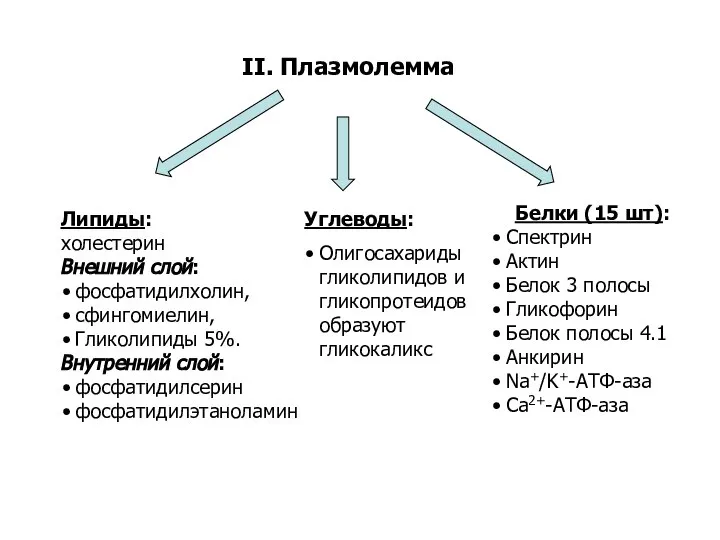
- 7. II. Плазмолемма Белки (15 шт): Спектрин Актин Белок 3 полосы Гликофорин Белок полосы 4.1 Анкирин Na+/K+-АТФ-аза
- 8. Часть белков плазмолеммы образуют цитоскелет фибриллярный белок спектрин образует сеть глобулярные белки, пронизывающие мембрану: гликофорин ,
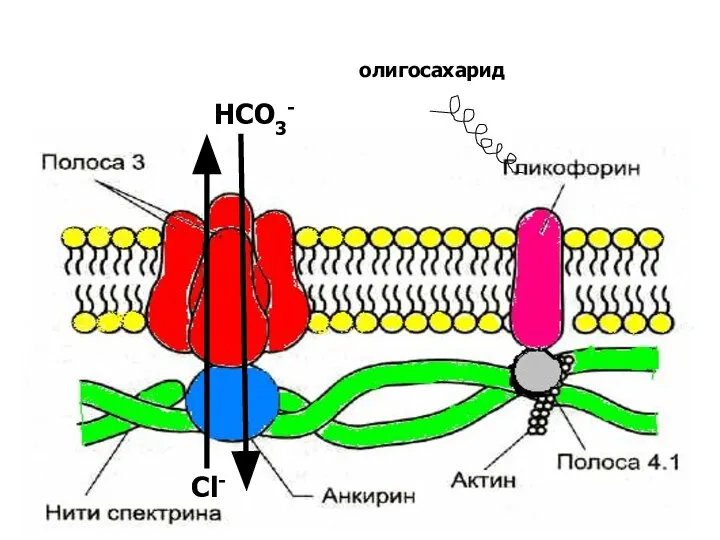
- 9. олигосахарид Cl- HCO3-
- 11. Спектрин основной белок цитоскелета эритроцитов ( 25% массы всех белков), имеет вид фибриллы 100нм, состоящей из
- 12. Гликофорин трансмембранный гликопротеин (30 кДа), пронизывает плазмолемму в виде спирали. С наружной поверхности эритроцита к нему
- 13. Углеводы олигосахариды гликолипидов и гликопротеидов, на внешней поверхности плазмолеммы образуют гликокаликс. Олигосахариды гликофорина являются агглютиногенами (А
- 14. ОСОБЕННОСТЬ ОБМЕНА ВЕЩЕСТВ И ЭНЕРГИИ В ЭРИТРОЦИТЕ Эритроцит высокоспециализированная клетка, хорошо приспособленная для транспорта газов. Для
- 15. Особенности обмена нуклеотидов рибозо-5ф + аденин → АМФ АМФ + АТФ → АДФ + АДФ АДФ
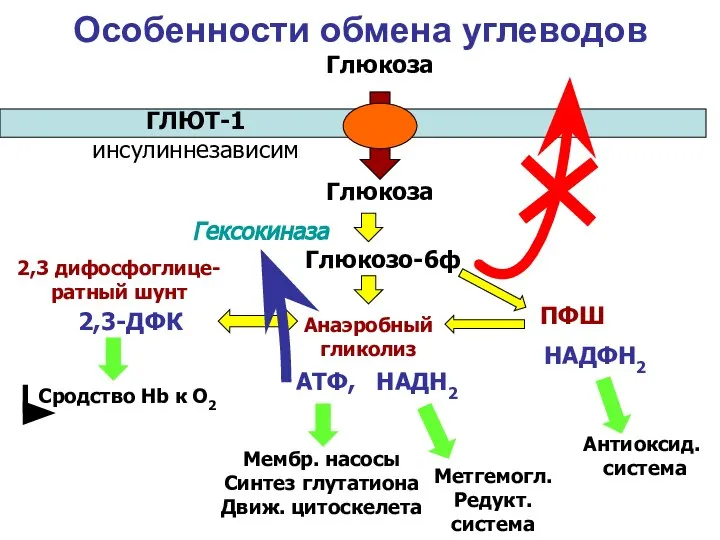
- 16. Особенности обмена углеводов Анаэробный гликолиз ПФШ 2,3 дифосфоглице- ратный шунт Глюкоза Глюкоза Глюкозо-6ф ГЛЮТ-1 инсулиннезависим Гексокиназа
- 17. (метод оценки ПРЭ)
- 18. Обмен метгемоглобина В течение суток до 3% гемоглобина может спонтанно окисляться в метгемоглобин: Ηb (Fe2+) →
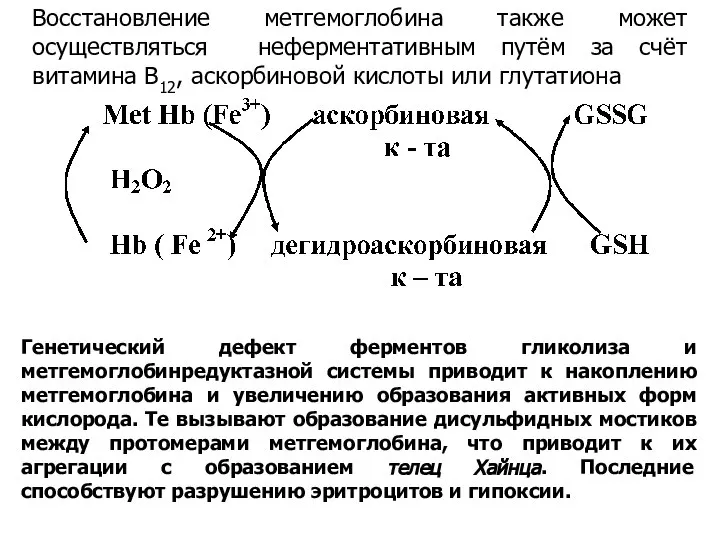
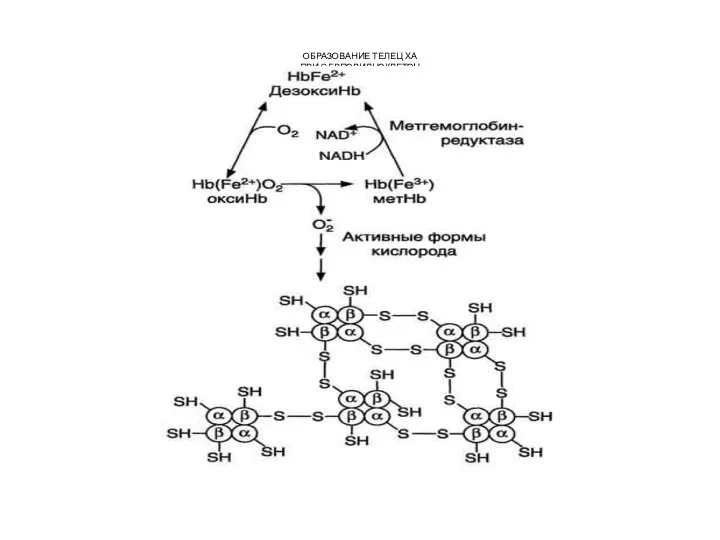
- 19. Восстановление метгемоглобина также может осуществляться неферментативным путём за счёт витамина В12, аскорбиновой кислоты или глутатиона Генетический
- 20. ОБРАЗОВАНИЕ ТЕЛЕЦ ХА ПРИ СЕРПОВИДНОКЛЕТОЧ НОЙ АНЕМИИ
- 21. Na+/K+-АТФ-аза - мембранный фермент поддерживает градиент концентраци Na+ и К+ Патология (сфероцитоз): ↓Na+/K+-АТФ-азы → ↑ Na+
- 23. Особенности липидного обмена В зрелом эритроците липиды не синтезируются, эритроцит может обмениваться липидами с липопротеинами крови.
- 24. В зрелом эритроците белки не синтезируются, т.к. у него нет рибосом, но в цитоплазме синтезируется глутатион
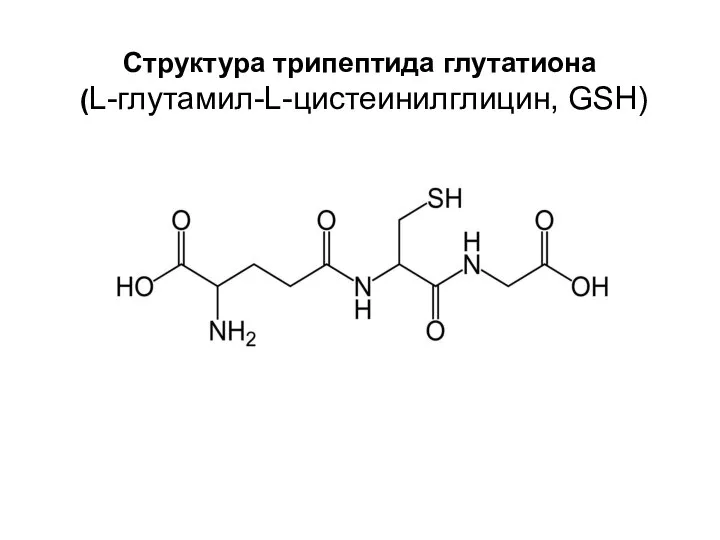
- 25. Структура трипептида глутатиона (L-глутамил-L-цистеинилглицин, GSH)
- 26. Биосинтез глутатиона Глутатион синтезируется из аминокислот L-цистеина, L-глутаминовой кислоты и глицина. Синтез происходит в две АТР-зависимые
- 27. Особенность метаболизма при старении эритроцитов ↓ образование АТФ Нарушаются энергозависимые процессы восстановления формы эритроцитов → сфероцитоз,
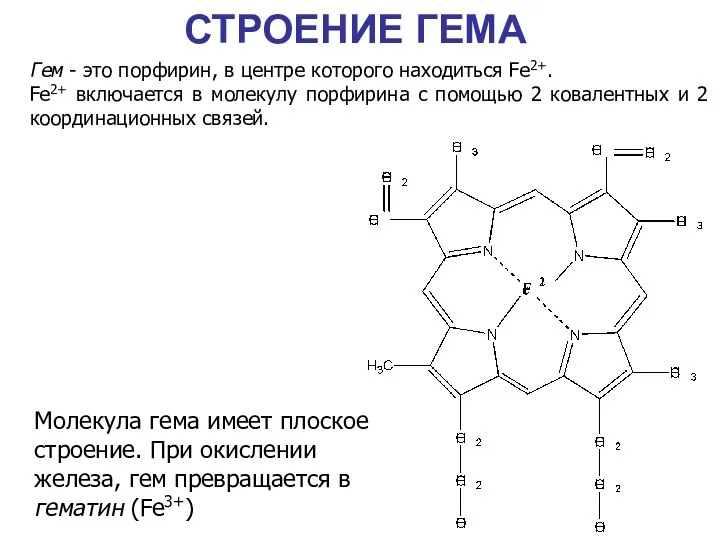
- 28. СТРОЕНИЕ ГЕМА Гем - это порфирин, в центре которого находиться Fe2+. Fe2+ включается в молекулу порфирина
- 29. Наибольшее количество гема содержат эритроциты (Hb), мышечные клетки (миоглобин) и клетки печени (цитохром Р450). Гемы разных
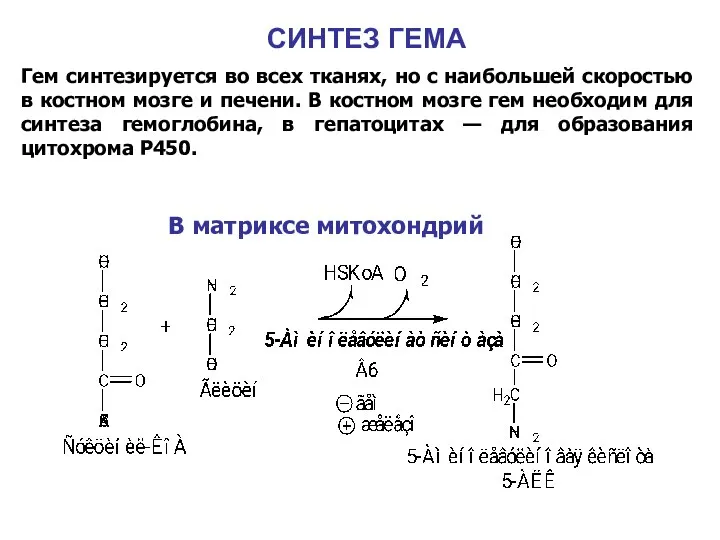
- 30. СИНТЕЗ ГЕМА Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени.
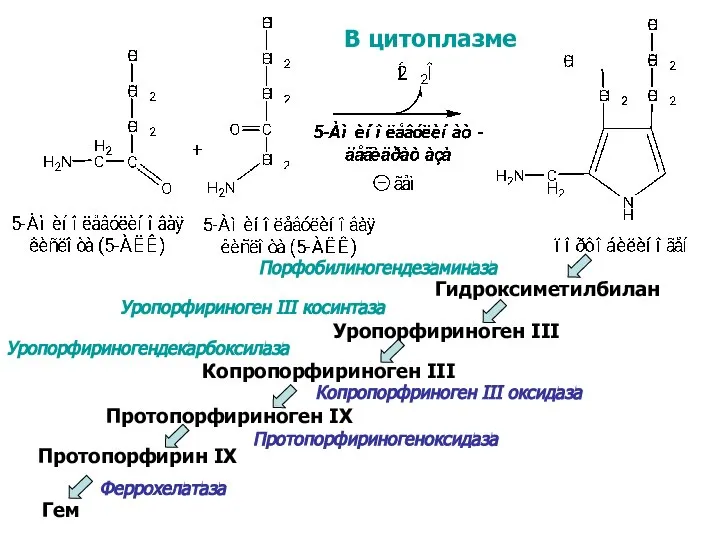
- 31. В цитоплазме Гидроксиметилбилан Уропорфириноген III Копропорфириноген III Протопорфириноген IX Протопорфирин IX Гем Порфобилиногендезаминаза Уропорфириноген III косинтаза
- 32. Порфирии - гетерогенная группа заболеваний, вызванная нарушениями синтеза гема вследствие дефицита одного или нескольких ферментов. НАРУШЕНИЯ
- 34. Негативные последствия порфирий связаны с дефицитом гема и накоплением в организме промежуточных продуктов синтеза гема –
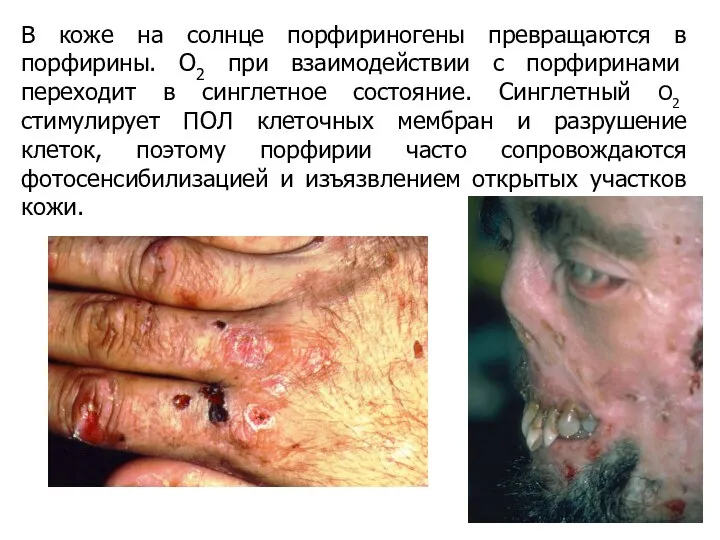
- 35. В коже на солнце порфириногены превращаются в порфирины. О2 при взаимодействии с порфиринами переходит в синглетное
- 36. Порфириногены бесцветны и не флуоресцируют, а порфирины имеют интенсивную красную флуоресценцию в ультрафиолетовых лучах. Избыток порфиринов
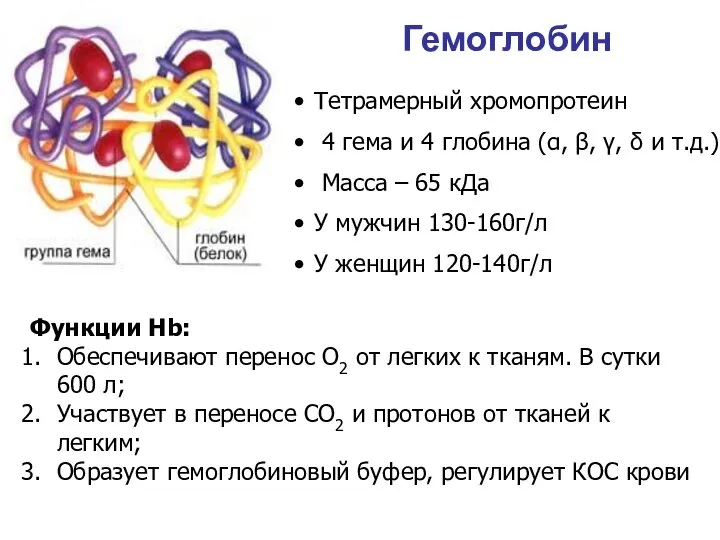
- 37. Гемоглобин Тетрамерный хромопротеин 4 гема и 4 глобина (α, β, γ, δ и т.д.) Масса –
- 38. Синтез гемоглобина Гем индуцируется синтез цепей глобина на рибосомах. Гены цепей глобина расположены в 11 и
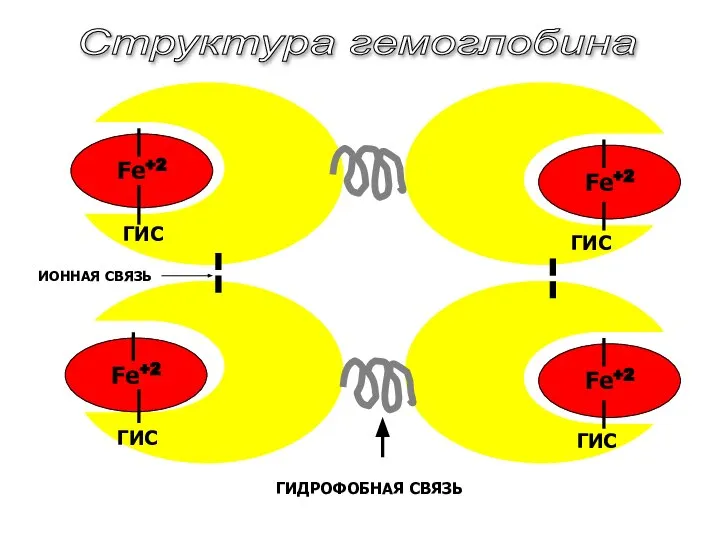
- 39. Fe+2 Fe+2 Fe+2 Fe+2 ГИДРОФОБНАЯ СВЯЗЬ ИОННАЯ СВЯЗЬ Структура гемоглобина ГИС ГИС ГИС ГИС
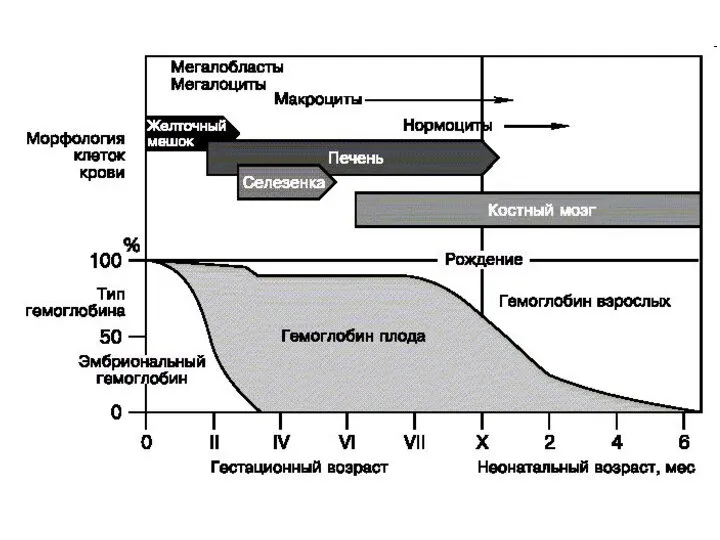
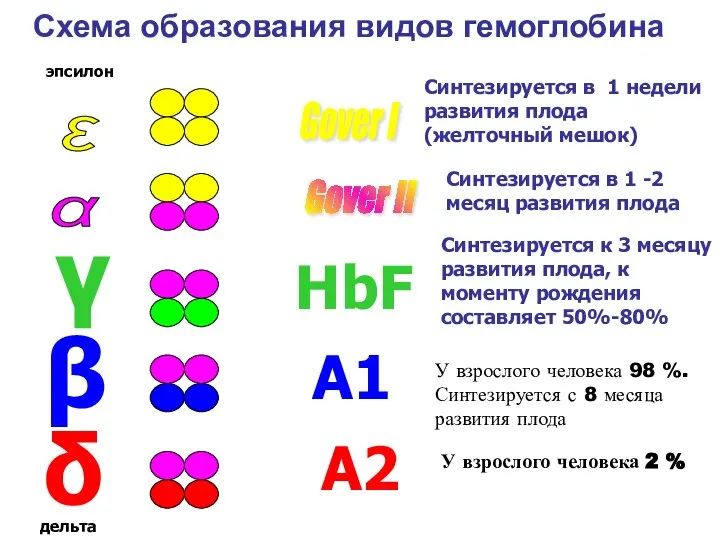
- 40. Виды гемоглобина Физиологические Эмбриональный: Gover I -4ε, Gover II -2α 2ε Фетальный - 2 α 2γ
- 41. ε α Gover I Gover II У взрослого человека 98 %. Синтезируется с 8 месяца развития
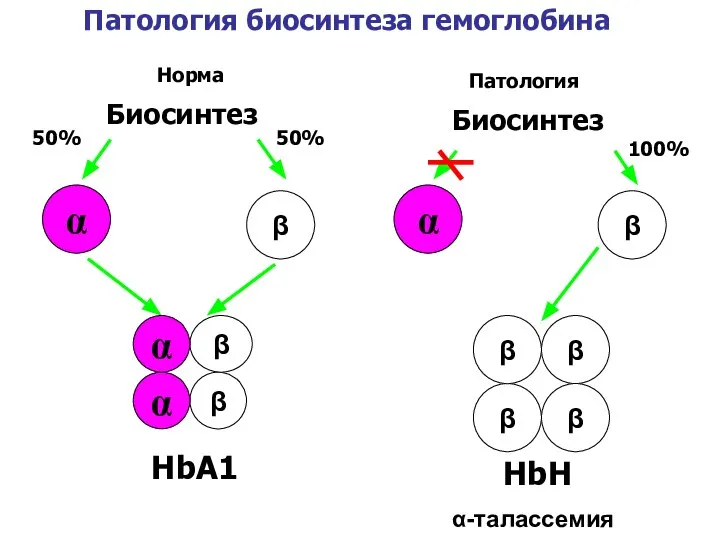
- 42. Талассемия Генетическое заболевание, обусловленное отсутствием или снижением синтеза одной из цепей гемоглобина. Причиной являются мутации генов-операторов,
- 43. HbА1 Биосинтез α β 50% 50% α-талассемия Биосинтез α β 100% β β β β β
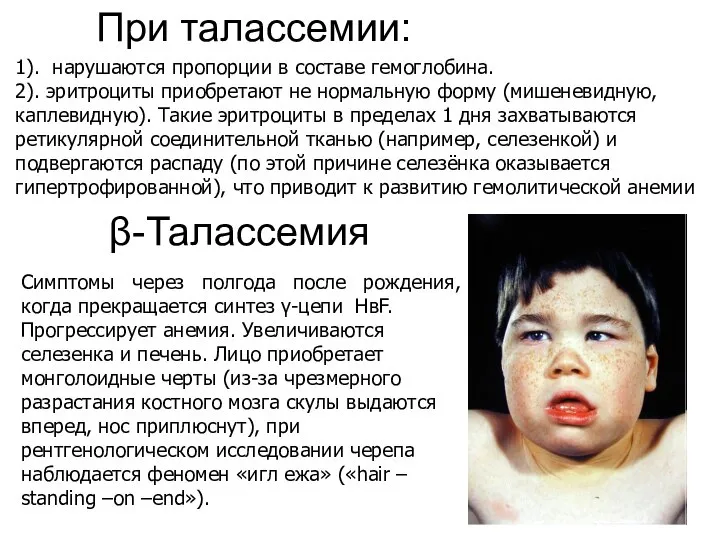
- 44. β-Талассемия Симптомы через полгода после рождения, когда прекращается синтез γ-цепи НвF. Прогрессирует анемия. Увеличиваются селезенка и
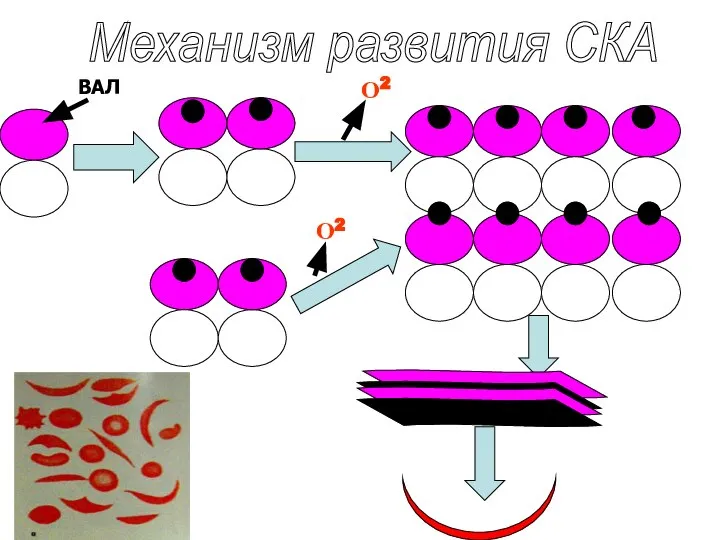
- 45. Серповидноклеточная анемия β-субъединицах НвS в шестом положении вместо ГЛУ находиться ВАЛ. Гидрофобные участок НвS, соединяются с
- 46. Механизм развития СКА О2 ВАЛ О2
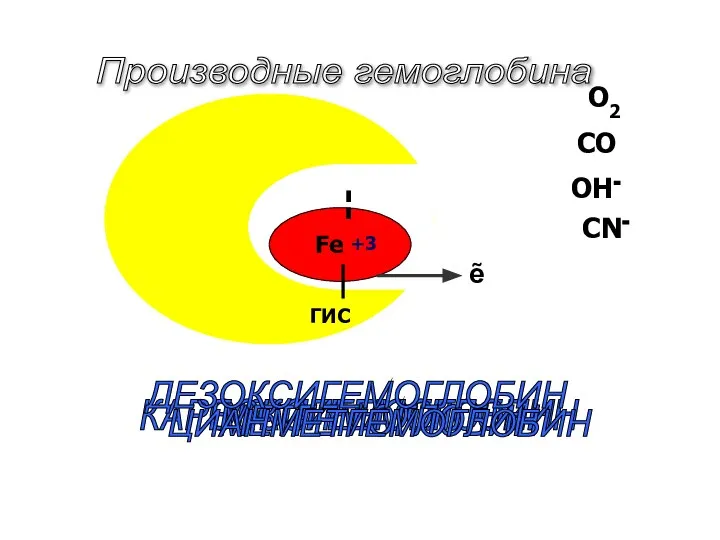
- 47. Fe+2 ГИС О2 CO CN- OH- ОКСИГЕМОГЛОБИН КАРБОКСИГЕМОГЛОБИН МЕТГЕМОГЛОБИН ЦИАНМЕТГЕМОГЛОБИН Производные гемоглобина +3 ẽ ДЕЗОКСИГЕМОГЛОБИН
- 48. оксигемоглобин HbО2 (Fe2+) - соединение молекулярного кислорода с гемоглобином. Процесс называется оксигенацией, обратный процесс - дезоксигенацией
- 49. Производные гемоглобина: Карбоксигемоглобин HbСО (Fe2+) Связь гема с СО в двести раз прочнее, чем с О2.
- 50. метгемоглобин МtHb (Fe3+) Образуется при воздействии на гемоглобин окислителей (оксидов азота, хлоратов). В норме в крови
- 51. Цианметгемоглобин HbСN (Fe3+) образуется при присоединении СN- к метгемоглобину. Эта реакция спасает организм от смертельного действия
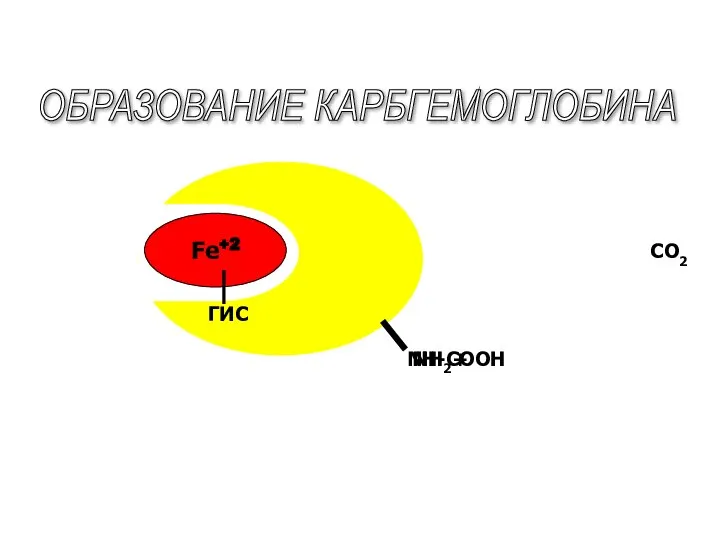
- 52. Fe+2 NH2 CO2 ОБРАЗОВАНИЕ КАРБГЕМОГЛОБИНА + ГИС NH-СООН
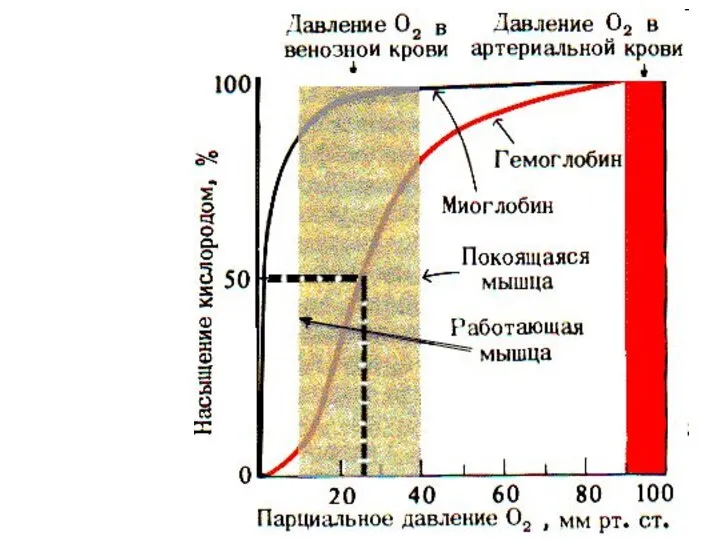
- 54. Аллостерическая регуляция насыщения гемоглобина кислородом На насыщение гемоглобина О2 влияют: Температура рH – эффект Бора Концентрация
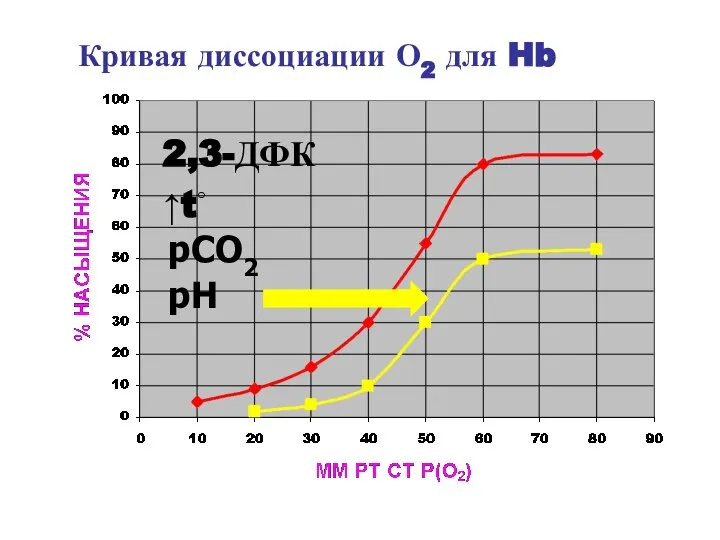
- 55. Кривая диссоциации О2 для Hb ↑t◦ pH pCO2 2,3-ДФК
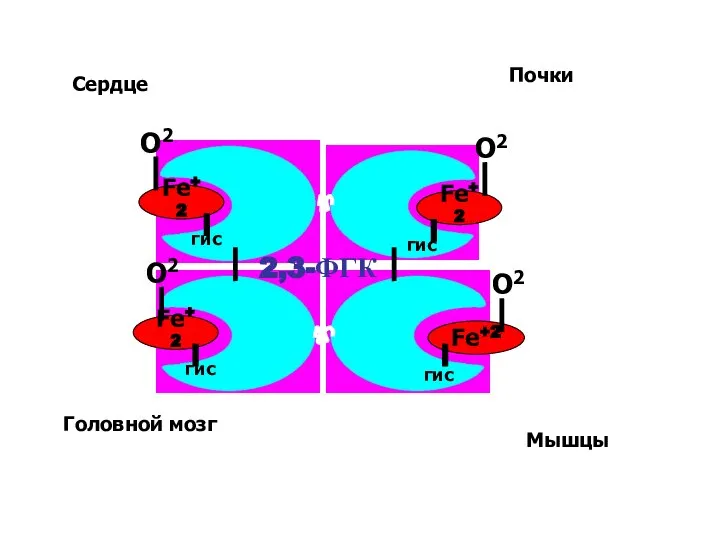
- 56. Fe+2 Fe+2 О2 Fe+2 Fe+2 гис гис гис гис О2 О2 О2 2,3-ФГК Сердце Головной мозг
- 57. Обмен веществ в лейкоцитах - полноценные клетки, содержат все органеллы. - присущи все виды обмена (кроме
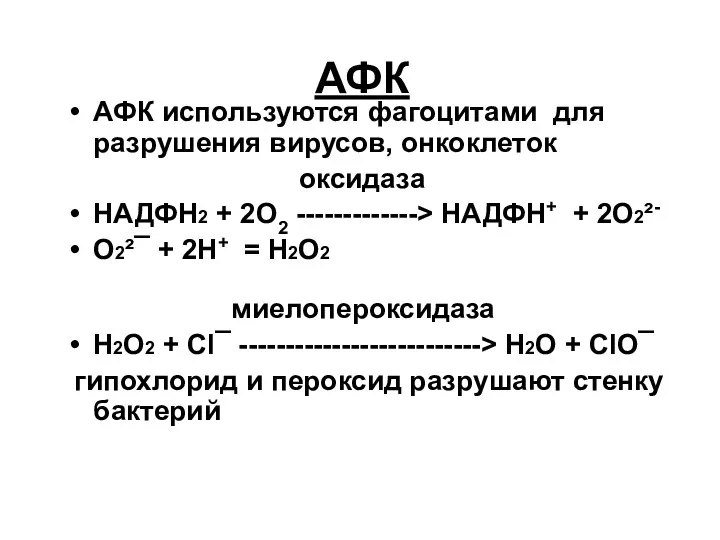
- 59. АФК АФК используются фагоцитами для разрушения вирусов, онкоклеток оксидаза НАДФН2 + 2О2 -------------> НАДФН+ + 2О2²-
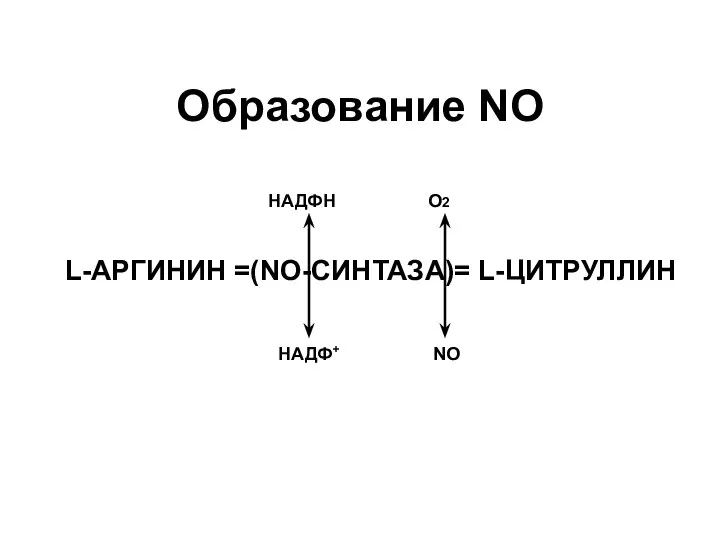
- 60. Образование NO L-АРГИНИН =(NO-СИНТАЗА)= L-ЦИТРУЛЛИН НАДФН НАДФ+ О2 NO
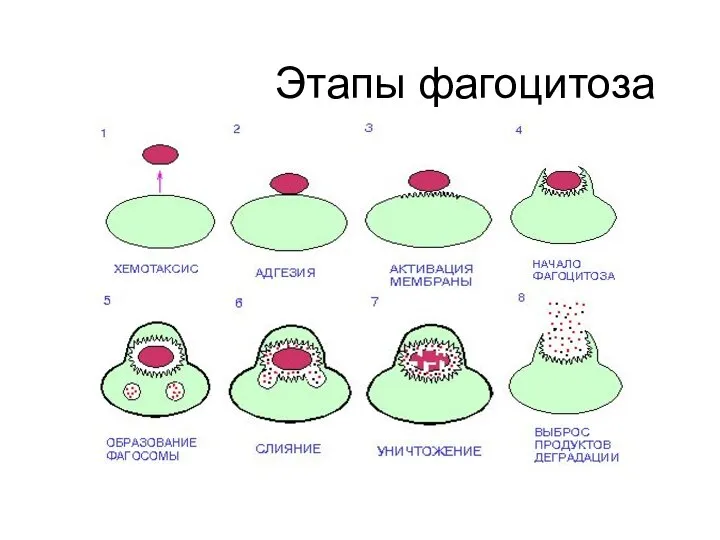
- 61. ФАГОЦИТОЗ Фагоцитоз-процесс активного поглощения и переваривания клетками организма попавших в него живых и убитых микробов или
- 62. Этапы фагоцитоза
- 66. Скачать презентацию






































 Химический элемент - америций
Химический элемент - америций Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1
Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1 Химический состав клетки
Химический состав клетки Волокнистые наполнители. (Тема 5)
Волокнистые наполнители. (Тема 5) Классификация неорганических соединений. Оксиды и их свойства
Классификация неорганических соединений. Оксиды и их свойства Гормоны
Гормоны  Алифатические углеводороды. Алканы, их свойства
Алифатические углеводороды. Алканы, их свойства Лекция 9-10. Диффузионная кинетика
Лекция 9-10. Диффузионная кинетика Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери
Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери Химический элемент. Вещества
Химический элемент. Вещества Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции. (лекция №10) Насыщенный пар. Зависимость давления насыщенного пара от температуры. Кипение
Насыщенный пар. Зависимость давления насыщенного пара от температуры. Кипение Фуллерены (шары Бакминстера)
Фуллерены (шары Бакминстера) Аппаратура ионообменных процессов
Аппаратура ионообменных процессов Игровые моменты на уроках химии Подготовила: Трубчанинова Е.П., учитель биологии и химии Грабской ЗОШ І-ІІ ст. Амвросиевского р
Игровые моменты на уроках химии Подготовила: Трубчанинова Е.П., учитель биологии и химии Грабской ЗОШ І-ІІ ст. Амвросиевского р Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин.
Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин.  Спирт. Спирты в природе. Влияние спирта на человека
Спирт. Спирты в природе. Влияние спирта на человека Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Підгрупа карбону
Підгрупа карбону Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Роль химии в нашей жизни
Роль химии в нашей жизни Защита полимеров от старения
Защита полимеров от старения Сплавы
Сплавы Технологія жирів і жирозамінників
Технологія жирів і жирозамінників Электродные процессы, их биологическая роль и применение в медицине
Электродные процессы, их биологическая роль и применение в медицине Нанокаталіз. Активність каталізатора
Нанокаталіз. Активність каталізатора Классификация опасных грузов
Классификация опасных грузов