Содержание
- 2. В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4.
- 3. Положение хрома в ПСХЭ Д.И. Менделеева. Строение атома. период группа порядковый номер Cr металл 24 4
- 4. Нахождение хрома в природе Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома
- 5. Физические свойства Плотность 7,19 г/см3; t плавления 1890°С; t кипения 2480°С. В свободном виде — голубовато-
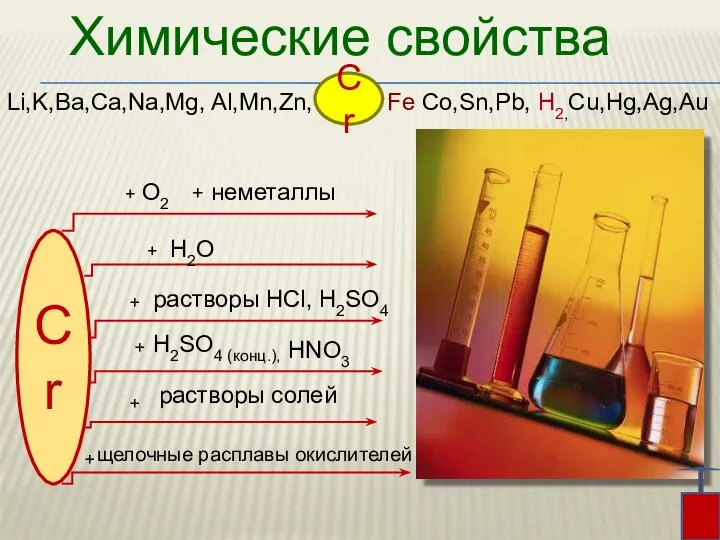
- 6. Химические свойства Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au Cr Cr + + + + H2SO4 (конц.), растворы
- 7. При комнатной температуре хром химически мало активен из-за образования на его поверхности тонкой прочной оксидной пленки.
- 8. В раскаленном состоянии хром реагирует с парами воды: 2Cr + 3H2O = Cr2O3 + 3H2 Li,K,Ba,Ca,Na,Mg,
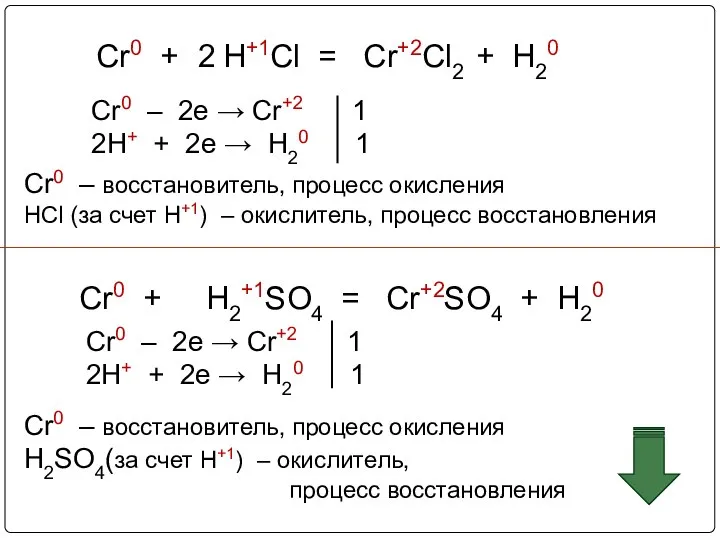
- 9. Cr0 + H+1Cl = Cr+2Cl2 + H20 Cr0 – 2e → Cr+2 1 2H+ + 2e
- 10. В присутствии кислорода хром реагирует с растворами кислот c образованием солей хрома (III) 4Cr + 12HCl
- 11. Концентрированные серная и азотная кислоты на холоду пассивируют хром При сильном нагревании кислоты pастворяют хром с
- 12. Хром способен вытеснять многие металлы, например медь, олово, серебро и другие, из растворов их солей: Cr0
- 13. Cr + KClO3 + KOH K2CrO4 + KCl + H2O Растворы щелочей на хром практически не
- 14. Хром - постоянная составная часть растительных и животных организмов. В крови содержится от 0,012 до 0,0035
- 15. Хром важный компонент во многих легированных сталях. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование)
- 16. Соединения хрома Соединения хрома (II) Соединения хрома (III) Соединения хрома (VI) оксид гидроксид соли оксид гидроксид
- 17. Соединения хрома (II) CrO Оксид хрома (II) – кристаллы черного цвета, имеет основный характер При осторожном
- 18. Оксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до оксида хрома (III) 4CrO + O2
- 19. Cr(OH)2 Гидроксид хрома (II) Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на
- 20. Гидроксид хрома (II) обладает основными свойствами. Cr(OН)2 + 2HCl = CrCl2 + 2H2O Гидроксид хрома (II)
- 21. Соли хрома (II) Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в
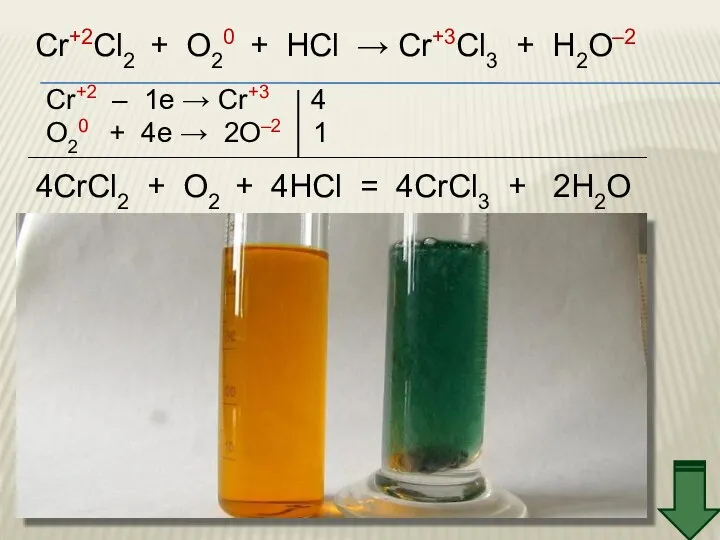
- 22. Cr+2Cl2 + O20 + HCl → Cr+3Cl3 + H2O–2 Cr+2 – 1e → Cr+3 4 O20
- 23. Соединения хрома (III) Cr2O3 Оксид хрома – тугоплавкий порошок темно-зеленого цвета. Оксид хрома (III) обладает амфотерными
- 24. В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель: Cr2O3 + KOH + KMnO4 →
- 25. Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида
- 26. Гидроксид хрома (III) Cr(OH)3 Получают гидроксид хрома (III) действием растворов щелочей или аммиака на растворы солей
- 27. Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте раствор
- 28. +H2SO4 +NaOH Осадок, полученный в опыте № 1 разделите на две части, к одной из них
- 29. Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3– Cr(OH)3 +
- 30. Соединения хрома (III) могут проявлять как окислительные, так и восстановительные свойства. K3[Cr(OH)6] + Br2 + KOH
- 31. Получают CrO3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na2Cr2O7 + 2H2SO4
- 32. CrO3 — кислотный оксид. С избытком воды образуется хромовая кислота H2CrO4 CrO3 + Н2O = Н2CrO4
- 33. CrO3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются
- 34. Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов
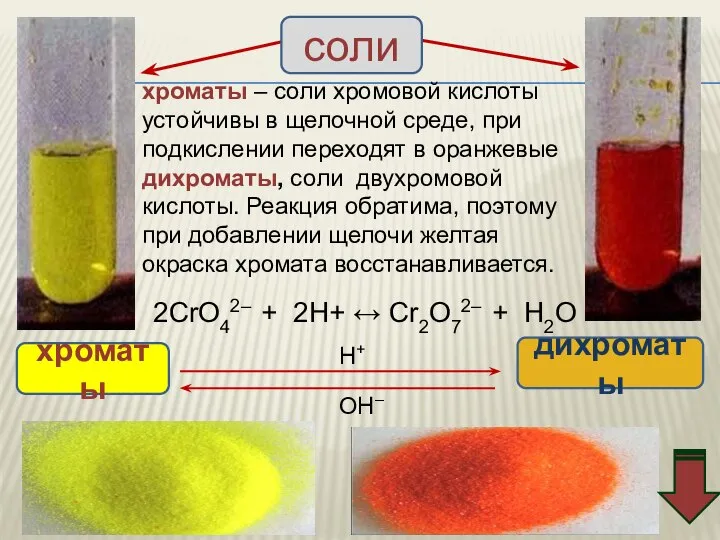
- 35. хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевые дихроматы, соли
- 36. Лабораторный опыт № 3 К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это
- 37. 2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
- 38. Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7,
- 39. Соединения хрома (VI) – сильные окислители Cr2O72– Cr3+ Cr(OH)3 [Cr(OH)6]3– H+ H2O OH– Cr2O72– + 14H+
- 40. Окислительные свойства дихроматов Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в
- 41. Zn + K2Cr2O7 + H2SO4 → ZnSO4 + Cr2(SO4)3 + K2SO4 +H2O K2Cr2O7 + H2S +
- 42. Дихромат калия (хромпик) широко применяется как окислитель органических соединений: 3С2H5OH + K2Cr2O7 + 4H2SO4 CH3– CHO
- 43. Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы. Дихромат аммония
- 44. В ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н2CrО4 закономерно происходит ослабление основных
- 46. Скачать презентацию
























![Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Cr(OH)3 + 3Na+ + 3OH– =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1394977/slide-28.jpg)








![Соединения хрома (VI) – сильные окислители Cr2O72– Cr3+ Cr(OH)3 [Cr(OH)6]3– H+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1394977/slide-38.jpg)





 Классификация карбоновых кислот. (Лекция 12)
Классификация карбоновых кислот. (Лекция 12) Гормоны. Фенилэтиламин
Гормоны. Фенилэтиламин Химия в кастрюле
Химия в кастрюле Жёсткость воды
Жёсткость воды α-Аминокислоты. Белки
α-Аминокислоты. Белки Аттестационная работа. Программа кружка по химии «Юный химик»
Аттестационная работа. Программа кружка по химии «Юный химик» L-3-Biomolecules (1) (1) (1)
L-3-Biomolecules (1) (1) (1) Союз химии и медицины
Союз химии и медицины Химия элементов VI группы главной подгруппы. Сера и ее соединения
Химия элементов VI группы главной подгруппы. Сера и ее соединения Аминокислоты. Классификация. Реакционная способность
Аминокислоты. Классификация. Реакционная способность Соли азотной кислоты, применение Девиз урока «Au, Na, Ar, Ne, It, Eu – Os, Ra,U, Db, In, Er, As Ni, Es C, Eu La Ь» Л. Н. Толстой
Соли азотной кислоты, применение Девиз урока «Au, Na, Ar, Ne, It, Eu – Os, Ra,U, Db, In, Er, As Ni, Es C, Eu La Ь» Л. Н. Толстой Углероды: их роль и значение в жизни человека
Углероды: их роль и значение в жизни человека Презентация по Химии "Алкины. Ацетилен" - скачать смотреть
Презентация по Химии "Алкины. Ацетилен" - скачать смотреть  Периодическая таблица Д.И. Менделеева Элемент № 24 ХРОМ
Периодическая таблица Д.И. Менделеева Элемент № 24 ХРОМ Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Химия p-элементов (лекция 12)
Химия p-элементов (лекция 12) Чугуны. Структура и свойства. Классификация и применение
Чугуны. Структура и свойства. Классификация и применение Обменные реакции в растворах электролитов
Обменные реакции в растворах электролитов Ионная связь
Ионная связь Продолжение лекции «Химическая связь»
Продолжение лекции «Химическая связь» Обмен веществ и энергии
Обмен веществ и энергии Нефть и способы ее переработки
Нефть и способы ее переработки Презентация по химии ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Презентация по химии ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Производные карбоновых кислот
Производные карбоновых кислот Спирты: свойства, получение, применение
Спирты: свойства, получение, применение Закономерности протекания химических процессов
Закономерности протекания химических процессов Минералы. Свойства минералов
Минералы. Свойства минералов