Содержание
- 2. Химия – это наука о веществах, их свойствах и превращениях Физическое тело вещество Химический элемент -
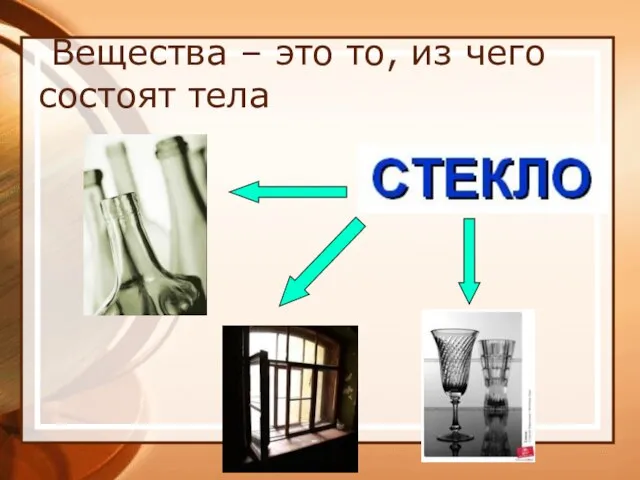
- 4. Вещества – это то, из чего состоят тела
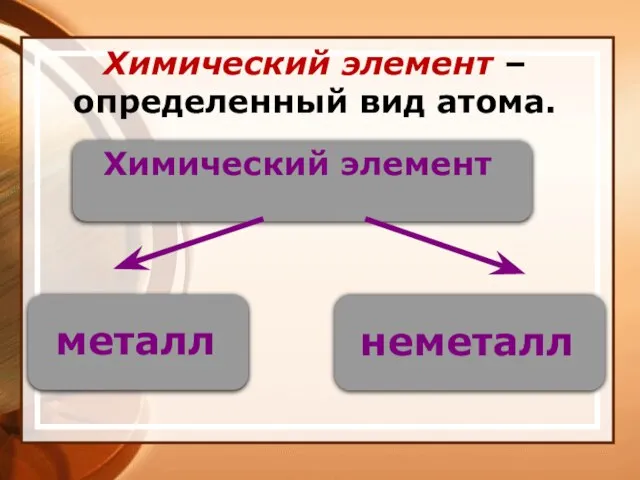
- 5. Химический элемент – определенный вид атома.
- 6. План характеристики элемента: 1. Символ и название. 2. Положение в ПСХЭ. 3. Строение атома. 4. Электронная
- 7. Ион - Заряженная частица вещества NA+, Cl- , SO4 2-, Al3+
- 8. это вещества, состоящие из атомов одного химического элемента это вещества, состоящие из атомов двух или нескольких
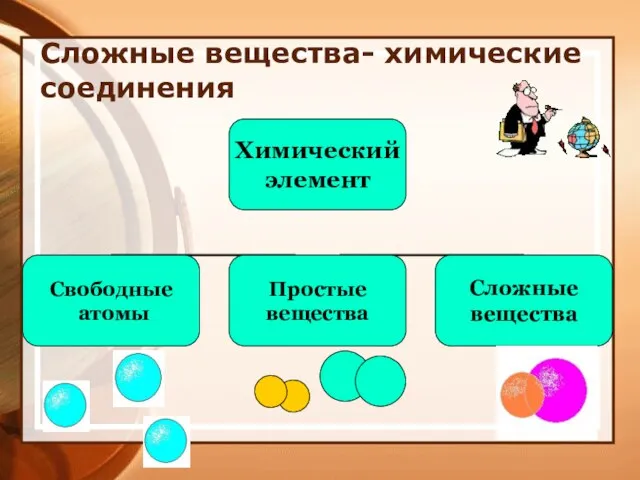
- 9. Сложные вещества- химические соединения
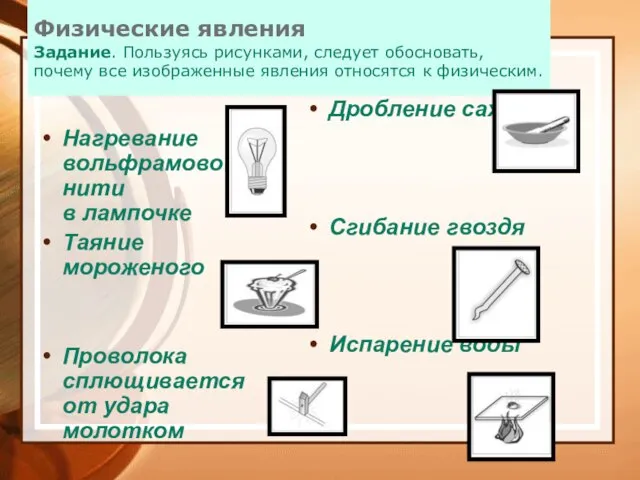
- 10. Физические явления Задание. Пользуясь рисунками, следует обосновать, почему все изображенные явления относятся к физическим. Нагревание вольфрамовой
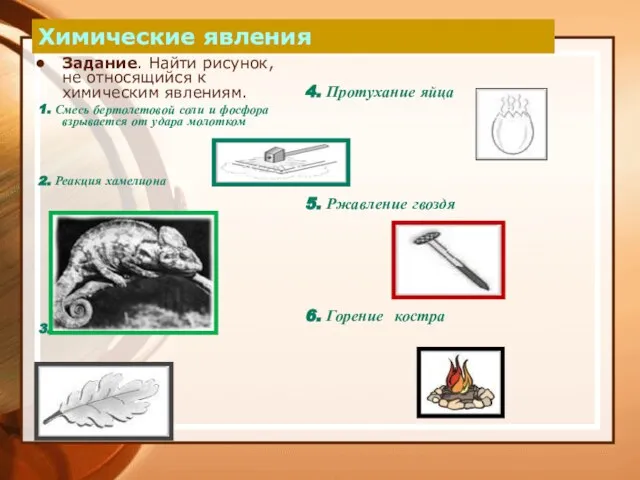
- 11. Химические явления Задание. Найти рисунок, не относящийся к химическим явлениям. 1. Смесь бертолетовой соли и фосфора
- 12. Признаки химической реакции Изменение окраски. Выделение или поглощение теплоты. Появление запаха. Образования осадка. Выделение газа.
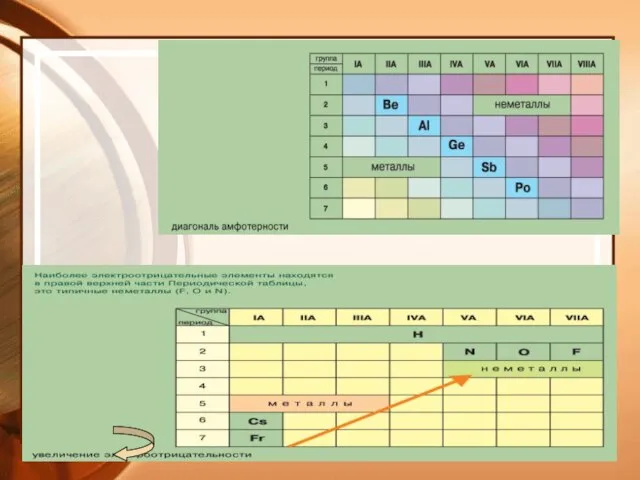
- 13. ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ: В пределах одного периода слева направо металлические свойства ослабевают; А неметаллические возрастают.
- 14. Под ВАЛЕНТНОСТЬ (сила) понимают свойства атомов образовывать химические связи с другими атомами, а также число одинарных
- 15. Химические формулы Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
- 16. Химическая формула.
- 17. Закон постоянства состава вещества или закон Пруста. каждое химически чистое вещество с молекулярным строением независимо от
- 18. Индекс показывает количество атомов данного элемента в молекуле. Итак, состав веществ выражается химическими формулами с целочисленными
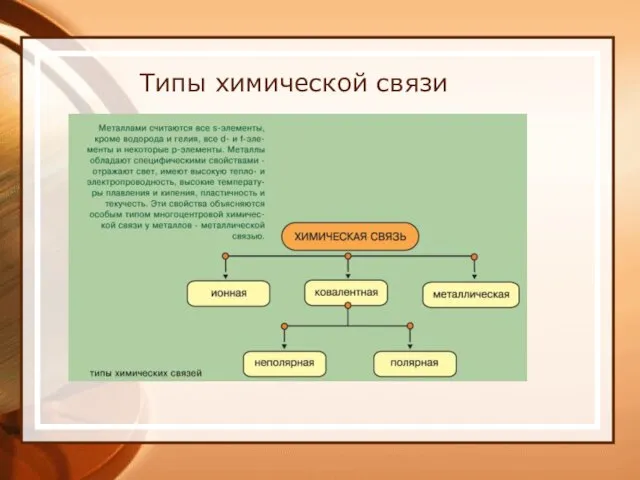
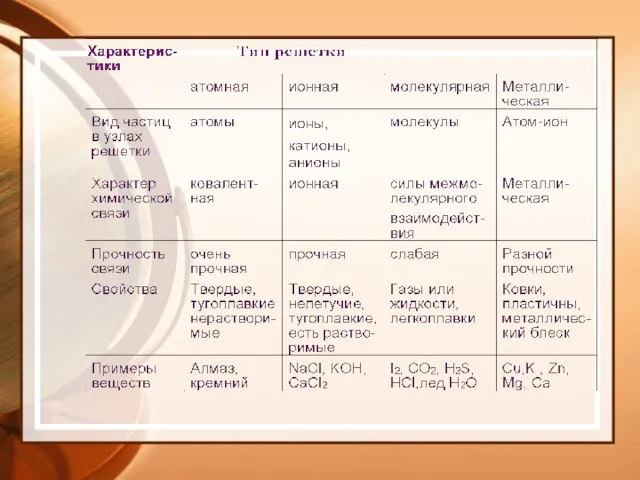
- 19. Типы химической связи
- 21. Электроотрицательность - способность атомов оттягивать на себя электроны. Ряд ЭО: Si H P C S Br
- 23. Металлы Na K Ca Ba Cu Ag Au Zn Pb Hg Al Mg Mn Fe натрий
- 24. Неметаллы S Cl Br C Si J N P O F H cера углерод водород кремний
- 25. Au 79 196, 97 число, показывающее во сколько раз масса данного атома больше массы атома водорода
- 26. Массовые доли элементов. ФОРМУЛА: Ar (эл.)• n W(эл.) Mr (в-ва) Единицы измерения [доли] или [%], в
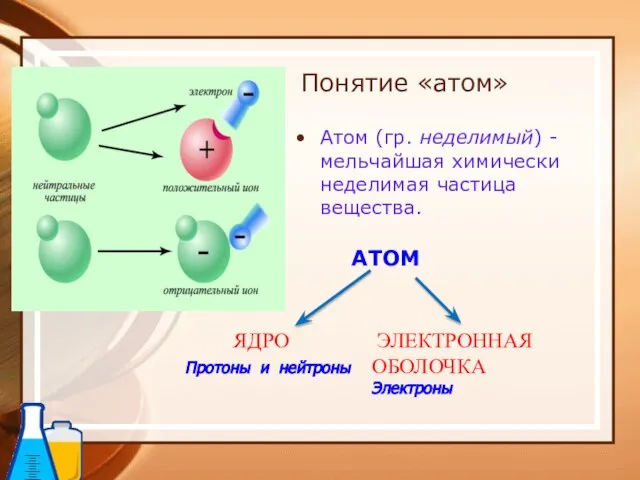
- 27. Понятие «атом» Атом (гр. неделимый) - мельчайшая химически неделимая частица вещества. АТОМ
- 28. ОСНОВНЫЕ ПОЛОЖЕНИЯ ПЛАНЕТАРНОЙ МОДЕЛИ: Атом – это микрочастица, которая имеет форму шара. Атом – это сложная
- 29. Как измерить вещество? Необходимо точно знать число частиц вещества, т.е. его количество Единица количества вещества –
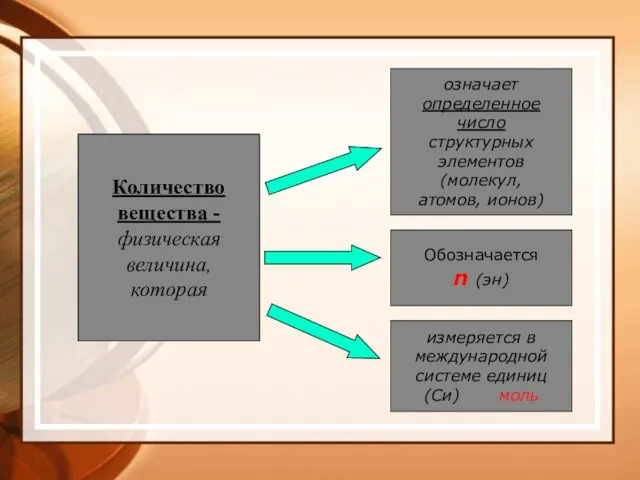
- 30. Количество вещества - физическая величина, которая означает определенное число структурных элементов (молекул, атомов, ионов) Обозначается n
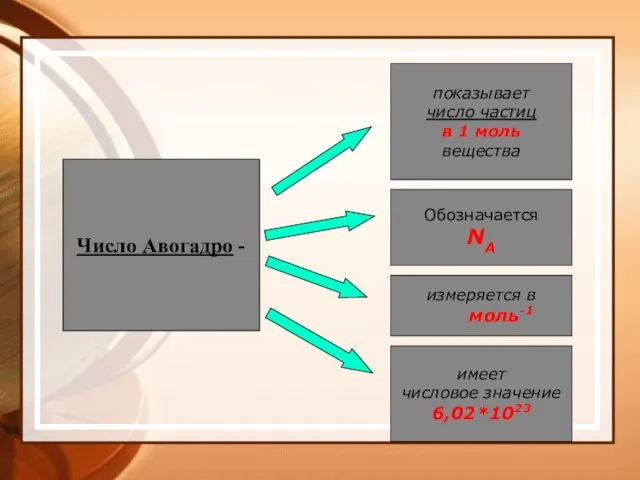
- 31. Число Авогадро - показывает число частиц в 1 моль вещества Обозначается NA измеряется в моль-1 имеет
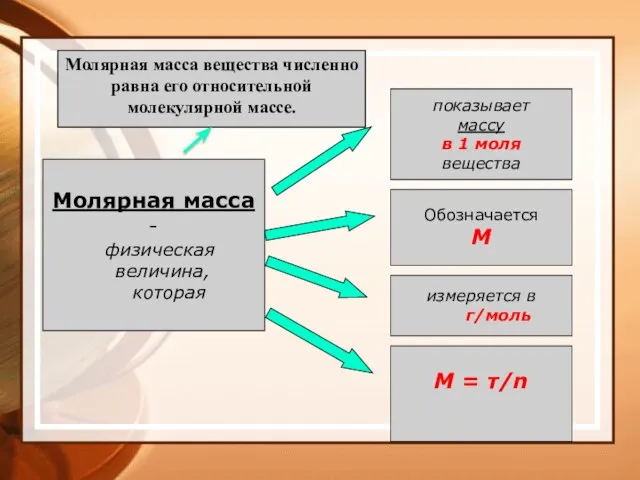
- 32. Молярная масса - физическая величина, которая показывает массу в 1 моля вещества Обозначается М измеряется в
- 33. Для расчёта количества n= m / М n=V/Vm n =N / Na
- 34. Но если число частиц известно? В 1 моле содержится 6 ● 10 23 частиц Эта величина
- 35. Амедео Авогадро высказал предположение в 1811 году, что В равных объемах различных газов при одинаковых условиях
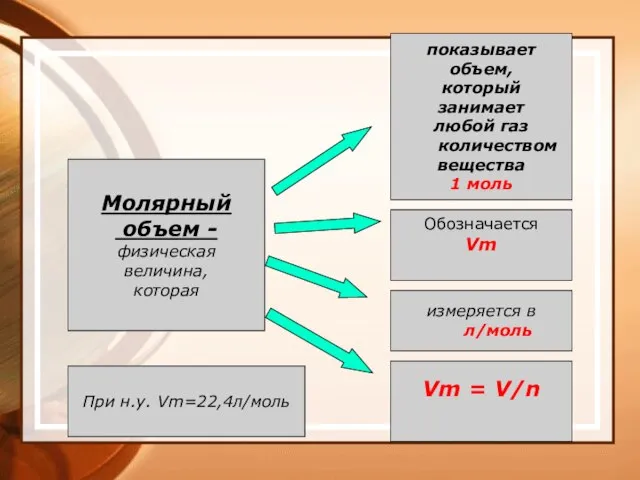
- 36. Молярный объем газа Vm — величина, определяемая отношением объема данной порции газа V к химическому количеству
- 37. Молярный объем - физическая величина, которая показывает объем, который занимает любой газ количеством вещества 1 моль
- 38. Производные формулы Иванова Г.А. gale993@yandex.ru m= n ● М V=n ● Vm N =n ● Na
- 39. Отношение массы растворимого вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают
- 41. Скачать презентацию

























 Углерод. Вещества, имеющие одинаковое значение степени окисления углерода
Углерод. Вещества, имеющие одинаковое значение степени окисления углерода Пластмассы и волокна
Пластмассы и волокна Препараты гормонов, их синтетические аналоги и антагонисты
Препараты гормонов, их синтетические аналоги и антагонисты Циклоалканы. Строение, изомерия, получение и свойства
Циклоалканы. Строение, изомерия, получение и свойства студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак
студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак Виды присадок к моторным топливам
Виды присадок к моторным топливам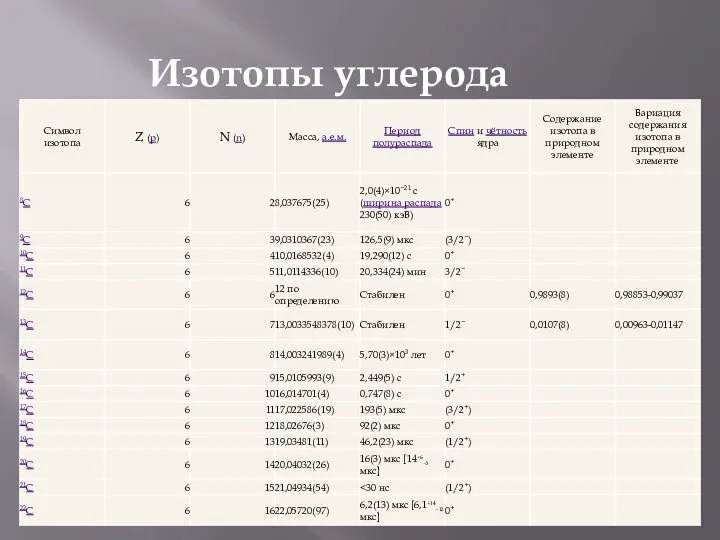 Изотопы углерода. Символ изотопа
Изотопы углерода. Символ изотопа Реализация принципов профессиональной направленности при изучении химии
Реализация принципов профессиональной направленности при изучении химии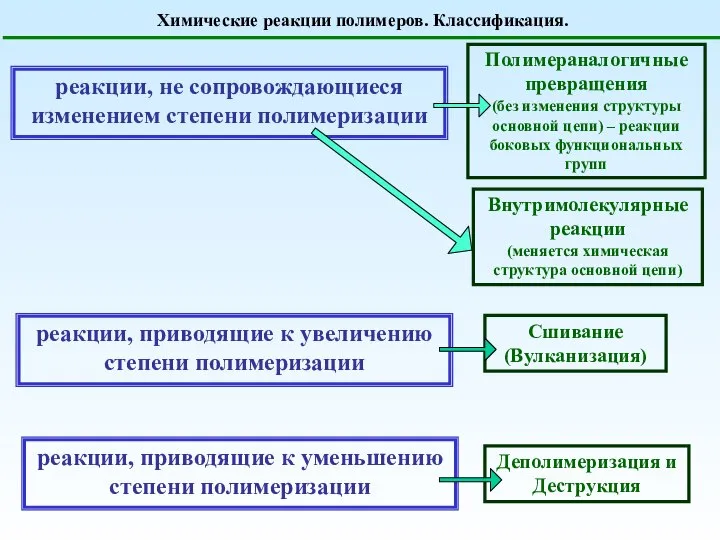 Презентация по Химии "Химические реакции полимеров. Классификация" - скачать смотреть бесплатно
Презентация по Химии "Химические реакции полимеров. Классификация" - скачать смотреть бесплатно Химическая связь
Химическая связь Подготовка к итоговой контрольной работе. (9 класс)
Подготовка к итоговой контрольной работе. (9 класс) История каучука
История каучука Реакции при участии катализатора
Реакции при участии катализатора Альдегиды
Альдегиды Теория строения химических соединений А.М. Бутлерова
Теория строения химических соединений А.М. Бутлерова Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Охрана окружающей среды от загрязнения сульфуро-содержащими соединениями
Охрана окружающей среды от загрязнения сульфуро-содержащими соединениями Химические элементы O2 и N2
Химические элементы O2 и N2 Сопротивление материалов. Металлический тип химической связи и основные свойства металлов
Сопротивление материалов. Металлический тип химической связи и основные свойства металлов Классификация неорганических веществ
Классификация неорганических веществ Методика проведения информированного добровольного тестирования учащихся на наличие наркотических и психотропных веществ
Методика проведения информированного добровольного тестирования учащихся на наличие наркотических и психотропных веществ  Нафта, сланцевий газ, екологія середовища Підготувала учениця 11 Б класу Кандибка Ольга
Нафта, сланцевий газ, екологія середовища Підготувала учениця 11 Б класу Кандибка Ольга  Презентация по химии Природные и синтетические красители и ароматизаторы
Презентация по химии Природные и синтетические красители и ароматизаторы  Відносна густина газів
Відносна густина газів Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) Природный газ
Природный газ Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Типы изомерии
Типы изомерии