Соли азотной кислоты, применение Девиз урока «Au, Na, Ar, Ne, It, Eu – Os, Ra,U, Db, In, Er, As Ni, Es C, Eu La Ь» Л. Н. Толстой
Содержание
- 2. знать и уметь называть соли азотной кислоты, определять какие свойства окислительные или и восстановительные характерны для
- 3. Игра «КРЕСТИКИ- НОЛИКИ Раствор азотной кислоты реагирует с каждым из веществ.
- 4. К каким классам неорганических веществ принадлежат эти вещества? 1.Назовите соли - продукты этих реакций 2. Составьте
- 5. Закончите уравнения реакций и объясните, какие классы соединений при взаимодействии могут давать нитраты. ВаО + НNO3→
- 6. Даны пары веществ, составьте возможные уравнения реакций а) гидроксид натрия и азотная кислота, б) гидроксид калия
- 7. Перечислите соли полученные в результате возможных реакций. Нитраты калия, натрия, кальция и аммония называют селитрами KNO3
- 8. Нитраты – твердые кристаллические вещества, тугоплавки, определите по таблице растворимости, к каким электролитам они относятся -
- 9. Физические свойства нитратов Какие вещества называют солями? Нужно построить логическую цепочку: вид химической связи – тип
- 10. Химические свойства нитратов Взаимодействие нитратов с металлами, кислотами, щелочами, солями Cu(NO3)2 + Zn … , AgNO3
- 11. Занимательная история Любознательный химик изучил типы химических реакций и заметил, что нерастворимые карбонаты (CaCO3) , сульфиты
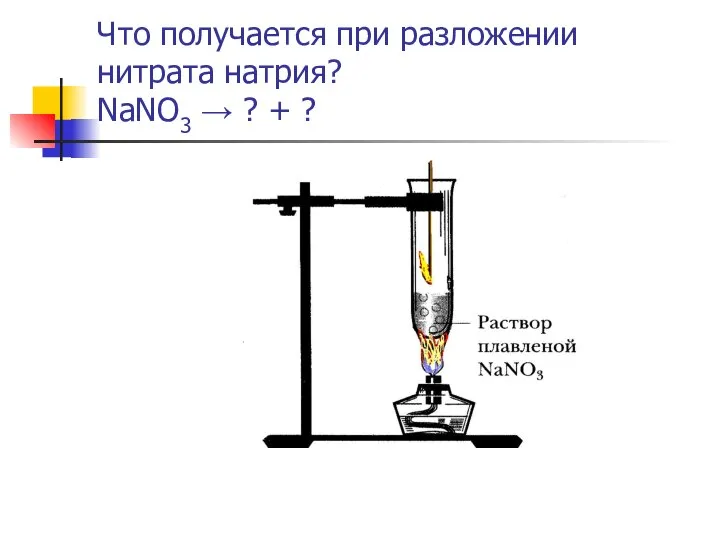
- 12. Что получается при разложении нитрата натрия? NaNO3 → ? + ?
- 13. После первого опыта юный химик решил проверить, как будут разлагаться другие соли, например, нитрат меди(II) ,
- 14. Cu(NO3)2 → А + В +? Cu(NO3)2 → … + ...+ …
- 15. Разложение нитрата меди (II)
- 17. Скачать презентацию













 Пластмасса
Пластмасса Вторичный метаболизм и запасные вещества семени растений
Вторичный метаболизм и запасные вещества семени растений Электроотрицательность (ЭО). Ковалентная связь
Электроотрицательность (ЭО). Ковалентная связь Признаки и условия протекания химических реакций
Признаки и условия протекания химических реакций Дифракционные методы исследований наноматериалов
Дифракционные методы исследований наноматериалов Белки простые и сложные
Белки простые и сложные Тема 13. Состав, строение и свойства стекла и хрусталя 1. Оксид кремния 71-73% 2. Оксид натрия 13-16% 3. Оксид кальция 5-10% 4. Оксид магния 2
Тема 13. Состав, строение и свойства стекла и хрусталя 1. Оксид кремния 71-73% 2. Оксид натрия 13-16% 3. Оксид кальция 5-10% 4. Оксид магния 2 Mechanistic insights into the aminolysis of 3,4-epoxysulfolane
Mechanistic insights into the aminolysis of 3,4-epoxysulfolane Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер
Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер Применение спиртов в медицине Выполнила студентка 11 группы Сыровацкая Лилия
Применение спиртов в медицине Выполнила студентка 11 группы Сыровацкая Лилия Диктант: название алканов
Диктант: название алканов Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена
Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена  Атмосфера. Химические и физико-химические процессы в атмосфере
Атмосфера. Химические и физико-химические процессы в атмосфере Химический элемент МЫШЬЯК
Химический элемент МЫШЬЯК Шампунь для волосся
Шампунь для волосся  Carbohydrates. mono-, di-, polysachcrides
Carbohydrates. mono-, di-, polysachcrides NiCl2 - Никель хлориді
NiCl2 - Никель хлориді Теория создание стекла, оптические кристаллы
Теория создание стекла, оптические кристаллы Натрия и калия иодиды. Йод, раствор иода спиртовый 5%
Натрия и калия иодиды. Йод, раствор иода спиртовый 5% Химическая связь и ее типы. (11 класс)
Химическая связь и ее типы. (11 класс) Адсорбционные явления. Общая характеристика адсорбции
Адсорбционные явления. Общая характеристика адсорбции Медь
Медь Кислородсодержащие классы органических соединений. Гидроксисоединения. Карбонильные соединения. (Лекция 3)
Кислородсодержащие классы органических соединений. Гидроксисоединения. Карбонильные соединения. (Лекция 3) Органический синтез
Органический синтез Физика, химия и диагностика поверхности
Физика, химия и диагностика поверхности Кинетика гетерогенно-каталитических реакций. (Лекция 22)
Кинетика гетерогенно-каталитических реакций. (Лекция 22) Соли. Тема 3
Соли. Тема 3