Содержание
- 2. Решение задач – важнейшая сторона овладения знаниями основ химии 4. Развитие творческого мышления и т.д. Включение
- 3. - способствуют реализации межпредметных связей, и следовательно - развитию научного мировоззрения учащихся; Задачи: - способствуют формированию
- 4. Классификация задач Экспериментальные (качественные) Расчетные (количественные) I группа II группа Типы: …………….. Типы: ……………..
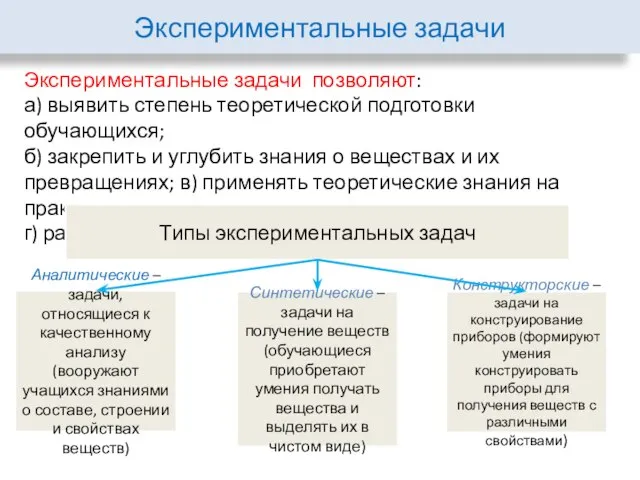
- 5. Экспериментальные задачи Экспериментальные задачи позволяют: а) выявить степень теоретической подготовки обучающихся; б) закрепить и углубить знания
- 6. Аналитические задачи По степени сложности: а) отнесение веществ к определенному классу – кислоты, основания, соли (распознаются
- 7. Синтетические задачи 6) рассчитать выход продукта реакции в процентах к теоретическому рассчитанному количеству или массе веществ.
- 8. Синтетические задачи 2. Получение вещества, если известно одно исходное. Получить 50 грамм гидроксид меди (II) из
- 9. Конструкторские задачи предполагают сборку прибора для получения заданного вещества. В задачах на конструирование приборов очень важно
- 10. Расчетные задачи базируются на стехиометрических законах: законе сохранения массы веществ; законе постоянства состава; законе постоянства количественных
- 11. Расчеты по химическим формулам 2. Вычисление отношений масс элементов в сложном веществе. где ω – массовая
- 12. Расчеты по химическим формулам 7. Вычисление массы вещества по его количеству: m=ν M, где М –
- 13. Расчеты по химическим уравнениям 1. Вычисления массовых отношений, в которых реагируют и получаются вещества. Определить массовые
- 14. Расчеты по химическим уравнениям 2. Вычисление массы или количества исходных веществ, необходимых для получения заданного количества
- 15. Расчеты по химическим уравнениям 4. Задачи на избыток – недостаток (вычисление массы или количества вещества продукта
- 16. Расчеты по химическим уравнениям 5. Определение выхода продукта реакции в процентах к теоретическому выходу. Рассчитать выход
- 17. Расчеты по химическим уравнениям 6. Определение массы или количества вещества продукта реакции или исходных веществ, если
- 18. Расчеты по химическим уравнениям Рассчитайте, количество теплоты выделяющейся при образовании хлороводорода объемом 8,96 л (н.у.), если
- 19. Расчеты для приготовления растворов и определения их концентрации 1. Расчет массы вещества для приготовления растворов заданной
- 20. Расчеты для приготовления растворов и определения их концентрации 3. Определение молярной концентрации раствора, если известен объем
- 21. Комбинированные и усложненные задачи Комбинированные задачи требуют сочетания не одного, а нескольких видов расчётов. Усложненные задачи,
- 22. Способы решения задач В ходе решения задач с помощью пропорций предлагается: установление зависимости между количествами веществ;
- 23. Способы решения задач Задачи с обратно пропорциональной зависимостью Определить массу 90 %-ного раствора, необходимого для приготовления
- 24. Способы решения задач Решение задач алгебраическим методом требует от учащихся более глубоких логических рассуждений и приучает
- 25. Способы решения задач Приготовить 350 г раствора с массовой долей серной кислоты 15 %-ов путем смешения
- 26. Способы решения задач
- 27. Способы решения задач Из 24,5 г смеси сульфатов калия и натрия получено 34,5 г сульфата бария.
- 28. Способы решения задач Решение задач методом приведения к единице используется для определения состава химических формул. В
- 29. Способы решения задач Вывести формулу минерала карналита. В состав карналита входят 26,9% KCl; 34,2% MgCl2; 38,9%
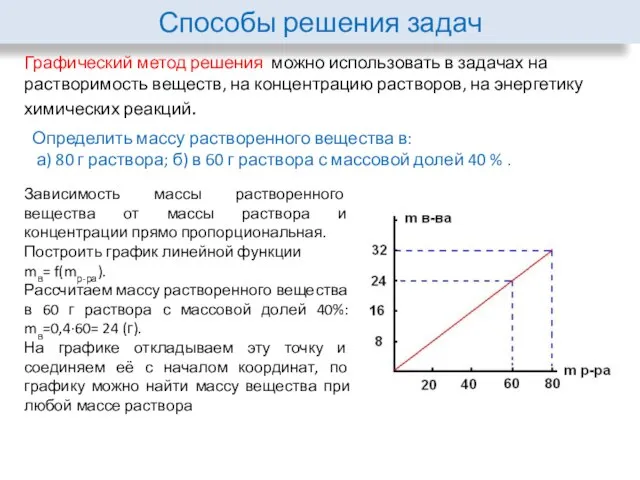
- 30. Способы решения задач Графический метод решения можно использовать в задачах на растворимость веществ, на концентрацию растворов,
- 31. Вывод формул веществ Нужно знать Молярную массу вещества Соотношение числа атомов элементов в молекуле Оно задается:
- 32. Вывод формул веществ Задача. При полном сгорании 2 л неизвестного газа в 5 л кислорода Выделяется
- 33. Скорость химических реакций Напишите выражение скорости химической реакции, протекающей в гомогенной системе по уравнению А+2В=АВ2 и
- 34. Скорость химических реакций Исходные концентрации веществ А2 и В2 соответственно равны 0,5 и 0,2 моль/л. После
- 36. Скачать презентацию































 Презентация по Химии "Нейский хрусталь" - скачать смотреть
Презентация по Химии "Нейский хрусталь" - скачать смотреть  Применение закона действующих масс к гетерогенным равновесиям. Ионное произведение растворимости. (Лекция 5)
Применение закона действующих масс к гетерогенным равновесиям. Ионное произведение растворимости. (Лекция 5) Пищевые добавки
Пищевые добавки Характеристика промышленных аэрозолей аллергического и раздражающего действия. Характеристика отдельных нозологических форм
Характеристика промышленных аэрозолей аллергического и раздражающего действия. Характеристика отдельных нозологических форм Органическая химия. Жиры
Органическая химия. Жиры Проблема химического элемента. Концепции структуры химических соединений
Проблема химического элемента. Концепции структуры химических соединений Харчові добавки в напоях
Харчові добавки в напоях  Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ
Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ Радиоактивные элементы
Радиоактивные элементы Презентация Автор: Кудрявцева Марина Анатольевна Учитель химии МОУ «СОШ №12»
Презентация Автор: Кудрявцева Марина Анатольевна Учитель химии МОУ «СОШ №12»  Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Хімія і екологія
Хімія і екологія  АНАЛИТИЧЕСКАЯ БИОХИМИЯ Цели курса: 1.Развитие интереса к выбранному профилю. 2. Показать наглядно эксперименты и опыты
АНАЛИТИЧЕСКАЯ БИОХИМИЯ Цели курса: 1.Развитие интереса к выбранному профилю. 2. Показать наглядно эксперименты и опыты Изготовление мыла в домашних условиях
Изготовление мыла в домашних условиях Попова Ольга Викторовна учитель химии ГБОУ школа 634 города Санкт-Петербург «Мониторинг продуктов питания»
Попова Ольга Викторовна учитель химии ГБОУ школа 634 города Санкт-Петербург «Мониторинг продуктов питания» Важнейшие научные открытия и технические сооружения в науке и культуре
Важнейшие научные открытия и технические сооружения в науке и культуре Растворы
Растворы Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Электроповерхностные явления. Строение двойного электрического слоя
Электроповерхностные явления. Строение двойного электрического слоя NiCl2 - Никель хлориді
NiCl2 - Никель хлориді Платина. Физические и химические свойства
Платина. Физические и химические свойства Кислотно-основные равновесия в растворах
Кислотно-основные равновесия в растворах Алхимический период
Алхимический период Горючие полезные ископаемые Каменный уголь Нефть Природный газ
Горючие полезные ископаемые Каменный уголь Нефть Природный газ  Технология производства сложных полиэфиров
Технология производства сложных полиэфиров Будівельні матеріали. Їх використання.
Будівельні матеріали. Їх використання.  Алициклические и гетероциклические соединения. Тема № 7, 8
Алициклические и гетероциклические соединения. Тема № 7, 8 Очистка воды. Лабораторная работа в домашних условиях
Очистка воды. Лабораторная работа в домашних условиях