Содержание
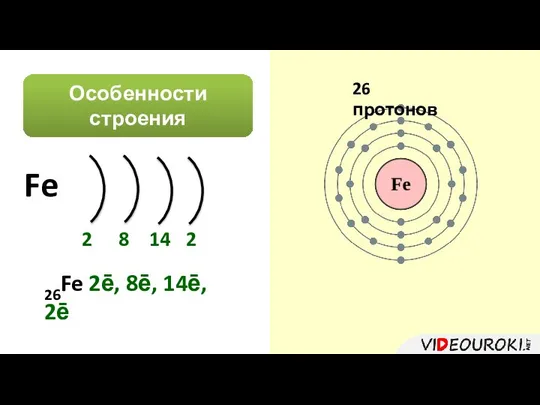
- 3. Особенности строения атома 26Fe 2ē, 8ē, 14ē, 2ē Fe 2 8 14 2 26 протонов
- 4. Особенности строения атома 26Fe 2ē, 8ē, 14ē, 2ē 26 протонов Fe0 - 2ē → Fe+2 Fe0
- 5. Железо – простое вещество Блестящий серебристо-белый металл. Температура плавления 1539 0С. Плотность железа 7,87 г/см3. Железо
- 6. Минералы Второе место по распространённости среди металлов. Магнитный железняк, или магнетит Fe3O4 Красный железняк, или гематит
- 7. Технически чистое железо Химически чистое железо Низкоуглеродистая сталь, содержащая 0,02-0,04% углерода. Небольшое содержание кислорода, серы, азота
- 8. «Железо» ― это «капнувший с неба, небесный»
- 9. Метеорит массой 60 т Метеорит массой 30 т
- 12. Получение: 2Fe2O3 + 3C = 4Fe + 3CO2 Fe2O3 + 3CO = 2Fe + 3CO2 Fe2O3
- 13. Химические свойства: Степень окисления +2 Степень окисления +3 2Fe + 3Br2 = 2FeBr3 3 ē Бромид
- 14. Химические свойства: Степень окисления +2, +3 Степень окисления +2 2 ē Хлорид железа (II) 0 +1
- 15. FeO → Fe(OH)2 Fe → FeCl2 → Fe(OH)2 → FeO 1 2 3 1) Fe +
- 16. FeO и Fe(OH)2 обладают основными свойствами FeO + 2H+ = Fe2+ + H2O Fe(OH)2 + 2H+
- 17. 1 2 3 1) 2) 3) t Fe2O3 → Fe(OH)3 Fe → FeCl3 → Fe(OH)3 →
- 18. Fe2O3 и Fe(OH)3 проявляют слабовыраженные амфотерные свойства t 2Fe(OH)3 = Fe2O3 + 3H2O Fe2O3 + 6H+
- 19. FeCl2 + 2КOH = Fe(OH)2↓ + 2КCl Fe2+ + 2OH- = Fe(OH)2↓ FeCl3 + 3KOH =
- 20. 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O 2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O
- 21. FeSO4 · 7H2O Железный купорос
- 22. Распознавание соединений железа (II) Распознавание соединений железа (III) K3[Fe(CN)6] Красная кровяная соль K4[Fe(CN)6] Жёлтая кровяная соль
- 23. Распознавание соединений железа (III) Роданид калия Роданид аммония KSCN NH4SCN KSCN Fe3+ + SCN- ↔ FeSCN2+
- 24. Массовая доля железа в животных организмах составляет около 0,01%. В организме человека содержится около 5 г
- 26. Скачать презентацию



















![Распознавание соединений железа (II) Распознавание соединений железа (III) K3[Fe(CN)6] Красная кровяная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/668681/slide-21.jpg)


 Хроматография как метод разделения и обнаружения в качественном анализе Выполнила: студентка 2 курса Акаева Дарья
Хроматография как метод разделения и обнаружения в качественном анализе Выполнила: студентка 2 курса Акаева Дарья  Дисперсные системы. Поверхностная энергия
Дисперсные системы. Поверхностная энергия Система подготовки к ЕГЭ по математике Рулева Т.Г. МОУ СОШ №42 г. Петрозаводск Республика Карелия
Система подготовки к ЕГЭ по математике Рулева Т.Г. МОУ СОШ №42 г. Петрозаводск Республика Карелия Екологія води Алєксєєнко, Жуковська
Екологія води Алєксєєнко, Жуковська  Натрій - найважливіший представник лужних металів
Натрій - найважливіший представник лужних металів Коррозия металлов
Коррозия металлов Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Основания, их классификация, способы получения и свойства. 8 класс
Основания, их классификация, способы получения и свойства. 8 класс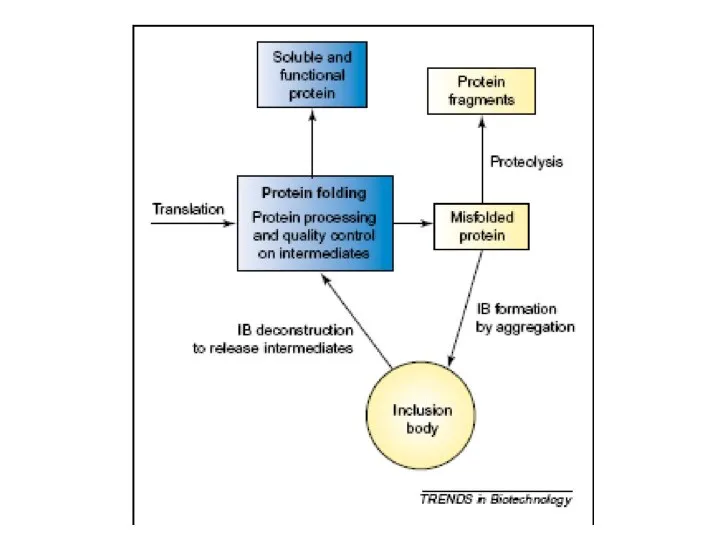 Рефолдинг миниантител
Рефолдинг миниантител Чистые вещества и смеси. Способы разделения смесей. Загадка
Чистые вещества и смеси. Способы разделения смесей. Загадка Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы Минералы. Свойства минералов
Минералы. Свойства минералов Белый камень
Белый камень Самоорганизация на межфазных границах, метод Ленгмюра-Блоджетт. Объекты исследования коллоидной химии
Самоорганизация на межфазных границах, метод Ленгмюра-Блоджетт. Объекты исследования коллоидной химии Презентация по Химии "Кальций" - скачать смотреть
Презентация по Химии "Кальций" - скачать смотреть  Презентація на тему: Твердість води Способи усунення твердості води
Презентація на тему: Твердість води Способи усунення твердості води  Ситалл – искусственный поликристаллический материал
Ситалл – искусственный поликристаллический материал Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Волшебные свойства воды
Волшебные свойства воды Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Строение и химические свойства кислот
Строение и химические свойства кислот Презентация по Химии "Эффективность снижения общей жесткости воды различными умягчителями, поступающими в продажу" - скачать
Презентация по Химии "Эффективность снижения общей жесткости воды различными умягчителями, поступающими в продажу" - скачать Металлы. Из истории металлов
Металлы. Из истории металлов Обобщение и систематизация знаний по теме «Химическая связь и строение атома»
Обобщение и систематизация знаний по теме «Химическая связь и строение атома» Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Периодический закон Менделеева и периодическая система химических элементов
Периодический закон Менделеева и периодическая система химических элементов  Магия 15 элемента
Магия 15 элемента Стратегия успеха 2 (ЕГЭ). Органическая химия
Стратегия успеха 2 (ЕГЭ). Органическая химия