Содержание
- 2. План: I ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ Положение в периодической таблице Строение атома Нахождение в природе II
- 3. Синквейн: Прочитайте и найдите ошибку? Металлы Блестящие Ковкие Окисляются Растворяются Замещаются Имеют молекулярную кристаллическую решетку Восстановители
- 4. i. как химический элемент Химический элемент- VIII группы, побочной подгруппы Периодической системы Д.И. Менделеева. Атомный номер
- 5. Строение атома Р(+)=26 n(о)=30 ядро е(-)=26 Электронная формула: 1s22s22р63s23р63d64s2
- 6. Нахождение в природе В земной коре железо распространено достаточно широко. На его долю приходится: Около 4,1%
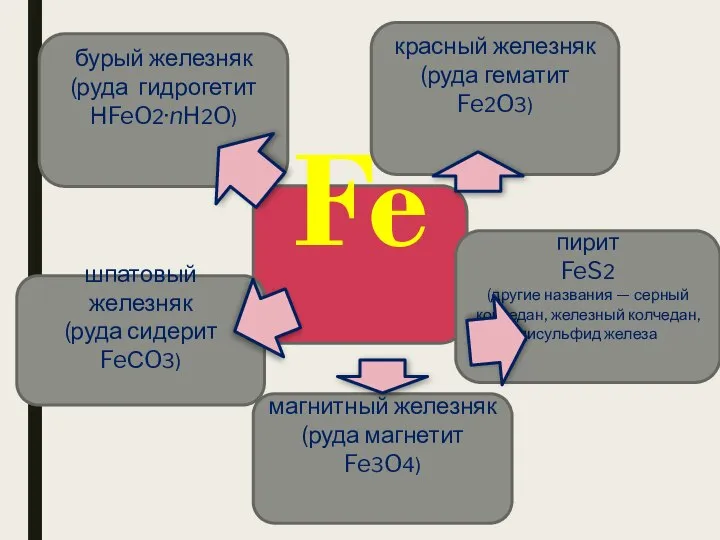
- 7. Fe красный железняк (руда гематит Fe2O3) магнитный железняк (руда магнетит Fe3O4) бурый железняк (руда гидрогетит НFeO2·nH2O)
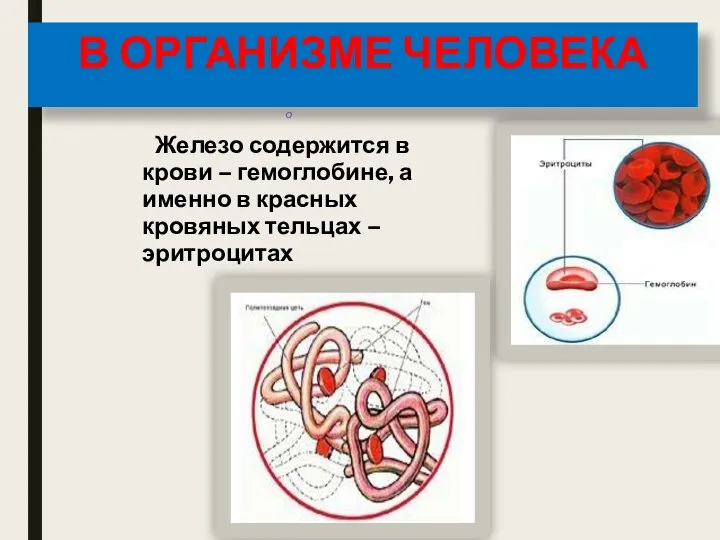
- 8. Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах о В
- 9. В растениях Железо влияет на процесс фотосинтеза.
- 10. II. Как простое вещество. Железо в истории В истории железо известно очень давно, из него изготовляли
- 11. В военной промышленности (производство военной техники)
- 12. В быту человека Железо-основа всей современной цивилизации
- 13. ФИЗИЧЕСКИЕ СЫВОЙСТВА - металлический блеск; - сравнительно мягкий ; - ковкий ; -серебристо-серый; - температура плавления
- 14. ЗАПОМНИТЕ!!! 1. Железо — активный металл. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3Fe
- 15. Взаимодействие с простыми веществами: 1. Горит в кислороде 3 Fe + 2 O2 = Fe3 O4
- 16. Взаимодействие со сложными веществами. 4. Реагирует с растворами солей. (Железо вытесняет из растворов солей металлы, находящиеся
- 17. 6. с кислотами: А)С соляной и разбавленной серной кислотами с образованием солей железа(II): Fe + 2HCl
- 18. Химические свойства 7.Соединения железа (III) в растворах восстанавливаются металлическим железом: Fe + 2FeCl3 = 3FeCl2
- 19. 1. Fе3О4 + 4СО =3Fе + 4СО2 2. FеО + Н2 = Fе + Н2О 3.Fе2О3
- 21. Скачать презентацию
















 Эти удивительные сталактиты
Эти удивительные сталактиты Презентация по Химии "Очистка воды в домашних условиях как жизненная необходимость" - скачать смотреть
Презентация по Химии "Очистка воды в домашних условиях как жизненная необходимость" - скачать смотреть  Минералогия. Силикаты
Минералогия. Силикаты №6. Электрофильное замещение в ароматических соединениях.
№6. Электрофильное замещение в ароматических соединениях.  Строение атома
Строение атома Нітрати – токсичні речовини
Нітрати – токсичні речовини  Природа активності та кислотності цеолітних каталізаторів
Природа активності та кислотності цеолітних каталізаторів Жидкокристаллические полимеры
Жидкокристаллические полимеры Альдегіди. Номенклатура альдегідів
Альдегіди. Номенклатура альдегідів Однолучевой спектрофотометр
Однолучевой спектрофотометр Дәрілік препараттардың синтезі мен олардың классификациясы
Дәрілік препараттардың синтезі мен олардың классификациясы Физические свойства оксида углерода
Физические свойства оксида углерода Аттестационная работа. Проект по химии: «Определение качества кисломолочных продуктов на примере сметаны»
Аттестационная работа. Проект по химии: «Определение качества кисломолочных продуктов на примере сметаны» Биохимия центральной нервной системы
Биохимия центральной нервной системы Біогеохімічні цикли та їх еволюція
Біогеохімічні цикли та їх еволюція Презентация на тему «Металлы и сплавы в моей профессии. Антикоррозийные покрытия»
Презентация на тему «Металлы и сплавы в моей профессии. Антикоррозийные покрытия»  Решение задач по уравнениям химических реакций
Решение задач по уравнениям химических реакций Инструментальные методы анализа
Инструментальные методы анализа Технология переработки полимеров
Технология переработки полимеров Обозначения химического состава и пищевой ценности продовольственных товаров
Обозначения химического состава и пищевой ценности продовольственных товаров Азот в природе
Азот в природе Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти
Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти  Теоретичні основи локалізації та ліквідації пожеж. Визначення витрати вогнегасних речовин для гасіння пожеж
Теоретичні основи локалізації та ліквідації пожеж. Визначення витрати вогнегасних речовин для гасіння пожеж Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Химический элемент медь
Химический элемент медь Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика Система твердое-твердое. Лекция 19
Система твердое-твердое. Лекция 19