Содержание
- 2. Фармацевтическая промышленность вызов Инновационный результат Появление новых препаратов подвержено увеличению времени на клиническую разработку. Повысился интерес
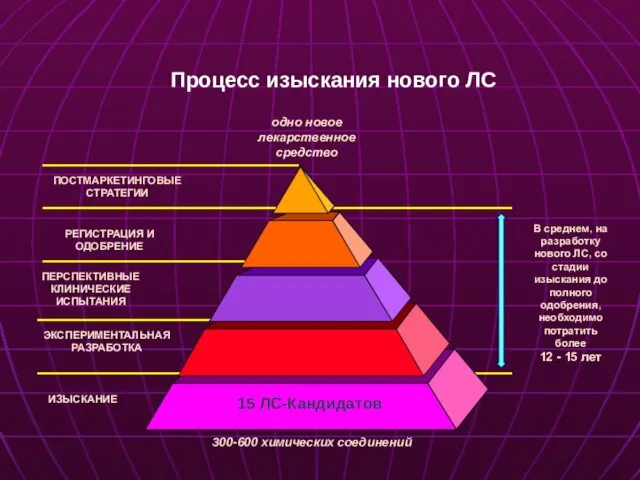
- 3. ЭКСПЕРИМЕНТАЛЬНАЯ РАЗРАБОТКА ПОСТМАРКЕТИНГОВЫЕ СТРАТЕГИИ В среднем, на разработку нового ЛС, со стадии изыскания до полного одобрения,
- 4. Клиническое испытание – любое систематическое изучение ЛП на человеке (на пациентах или здоровых добровольцах) в целях
- 5. Что такое клиническое испытание? Цель клинического испытания заключается в: определении терапевтической пользы путем демонстрации … безопасности,
- 6. Клинические испытания обеспечивают достаточную информацию, которая базируется на … Клинической фармакологии Биодоступность Фармакокинетика фармакодинамика Показания Противопоказания
- 7. восемь шагов клинического испытания Оценка и передача доклинических данных Разработка протокола и исследования Определение подходящих исследователей
- 8. Хорошая практика клинических исследований Этические принципы, на которых основано GCP Нюрнбергский Кодекс Хельсинская декларация Бельмонтский Отчет
- 9. Хельсинская Декларация является наиболее известным политическим заявлением Всемирной Медицинской Ассоциации. Первоначально принятая в 1964, пять раз
- 10. Хельсинская Декларация, права испытуемых Испытуемыми должны быть добровольцы Должно уважаться право на защиту собственной безопасности Испытуемые
- 11. Бельмонтский отчет, 1974 (Belmont Report) В 1974г. Национальный комитет США по защите прав участников биомедицинских и
- 12. В 1977 году FDA предложила правила, определяющие обязанности исследователей и спонсоров, которые вскоре были внедрены в
- 13. Гармонизация GCP Международная конференция по гармонизации технических требований к регистрации лекарственных препаратов для человека - ICH
- 14. Основными членами ICH являются: Комиссия ЕС – Европейский Союз (EU); Европейская федерация ассоциаций фармацевтической промышленности (EFPIA);
- 15. Good Clinical Practice (GCP) Надлежащая клиническая практика - стандарт планирования, проведения, выполнения, мониторинга, аудита и документального
- 16. GCP ICH : Введение 1. Терминология 2. Принципы GCP 3. Экспертный совет/Этический комитет 4. Исследователь 5.
- 17. Принципы ICH GCP 1. КИ следует проводить в соответствии с этическими принципами Хельсинской декларации, правилами GCP
- 18. Принципы ICH GCP 3. Права, безопасность и благополучие испытуемых важнее интересов науки и общества. 4. Данные
- 19. Клинический протокол Всегда следует помнить … “в хорошо контролируемых условиях люди делают то, что они должны
- 21. Скачать презентацию

















 Инфекция. Типы инфекционных болезней
Инфекция. Типы инфекционных болезней Виды реабилитации детей с ДЦП. Методики лечения детского церебрального паралича. Специфика гидрореабилитации
Виды реабилитации детей с ДЦП. Методики лечения детского церебрального паралича. Специфика гидрореабилитации Массаж ребёнка от 3 до 6 месяцев жизни
Массаж ребёнка от 3 до 6 месяцев жизни Кома диабетическая гиперосмолярная
Кома диабетическая гиперосмолярная диетотерапия при заболеваниях печени
диетотерапия при заболеваниях печени Повреждение клеток и тканей (альтерация)
Повреждение клеток и тканей (альтерация) АРИЗ. Методы активизации поиска решений нестандартных задач
АРИЗ. Методы активизации поиска решений нестандартных задач Аспекты информационного метаболизма. Принципы построения модели А в соционике
Аспекты информационного метаболизма. Принципы построения модели А в соционике Инфузионная терапия у нейрохирургических больных
Инфузионная терапия у нейрохирургических больных Термические ожоги
Термические ожоги Бөлме ауасының химиялық және бактериялық ластануын гигиеналық бағалау
Бөлме ауасының химиялық және бактериялық ластануын гигиеналық бағалау Нейроциркуляторная дистония
Нейроциркуляторная дистония Причины и факторы, приводящие к нарушениям в развитии во время и после родов
Причины и факторы, приводящие к нарушениям в развитии во время и после родов Курсовая работа. Методы профилактики рака молочной железы
Курсовая работа. Методы профилактики рака молочной железы Хиджама. Капиллярное кровопускание
Хиджама. Капиллярное кровопускание Принципы интенсивной терапии и реанимации детей раннего возраста
Принципы интенсивной терапии и реанимации детей раннего возраста Этнологические исследования детства
Этнологические исследования детства Семейство пикорнавирусов ( Picornaviridae)
Семейство пикорнавирусов ( Picornaviridae) Презентация Искусство и наука массажных практик
Презентация Искусство и наука массажных практик Балалар стоматологиясындағы реминерализациялаушы терапия. Материалдардың құрамы мен қасиеті, шығарылу түрлері
Балалар стоматологиясындағы реминерализациялаушы терапия. Материалдардың құрамы мен қасиеті, шығарылу түрлері Болезни органов дыхания у детей
Болезни органов дыхания у детей Жанұямен танысқанда алған пікірлерді талдау
Жанұямен танысқанда алған пікірлерді талдау Физиология. Физиология возбудимых тканей. (Лекция 1)
Физиология. Физиология возбудимых тканей. (Лекция 1) Оказание первой медицинской помощи при ожогах
Оказание первой медицинской помощи при ожогах Профессионально-педагогическая направленность и педагогическое призвание учителя логопеда
Профессионально-педагогическая направленность и педагогическое призвание учителя логопеда Средства, влияющие на аппетит. Средства при гастрите
Средства, влияющие на аппетит. Средства при гастрите Психология развития. Возрастная психология, как отрасль психологии
Психология развития. Возрастная психология, как отрасль психологии Сложное подлежащее
Сложное подлежащее