Содержание
- 2. Q: КАК КЛЕТКИ ВРОЖДЕННОГО ИММУНИТЕТА ОТЛИЧАЮТ «СВОЕ» от «ЧУЖОЕ»?
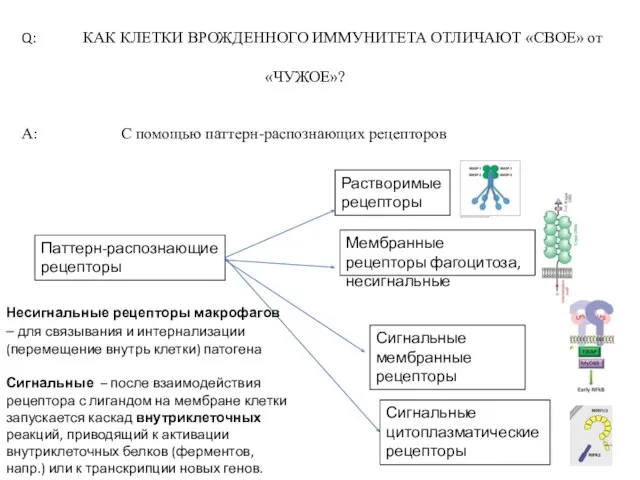
- 3. Q: КАК КЛЕТКИ ВРОЖДЕННОГО ИММУНИТЕТА ОТЛИЧАЮТ «СВОЕ» от «ЧУЖОЕ»? A: С помощью паттерн-распознающих рецепторов Растворимые рецепторы
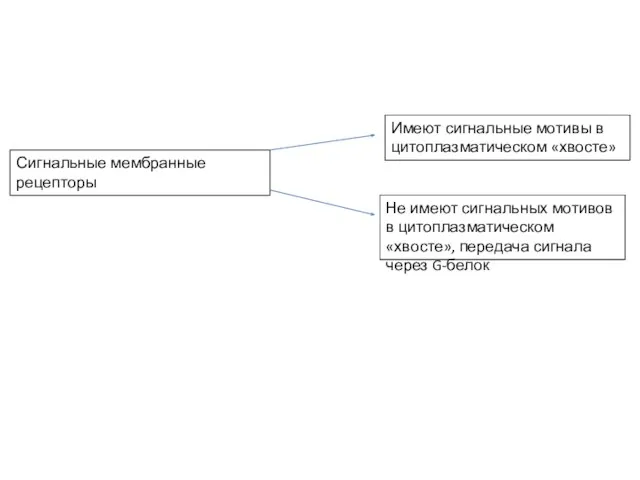
- 4. Сигнальные мембранные рецепторы Имеют сигнальные мотивы в цитоплазматическом «хвосте» Не имеют сигнальных мотивов в цитоплазматическом «хвосте»,
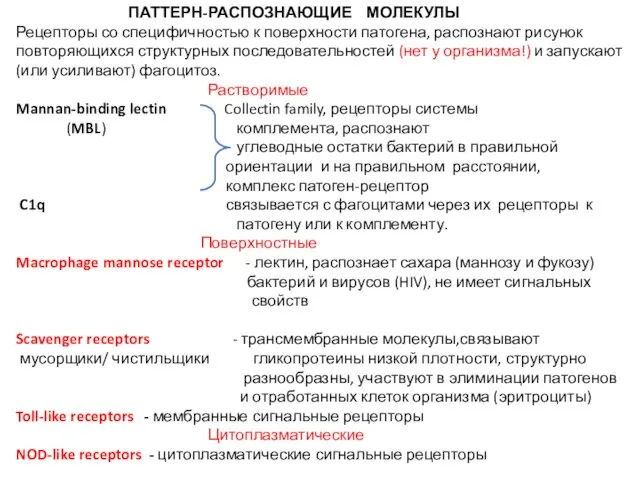
- 5. ПАТТЕРН-РАСПОЗНАЮЩИЕ МОЛЕКУЛЫ Рецепторы со специфичностью к поверхности патогена, распознают рисунок повторяющихся структурных последовательностей (нет у организма!)
- 6. Четыре типа паттерн-распознающих рецепторов: «Растворимые» рецепторы плазмы крови – белки системы комплемента, инициаторы активации этой системы
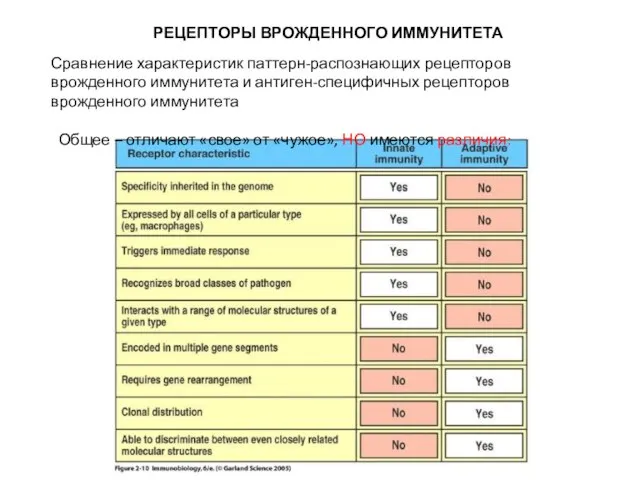
- 7. РЕЦЕПТОРЫ ВРОЖДЕННОГО ИММУНИТЕТА Сравнение характеристик паттерн-распознающих рецепторов врожденного иммунитета и антиген-специфичных рецепторов врожденного иммунитета Общее –
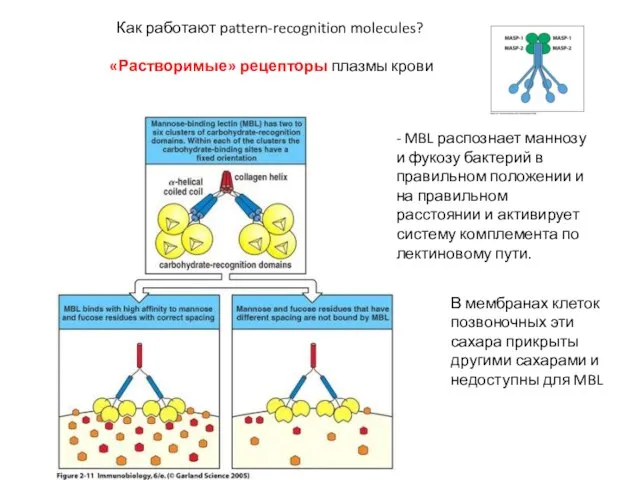
- 8. Как работают pattern-recognition molecules? «Растворимые» рецепторы плазмы крови - MBL распознает маннозу и фукозу бактерий в
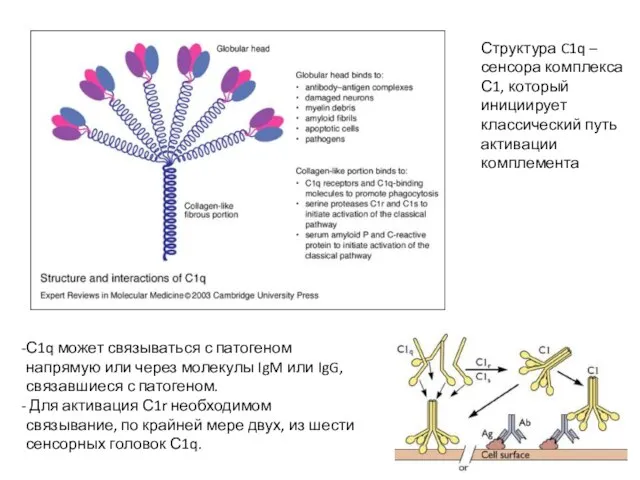
- 9. С1q может связываться с патогеном напрямую или через молекулы IgM или IgG, связавшиеся с патогеном. Для
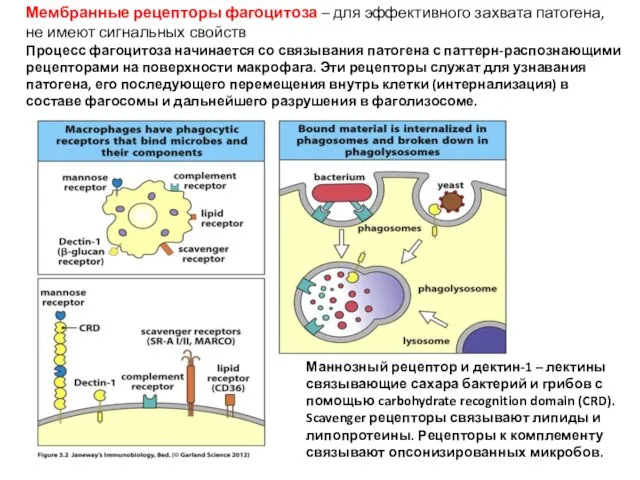
- 10. Мембранные рецепторы фагоцитоза – для эффективного захвата патогена, не имеют сигнальных свойств Процесс фагоцитоза начинается со
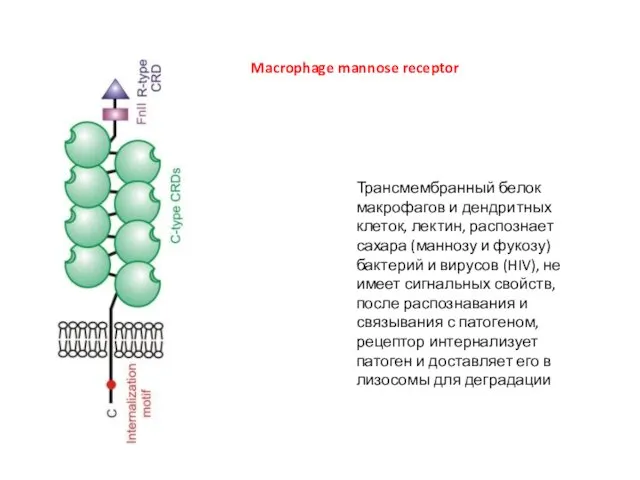
- 11. Macrophage mannose receptor Трансмембранный белок макрофагов и дендритных клеток, лектин, распознает сахара (маннозу и фукозу) бактерий
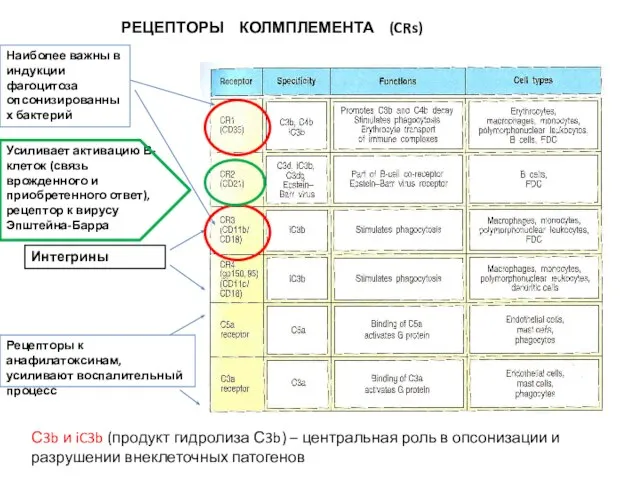
- 12. РЕЦЕПТОРЫ КОЛМПЛЕМЕНТА (CRs) Усиливает активацию В-клеток (связь врожденного и приобретенного ответ), рецептор к вирусу Эпштейна-Барра Рецепторы
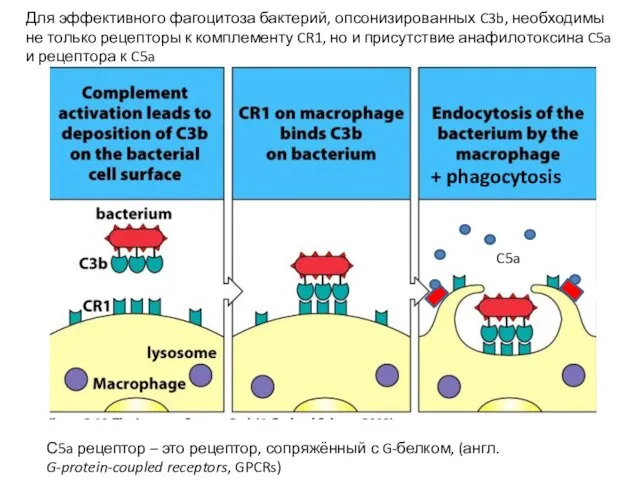
- 13. C5a Для эффективного фагоцитоза бактерий, опсонизированных C3b, необходимы не только рецепторы к комплементу CR1, но и
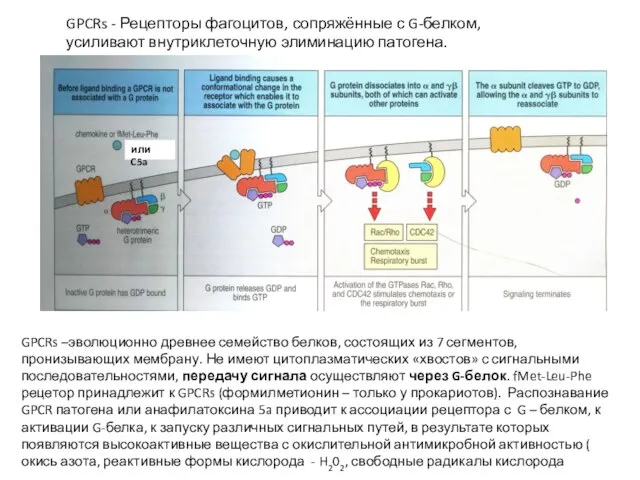
- 14. GPCRs - Рецепторы фагоцитов, сопряжённые с G-белком, усиливают внутриклеточную элиминацию патогена. GPCRs –эволюционно древнее семейство белков,
- 15. Toll-like receptors (mammals) Семейство рецепторов, эволюционно древнее, консервативное, появилось до разделения животных и растений. У Dr.melanogaster
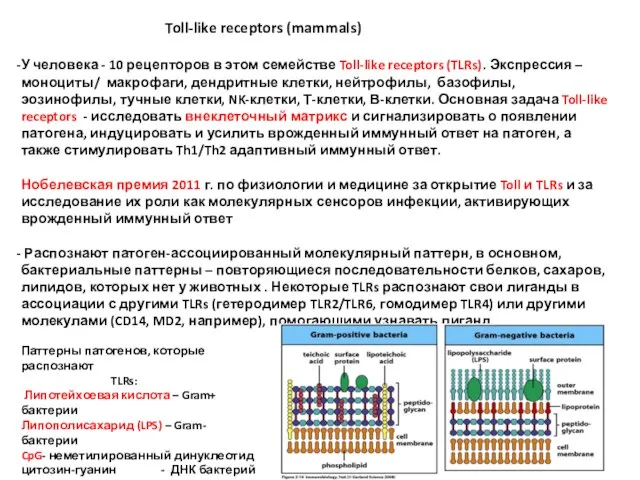
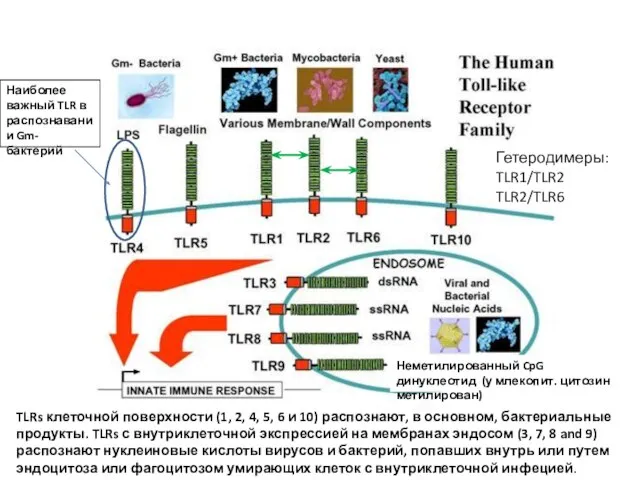
- 16. Toll-like receptors (mammals) У человека - 10 рецепторов в этом семействе Toll-like receptors (TLRs). Экспрессия –
- 17. TLRs клеточной поверхности (1, 2, 4, 5, 6 и 10) распознают, в основном, бактериальные продукты. TLRs
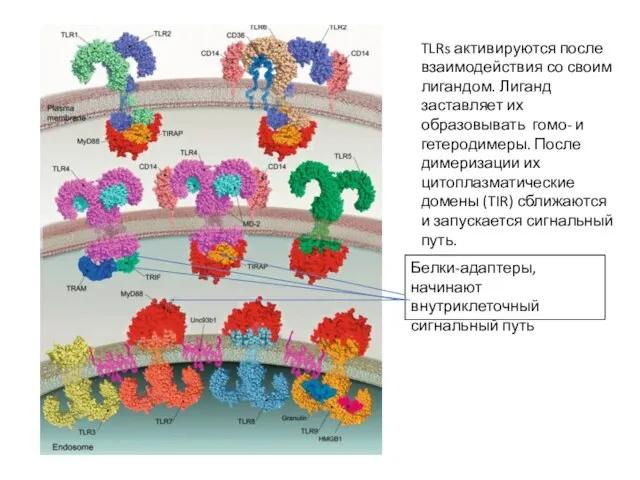
- 18. TLRs активируются после взаимодействия со своим лигандом. Лиганд заставляет их образовывать гомо- и гетеродимеры. После димеризации
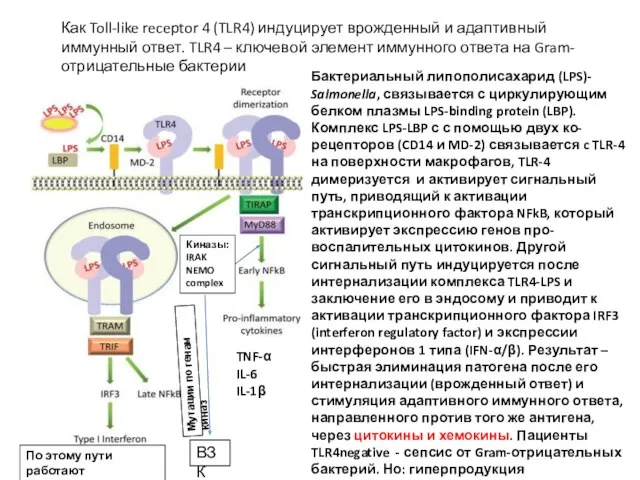
- 19. Бактериальный липополисахарид (LPS)- Salmonella, связывается с циркулирующим белком плазмы LPS-binding protein (LBP). Комплекс LPS-LBP с с
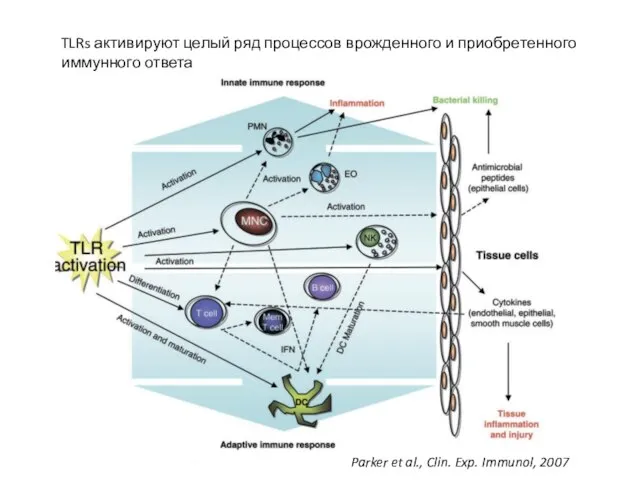
- 20. TLRs активируют целый ряд процессов врожденного и приобретенного иммунного ответа Parker et al., Clin. Exp. Immunol,
- 21. Цитоплазматические сигнальные рецепторы NOD-like receptors (NLRs) Цитоплазматические сенсоры микробных продуктов, очень древнее семейство врожденного иммунитета, гомологи
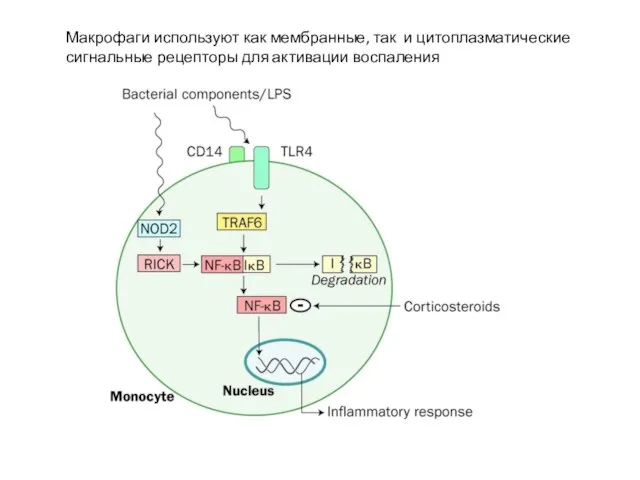
- 22. Макрофаги используют как мембранные, так и цитоплазматические сигнальные рецепторы для активации воспаления
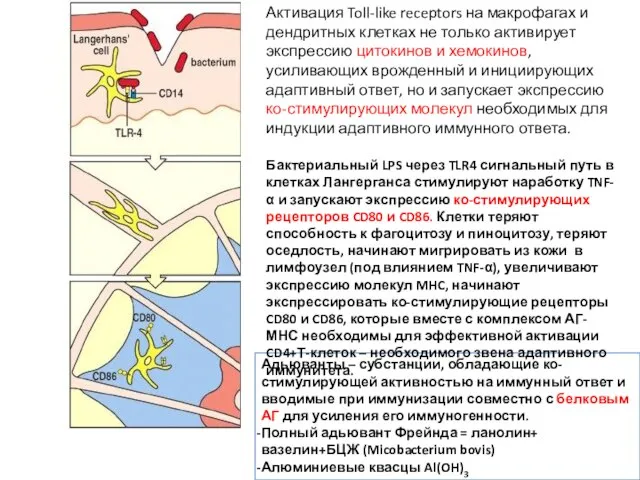
- 23. Адьюванты – субстанции, обладающие ко-стимулирующей активностью на иммунный ответ и вводимые при иммунизации совместно с белковым
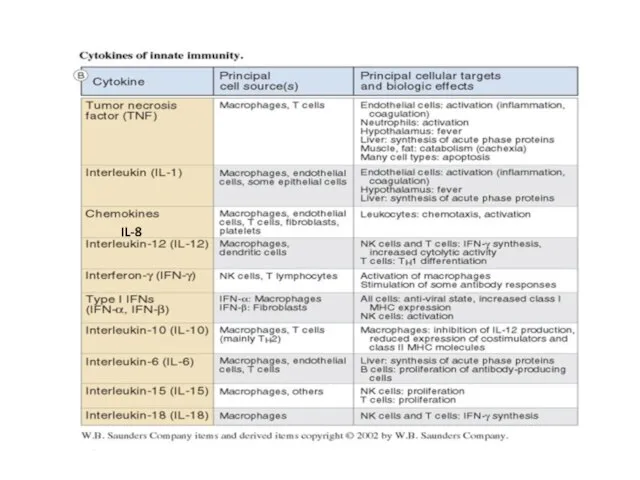
- 24. Макрофаги и дендритные клетки, активированные через TLRs и другие рецепторы к патогену, секретируют целый ряд цитокинов,
- 25. IL-8
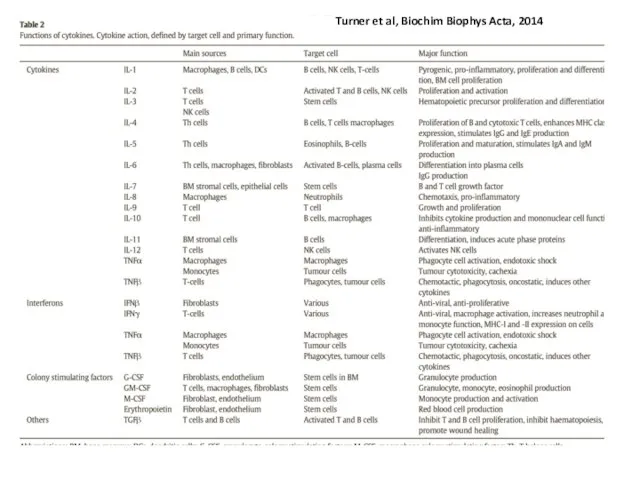
- 26. Turner et al, Biochim Biophys Acta, 2014
- 27. ФУНКЦИИ ХЕМОКИНОВ Хемокины, секретируемые фагоцитами, рекрутируют клетки (моноциты, нейтрофилы, дендритные клетки, а также лимфоциты) из крови
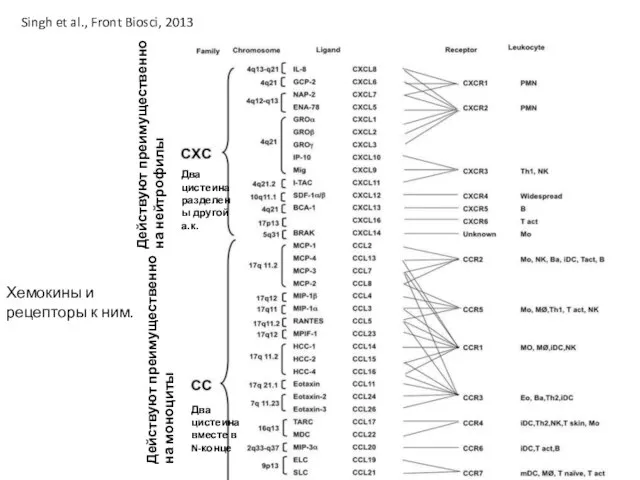
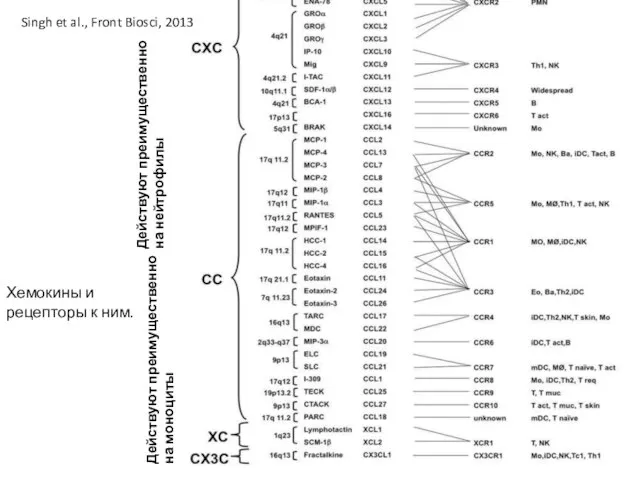
- 28. Хемокины и рецепторы к ним. Singh et al., Front Biosci, 2013 Действуют преимущественно на моноциты Действуют
- 29. Хемокины и рецепторы к ним. Singh et al., Front Biosci, 2013 Действуют преимущественно на моноциты Действуют
- 30. КАК ПРОИСХОДИТ МИГРАЦИЯ КЛЕТОК ИЗ КРОВИ В МЕСТА ВОСПАЛЕНИЯ? КАК ЛЕЙКОЦИТЫ УЗНАЮТ МЕСТА, ГДЕ ИМ МОЖНО
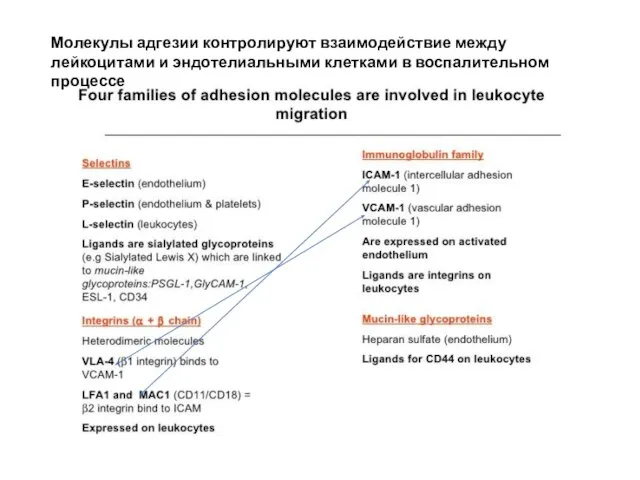
- 31. Молекулы адгезии контролируют взаимодействие между лейкоцитами и эндотелиальными клетками в воспалительном процессе
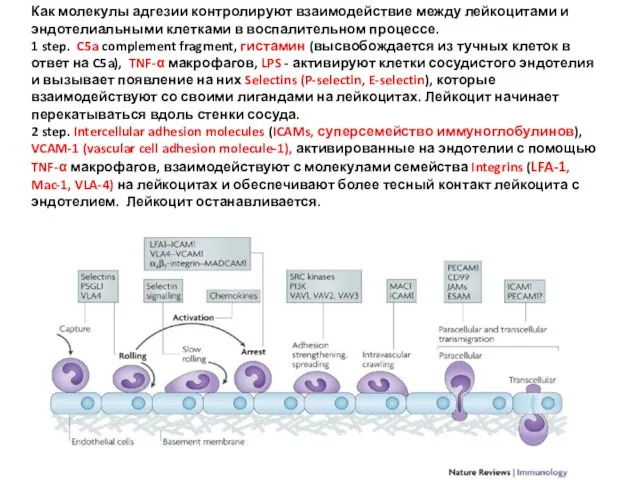
- 32. Как молекулы адгезии контролируют взаимодействие между лейкоцитами и эндотелиальными клетками в воспалительном процессе. 1 step. C5a
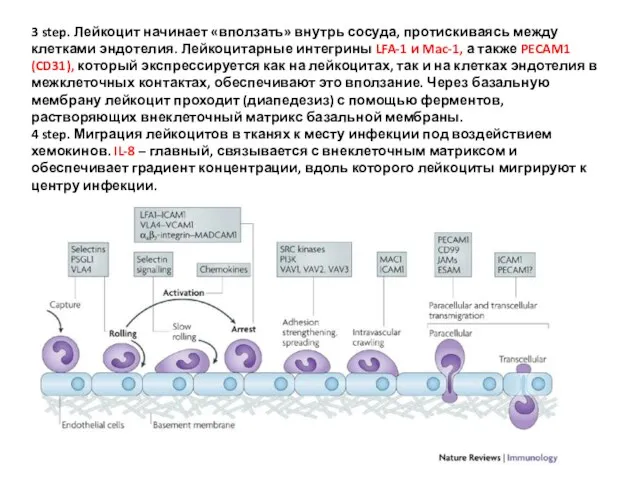
- 33. 3 step. Лейкоцит начинает «вползать» внутрь сосуда, протискиваясь между клетками эндотелия. Лейкоцитарные интегрины LFA-1 и Mac-1,
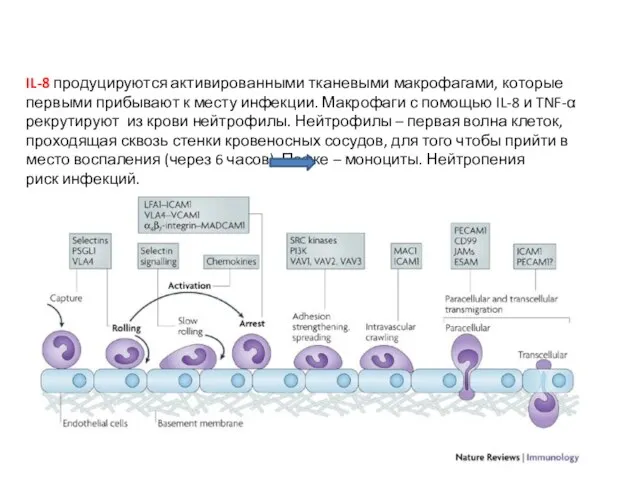
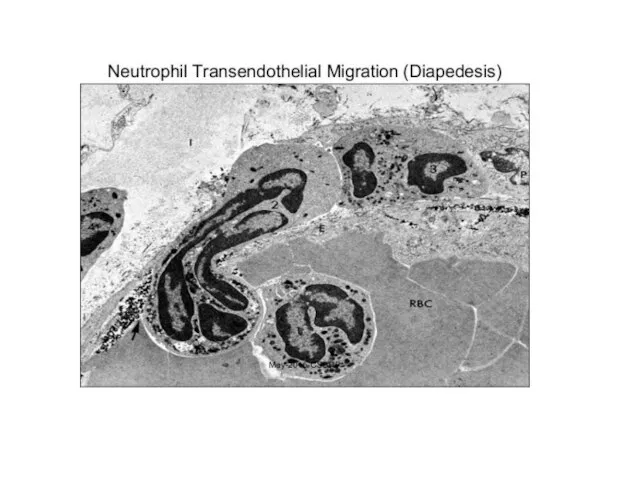
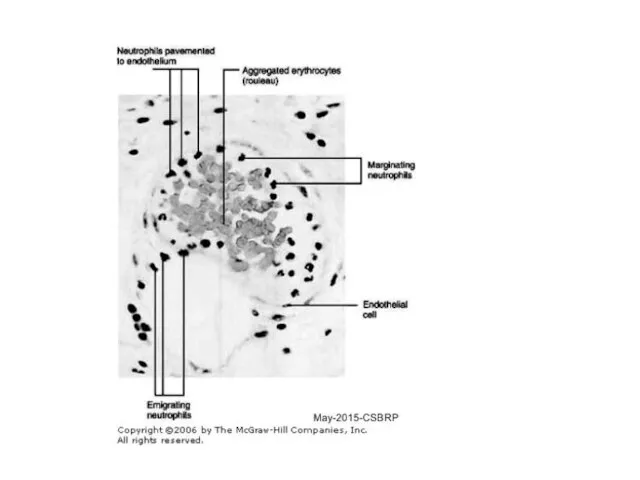
- 34. IL-8 продуцируются активированными тканевыми макрофагами, которые первыми прибывают к месту инфекции. Макрофаги с помощью IL-8 и
- 37. Может ли врожденный иммунный ответ бороться с вирусными инфекциями?
- 38. Интерфероны – антивирусные белки, продуцируемые клеткой в ответ на вирусную инфекцию (инфицированной клеткой или неинфицированной) и
- 39. Какие клетки продуцируют IFN-α и IFN-β? Любой тип клеток может продуцировать IFN-α и IFN-β, но особенно
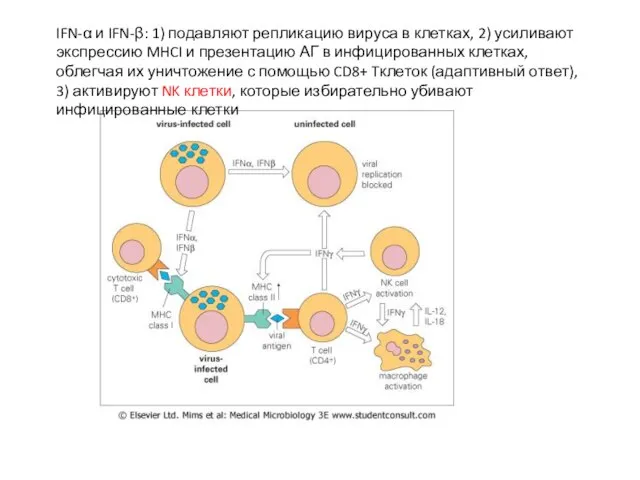
- 40. IFN-α и IFN-β: 1) подавляют репликацию вируса в клетках, 2) усиливают экспрессию MHCI и презентацию АГ
- 41. NK cells – естественные киллеры. - Лимфоидного происхождения, циркулируют в крови, составляют 10% (5%-30%) от лимфоцитов
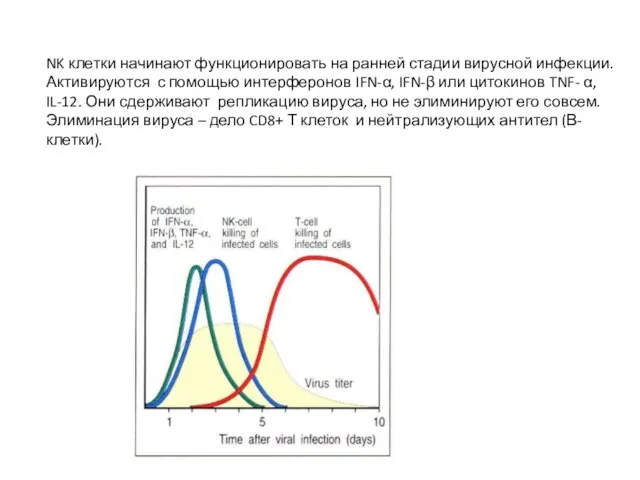
- 42. NK клетки начинают функционировать на ранней стадии вирусной инфекции. Активируются с помощью интерферонов IFN-α, IFN-β или
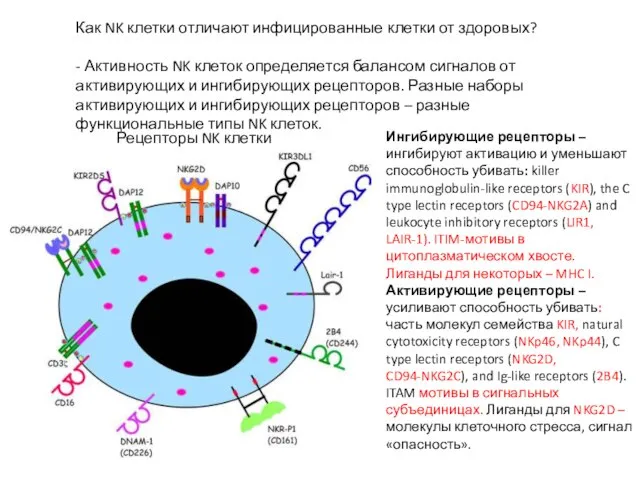
- 43. Рецепторы NK клетки Как NK клетки отличают инфицированные клетки от здоровых? - Активность NK клеток определяется
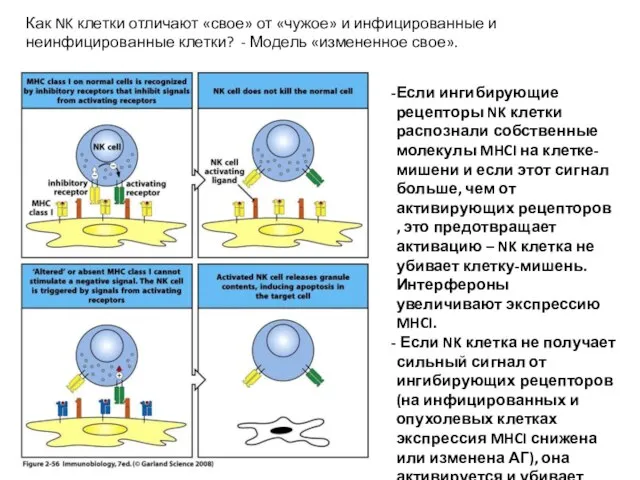
- 44. Как NK клетки отличают «свое» от «чужое» и инфицированные и неинфицированные клетки? - Модель «измененное свое».
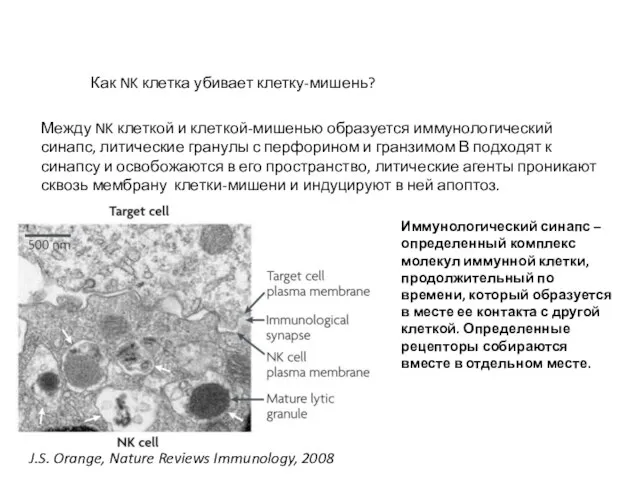
- 45. J.S. Orange, Nature Reviews Immunology, 2008 Между NK клеткой и клеткой-мишенью образуется иммунологический синапс, литические гранулы
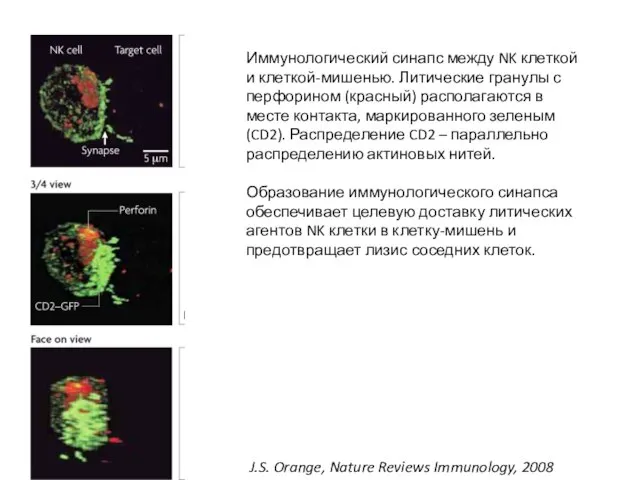
- 46. J.S. Orange, Nature Reviews Immunology, 2008 Иммунологический синапс между NK клеткой и клеткой-мишенью. Литические гранулы с
- 47. ɣδT клетки, B1 клетки и natural antibodies – промежуточное звено между адаптивным и врожденным иммунитетом Рецепторам
- 49. Скачать презентацию












 Тепловой и солнечный удар
Тепловой и солнечный удар Диагностика и лечение варикозной болезни вен нижних конечностей
Диагностика и лечение варикозной болезни вен нижних конечностей Судебная медицина. Организация судебномедицинской службы
Судебная медицина. Организация судебномедицинской службы Методы иследования систем и органов у детей
Методы иследования систем и органов у детей Рецепты естественной жизни: питание
Рецепты естественной жизни: питание Околочелюстные абсцессы и флегмоны
Околочелюстные абсцессы и флегмоны Оказание паллиативной медицинской помощи, в части назначения, выписки и обеспечения обезболивающими средствами
Оказание паллиативной медицинской помощи, в части назначения, выписки и обеспечения обезболивающими средствами Lichidul cefalorahidian (fluidul cerobrospinal)
Lichidul cefalorahidian (fluidul cerobrospinal) Компьютерная томография
Компьютерная томография Формы ЛВД, ассоциированные с двигательными расстройствами
Формы ЛВД, ассоциированные с двигательными расстройствами Исследование маркеров эффективности трансляции в постуральной мышце человека в условиях 3 - суточной женской иммерсии
Исследование маркеров эффективности трансляции в постуральной мышце человека в условиях 3 - суточной женской иммерсии Адъювантная терапия рака молочной железы
Адъювантная терапия рака молочной железы Перелом верхней челюсти. Классификация, клиника, диагностика. Лечение
Перелом верхней челюсти. Классификация, клиника, диагностика. Лечение Нормальная и патологическая гистология лимфоидных тканей
Нормальная и патологическая гистология лимфоидных тканей Дифференциальный диагноз при аритмиях. Клиническая и ЭКГ-диагностика. Принципы лечения и неотложная помощь
Дифференциальный диагноз при аритмиях. Клиническая и ЭКГ-диагностика. Принципы лечения и неотложная помощь Использование современных технологий в работе воспитателей и логопедов ДОУ: игровой самомассаж
Использование современных технологий в работе воспитателей и логопедов ДОУ: игровой самомассаж پرستاري_بهداشت_مادران_و_نوزادان
پرستاري_بهداشت_مادران_و_نوزادان Клиническая и лабораторноинструментальная диагностика диффузного токсического зоба. Тиреотоксический криз
Клиническая и лабораторноинструментальная диагностика диффузного токсического зоба. Тиреотоксический криз Особенности первичной позитивной профилактики аддиктивного поведения в образовательных учреждениях
Особенности первичной позитивной профилактики аддиктивного поведения в образовательных учреждениях Несеп тас ауруы. Несепағар, қуық және зәр шығару арнасының тастары
Несеп тас ауруы. Несепағар, қуық және зәр шығару арнасының тастары Формы опухоли
Формы опухоли Аутоиммунная гемолитическая анемия
Аутоиммунная гемолитическая анемия СПИД Подари себе жизнь
СПИД Подари себе жизнь Судебная медицина
Судебная медицина Санитарно-гигиеническая оценка мяса, мясных продуктов и рыбы
Санитарно-гигиеническая оценка мяса, мясных продуктов и рыбы Психотропное вещество как элемент оружия
Психотропное вещество как элемент оружия Халықтың радиациялық қауіпсіздігін қамтамасыз ету мен қоршаған ортаны радиоактивті ластанулардан қорғау бойынша
Халықтың радиациялық қауіпсіздігін қамтамасыз ету мен қоршаған ортаны радиоактивті ластанулардан қорғау бойынша Бір жасқа дейінгі дені сау балалардың диспансерлік бақылау, патронаж
Бір жасқа дейінгі дені сау балалардың диспансерлік бақылау, патронаж