- Главная
- Медицина
- Общая и неорганическая химия. Лекция. Р-элементы III-IV групп (бор, алюминий, углерод)

Содержание
Слайд 2
Общая характеристика р-элементов и их соединений.
Химические элементы, в атомах которых
Общая характеристика р-элементов и их соединений.
Химические элементы, в атомах которых
заполняются электронами р-подуровень внешнего уровня, называют р-элементами.
В периодах слева направо атомные и ионные радиусы р-элементов по мере увеличения заряда ядра уменьшаются, энергия ионизации и сродство к электрону в целом возрастают, электроотрицательность увеличивается, окислительная активность элементных веществ и неметаллические свойства усиливаются.
В группах радиусы атомов и однотипных ионов, в общем, увеличиваются. Энергия ионизации при переходе от 2р-элементов к 6р-элементам уменьшается, так как по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешним электронам.
С увеличением порядкового номера р-элемента в группе неметаллические свойства ослабевают, а металлические усиливаются.
В периодах слева направо атомные и ионные радиусы р-элементов по мере увеличения заряда ядра уменьшаются, энергия ионизации и сродство к электрону в целом возрастают, электроотрицательность увеличивается, окислительная активность элементных веществ и неметаллические свойства усиливаются.
В группах радиусы атомов и однотипных ионов, в общем, увеличиваются. Энергия ионизации при переходе от 2р-элементов к 6р-элементам уменьшается, так как по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешним электронам.
С увеличением порядкового номера р-элемента в группе неметаллические свойства ослабевают, а металлические усиливаются.
Слайд 3
III А-группа р-элементов и их соединения.
К IIIА-группе относятся бор, алюминий, галлий,
III А-группа р-элементов и их соединения.
К IIIА-группе относятся бор, алюминий, галлий,
индии, таллий (главная подгруппа). Они имеют электронную формулу ns2np1. Они являются значительно менее активными восстановителями, чем щелочноземельные металлы. Для них характерна степень окисления +3 и валентность III.
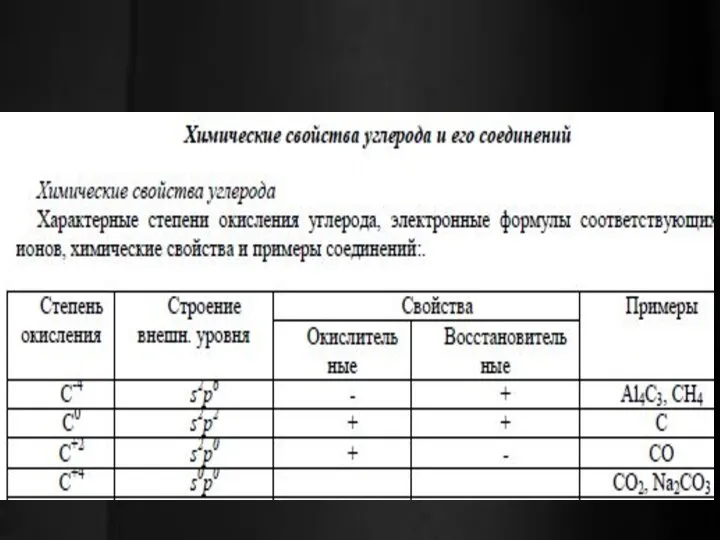
Для бора и алюминия характерны соединения только со степенью окисления +3. В группе сверху вниз возрастают металлические свойства элементов, увеличиваются восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства.
У элементов подгруппы галлия (галлий, индий, таллий) на внешнем электронном уровне также находится по 3 электрона, образуя конфигурацию s2р1, но они расположены после 18-электронного слоя. Поэтому в отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Ga, In, Тl ослабевают, а металлические свойства усиливаются.
Гидроксиды элементов IIIA-подгруппы малорастворимы в воде. Оксиды и гидроксиды алюминия и галлия проявляют амфотерные свойства. Гидроксид бора проявляет слабые кислотные свойства. В отличие от всех элементов для таллия характерна степень окисления +1.
Для бора и алюминия характерны соединения только со степенью окисления +3. В группе сверху вниз возрастают металлические свойства элементов, увеличиваются восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства.
У элементов подгруппы галлия (галлий, индий, таллий) на внешнем электронном уровне также находится по 3 электрона, образуя конфигурацию s2р1, но они расположены после 18-электронного слоя. Поэтому в отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Ga, In, Тl ослабевают, а металлические свойства усиливаются.
Гидроксиды элементов IIIA-подгруппы малорастворимы в воде. Оксиды и гидроксиды алюминия и галлия проявляют амфотерные свойства. Гидроксид бора проявляет слабые кислотные свойства. В отличие от всех элементов для таллия характерна степень окисления +1.
Слайд 4
Слайд 5
Слайд 6
Слайд 7
Слайд 8
Слайд 9
Слайд 10
Слайд 11
Слайд 12
Слайд 13
Слайд 14
Слайд 15
Слайд 16
Слайд 17
Слайд 18
Слайд 19
Слайд 20
Слайд 21
Слайд 22
Слайд 23
Слайд 24
Слайд 25
Слайд 26
- Предыдущая
Монтаж парящих натяжных потолковСледующая -
Временные пломбировочные материалы























 Физиология выделения. Физиология почек и водно-солевого обмена
Физиология выделения. Физиология почек и водно-солевого обмена Лечение аппендицита
Лечение аппендицита Врожденная пневмония
Врожденная пневмония Терминальные состояния. Принципы реанимации. Постреанимационная болезнь. Методы интенсивной терапии
Терминальные состояния. Принципы реанимации. Постреанимационная болезнь. Методы интенсивной терапии Инфаркт миокарда. Причины инфаркта
Инфаркт миокарда. Причины инфаркта Травматические повреждения нижней челюсти: классификация, клиническая картина, диагностика
Травматические повреждения нижней челюсти: классификация, клиническая картина, диагностика Вирусқа қарсы препараттар. Ауыз қуысының вирусты аурулары және оны емдеу
Вирусқа қарсы препараттар. Ауыз қуысының вирусты аурулары және оны емдеу Инфекционный процесс у детей. ОРВИ
Инфекционный процесс у детей. ОРВИ Введение. Современные представления об антибиотиках. Классификация антибиотиков
Введение. Современные представления об антибиотиках. Классификация антибиотиков Валеология, как наука. Критерии формирования, сохранения и укрепления здоровья
Валеология, как наука. Критерии формирования, сохранения и укрепления здоровья Физиотерапия в стоматологии
Физиотерапия в стоматологии Вирусные заболевания человека
Вирусные заболевания человека Информирование во время пандемии детей и родителей
Информирование во время пандемии детей и родителей Повреждения и заболевания прямой кишки
Повреждения и заболевания прямой кишки Ifeanyi merit chioma\dharavath baskar
Ifeanyi merit chioma\dharavath baskar Профилактика новой коронавирусной инфекции
Профилактика новой коронавирусной инфекции Заболевания печени
Заболевания печени Реанимация и интенсивная терапия при травматическом, геморрагическом, анафилактическом и инфекционно-токсическом шоке
Реанимация и интенсивная терапия при травматическом, геморрагическом, анафилактическом и инфекционно-токсическом шоке Сана бұзылысының ұзақтығы мен тереңдігі бас ми жарақатта және ми қан айналымының жедел
Сана бұзылысының ұзақтығы мен тереңдігі бас ми жарақатта және ми қан айналымының жедел Лечебная физическая культура
Лечебная физическая культура Что такое ремоделирование и как этот процесс влияет на приживление имплантов
Что такое ремоделирование и как этот процесс влияет на приживление имплантов Психологическое консультирование при работе с семьями детей с ЗПРР
Психологическое консультирование при работе с семьями детей с ЗПРР Использование виртуальной реальности у детей с нарушениями осанки при синдроме гипермобильности суставов
Использование виртуальной реальности у детей с нарушениями осанки при синдроме гипермобильности суставов Магнитная гипертермия. Применение локальных физических воздействий в биомедицинских нанотехнолонгиях
Магнитная гипертермия. Применение локальных физических воздействий в биомедицинских нанотехнолонгиях Жүктіліктің үзілу қаупі терапиясы
Жүктіліктің үзілу қаупі терапиясы Гигиена дыхания
Гигиена дыхания Бабезіоз великої рогатої худоби
Бабезіоз великої рогатої худоби Проблемы женщин, злоупотребляющих вредными привычками во время беременности и после
Проблемы женщин, злоупотребляющих вредными привычками во время беременности и после