Содержание
- 2. ПЛАН: Общая характеристика фармакопеи. Краткая история процесса создания фармакопей. Современные подходы к гармонизации фармакопей Характеристика фармакопей
- 3. ОБЩАЯ ХАРАКТЕРИСТИКА ФАРМАКОПЕИ Государственная фармакопея - свод общих фармакопейных статей и фармакопейных статей. Общая фармакопейная статья
- 4. КРАТКАЯ ИСТОРИЯ ПРОЦЕССА СОЗДАНИЯ ФАРМАКОПЕЙ Арабские сочинения (IX—XII вв.) «Ricettario Fiorentino». Флоренция. 1498 г. «Antidotarium Florentinum».
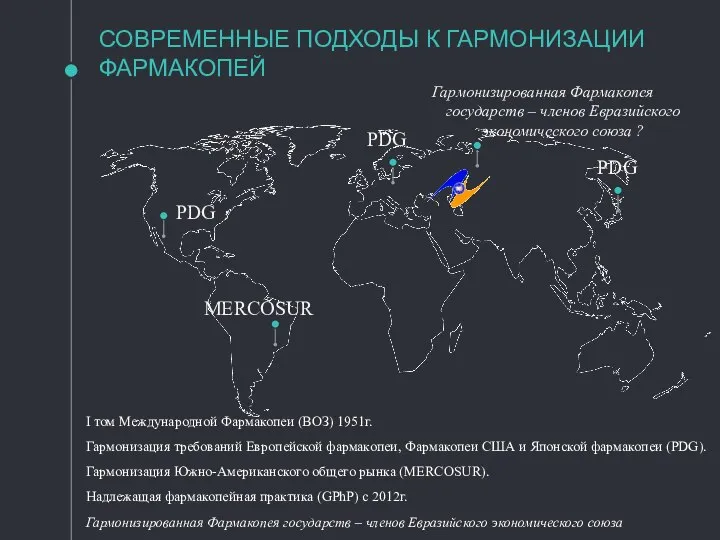
- 5. СОВРЕМЕННЫЕ ПОДХОДЫ К ГАРМОНИЗАЦИИ ФАРМАКОПЕЙ MERCOSUR PDG PDG PDG Гармонизированная Фармакопея государств – членов Евразийского экономического
- 6. Краткая характеристика фармакопей государств-членов ЕврАзЭс
- 7. КРАТКАЯ ХАРАКТЕРИСТИКА ГОСУДАРСТВЕННОЙ ФАРМАКОПЕИ РОССИЙСКОЙ ФЕДЕРАЦИИ Российская Федерация Государственная фармакопея РФ XII издания в большинстве случаев
- 8. «Современная отечественная система стандартизации должна быть ориентирована на опыт развитых стран мира. Это подразумевает гармонизацию …
- 9. КРАТКАЯ ХАРАКТЕРИСТИКА ФАРМАКОПЕЙ РЕСПУБЛИКИ БЕЛАРУСЬ И РЕСПУБЛИКИ КАЗАХСТАН Республика Беларусь и Республика Казахстан Структура большинства их
- 10. КРАТКАЯ ХАРАКТЕРИСТИКА НОРМАТИВНОЙ БАЗЫ РЕСПУБЛИКИ АРМЕНИЯ И КЫРГЫЗСКОЙ РЕСПУБЛИКИ Государственные Фармакопеи Республик в настоящий момент не
- 11. ПЕРСПЕКТИВЫ ПРИНЯТИЯ ЕДИНОЙ ФАРМАКОПЕИ ЕВРАЗИЙСКОГО ЭКОНОМИЧЕСКОГО СОЮЗА непрерывная разработка и обновление гармонизированных фармакопейных статей (монографий); дальнейшее
- 12. ПРОБЛЕМЫ ПРИ ГАРМОНИЗАЦИИ (ВОЗНИКШИЕ И ПОТЕНЦИАЛЬНЫЕ) различия в требованиях статей/монографий национальных фармакопей; недостаточный охват лекарственных средств;
- 13. ИТОГИ Республика Беларусь Республика Казахстан Российская Федерация 1. СООТВЕТСТВИЕ ГОСУДАРСТВЕННЫХ ФАРМАКОПЕЙ GMP и ТРЕБОВАНИЯМИ ЗАРУБЕЖНЫХ ФАРМАКОПЕЙ
- 14. 3. В НАИБОЛЬШЕЙ ОПАСНОСТИ В СЛОЖИВШЕЙСЯ СИТУАЦИИ НАХОДИТСЯ РЫНОК ЛЕКАРСТВЕННЫХ СРЕДСТВ РЕСПУБЛИКИ АРМЕНИЯ И КЫРГЫЗСКОЙ РЕСПУБЛИКИ,
- 15. ИТОГИ НЕОБХОДИМОСТЬ И ЦЕЛЕСООБРАЗНОСТЬ ИЗДАНИЯ ГАРМОНИЗИРОВАННОЙ ФАРМАКОПЕИ ЕВРАЗИЙСКОГО ЭКОНОМИЧЕСКОГО СОЮЗА, ПОСЛЕДУЮЩЕГО ЕЕ ОБНОВЛЕНИЯ И ВЗАИМОДЕЙСТВИЯ ГОСУДАРСТВ-ЧЛЕНОВ
- 17. Скачать презентацию













 Методические рекомендации по проведению всероссийской олимпиады школьников по информатике в 2020/21 учебном году
Методические рекомендации по проведению всероссийской олимпиады школьников по информатике в 2020/21 учебном году Развивающая предметно-пространственная среда дошкольного образовательного учреждения в условиях реализации ФГОС
Развивающая предметно-пространственная среда дошкольного образовательного учреждения в условиях реализации ФГОС ГУАП. Институт технологий предпринимательства. (Экономический факультет)
ГУАП. Институт технологий предпринимательства. (Экономический факультет) Детская музыкальная школа №1
Детская музыкальная школа №1 Научное исследование как разновидность творческой деятельности. (Лекция 2)
Научное исследование как разновидность творческой деятельности. (Лекция 2) Готовимся к сдаче предпрофессионального экзамена - 2022
Готовимся к сдаче предпрофессионального экзамена - 2022 Самозанятость как перспективный вариант трудоустройства выпускника
Самозанятость как перспективный вариант трудоустройства выпускника Космический факультет. Системы автоматического управления
Космический факультет. Системы автоматического управления Universities in the Altai Krai
Universities in the Altai Krai Аттестационная работа. Программа элективного курса. Технология карьеры
Аттестационная работа. Программа элективного курса. Технология карьеры Аттестационная работа. Компьютер и здоровье
Аттестационная работа. Компьютер и здоровье День российской науки
День российской науки Экзаменационный билет №3. Квалификационный экзамен на присвоение рабочей профессии Бармен
Экзаменационный билет №3. Квалификационный экзамен на присвоение рабочей профессии Бармен Наука и культура Беларуси во второй половине XIX века
Наука и культура Беларуси во второй половине XIX века Правила оформления дипломной работы
Правила оформления дипломной работы Роль дополнительного образования в развитии и воспитании ребенка, его социальных потребностей
Роль дополнительного образования в развитии и воспитании ребенка, его социальных потребностей Мечта и реальность. Алгоритм работы над сочинением
Мечта и реальность. Алгоритм работы над сочинением Установка на рефлексию сессии и сборку результатов работы групп
Установка на рефлексию сессии и сборку результатов работы групп Всероссийский День библиотек
Всероссийский День библиотек Coursera. Проект в помощь обучающимся
Coursera. Проект в помощь обучающимся Аттестационная работа. Проектная деятельность в начальной школе
Аттестационная работа. Проектная деятельность в начальной школе Аттестационная работа. Планирование работы школы в области исследовательской/проектной деятельности
Аттестационная работа. Планирование работы школы в области исследовательской/проектной деятельности День финансиста. Выбираем профессию
День финансиста. Выбираем профессию Аттестационная работа. Методическая разработка по выполнению исследовательской работы младших школьников
Аттестационная работа. Методическая разработка по выполнению исследовательской работы младших школьников УМК Школа России
УМК Школа России Орал қаласы білім беру бөлімінің
Орал қаласы білім беру бөлімінің Изменения в стипендиальных выплатах за 2016-2017 г
Изменения в стипендиальных выплатах за 2016-2017 г Введение в дистанционные образовательные технологии
Введение в дистанционные образовательные технологии