Содержание
- 2. Классификация масс-спектрометров По способу регистрации: масс-спектроскоп – регистрация при помощи осциллографа; масс- спектрограф – регистрация на
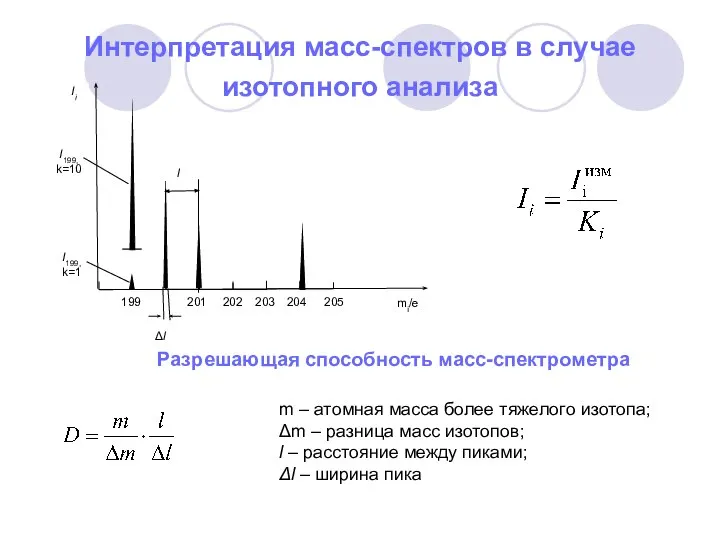
- 3. Интерпретация масс-спектров в случае изотопного анализа Разрешающая способность масс-спектрометра m – атомная масса более тяжелого изотопа;
- 4. Изотопный анализ по пикам атомарных ионов Метод часто используется для определения разрешающей способности масс-спектрометра. Ртуть имеет
- 5. Изотопный анализ по пикам молекулярных ионов Молекула содержит один атом определяемого элемента. Квазиатомарный случай Для многоатомных
- 6. Пример 2. Определить изотопный состав углерода, используя аналитическую форму СО. Массовые числа 12СО и 13СО равны
- 7. Можно ли наблюдать раздельно масс-спектрометрические пики 12С17 О и 13С16О? масса электрона: me = 5,485799⋅10-4 а.е.м.
- 8. Двухатомные молекулы В молекуле содержится два стабильных изотопа Пример: Изотопный анализ азота по ионам N2+: У
- 9. Если для атомов азота справедливо равновероятностное распределение, для определения содержания изотопа достаточно измерять два пика вместо
- 10. В молекуле содержится более двух стабильных изотопов Пример: Изотопный анализ кислорода по ионам О2+: В природе
- 11. При равновероятностном распределении изотопов расчет можно провести по трем пикам I32, I33, I34. Обозначим [18 O]=u,
- 12. Многоатомные молекулы При изотопном анализе многоатомных молекул, число измерений ионных токов всегда больше числа изотопов элемента
- 14. Скачать презентацию










 Текстильные волокна. Свойства и классификация волокон
Текстильные волокна. Свойства и классификация волокон Храмы Сампурского района
Храмы Сампурского района театр и мы Microsoft PowerPoint
театр и мы Microsoft PowerPoint Закономерности развития психики детей с соматическими заболеваниями
Закономерности развития психики детей с соматическими заболеваниями Христианская философия
Христианская философия 20151014_prez
20151014_prez Дана - консультант по продуктовым характеристикам табачной компании JTI
Дана - консультант по продуктовым характеристикам табачной компании JTI Проектирование асинхронного трехфазного двигателя с короткозамкнутым ротором
Проектирование асинхронного трехфазного двигателя с короткозамкнутым ротором Конструкционные углеродистые стали
Конструкционные углеродистые стали Оценка пылегазовых выбросов электросталеплавильного производства
Оценка пылегазовых выбросов электросталеплавильного производства Условия изучения дисциплины Conditions for studying the discipline:
Условия изучения дисциплины Conditions for studying the discipline: Информатизация правовой деятельности
Информатизация правовой деятельности Почему самолеты летают? Основные части самолета
Почему самолеты летают? Основные части самолета Birthday Pary
Birthday Pary Промышленная архитектура – архитектурная деятельность в области промышленного строительства
Промышленная архитектура – архитектурная деятельность в области промышленного строительства Цели применения МУН. Методы увеличения нефтеотдачи
Цели применения МУН. Методы увеличения нефтеотдачи Selected item from A-OK2022-8-17
Selected item from A-OK2022-8-17 ООО Элвест. Комплексные решения задач энергетики
ООО Элвест. Комплексные решения задач энергетики Соматосенсорный анализатор (кожная и болевая рецепция). Нейрофизиология боли. Анализаторы вкуса и обоняния
Соматосенсорный анализатор (кожная и болевая рецепция). Нейрофизиология боли. Анализаторы вкуса и обоняния Микроконтроллеры и аппаратно-программное средство для построения простых систем автоматики и мехатроники
Микроконтроллеры и аппаратно-программное средство для построения простых систем автоматики и мехатроники Система охлаждения
Система охлаждения Знай правду – живи трезво!
Знай правду – живи трезво! От Империи к Республике
От Империи к Республике Мотивация
Мотивация Характеристики насосных цехов нефтеперекачивающей станции
Характеристики насосных цехов нефтеперекачивающей станции Контроль технологии сварки. Конструкторская и производственно-технологическая документация по сварке
Контроль технологии сварки. Конструкторская и производственно-технологическая документация по сварке Фонтанная и механизированная добыча нефти
Фонтанная и механизированная добыча нефти задание 2
задание 2