Содержание
- 2. Жесткость воды Наличие в воде растворенных солей кальция и магния придает ей свойство, называемое жесткостью воды.
- 3. Карбонатная (временная) жесткость. Образуется при растворении в воде бикарбонатов кальция и магния – Са(HCO3)2 и Mg(HCO3)2.При
- 4. Жесткость воды может быть уменьшена с помощью обработки гашеной известью Са(OH)2 и кальцинированной содой Na2CO3. Известь
- 5. Заключительная стадия подготовки воды, связанная с изменением ее ионного состава, вплоть до полного удаления растворенных примесей,
- 6. Ионный обмен Катионный обмен Анионный обмен Na + H + Cl - OH- Регенерация NaCl НCl
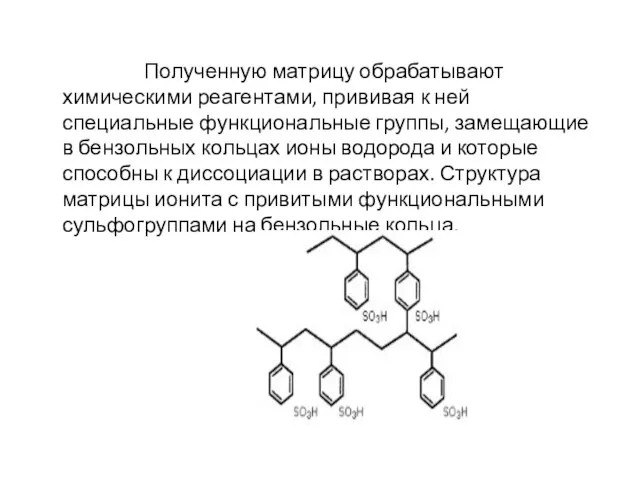
- 7. Полученную матрицу обрабатывают химическими реагентами, прививая к ней специальные функциональные группы, замещающие в бензольных кольцах ионы
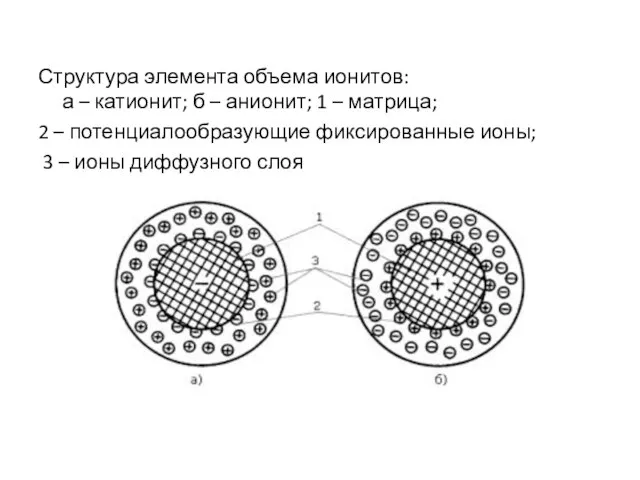
- 8. Структура элемента объема ионитов: а – катионит; б – анионит; 1 – матрица; 2 – потенциалообразующие
- 9. Типичная реакция катионного обмена записывается как: 2КNa + Са 2+ + 2Cl- = R2Ca + 2Na+
- 10. Обратимость процессов обмена ионов позволяет многократно использовать дорогостоящие иониты в технологии обработки вод. После замены катионов
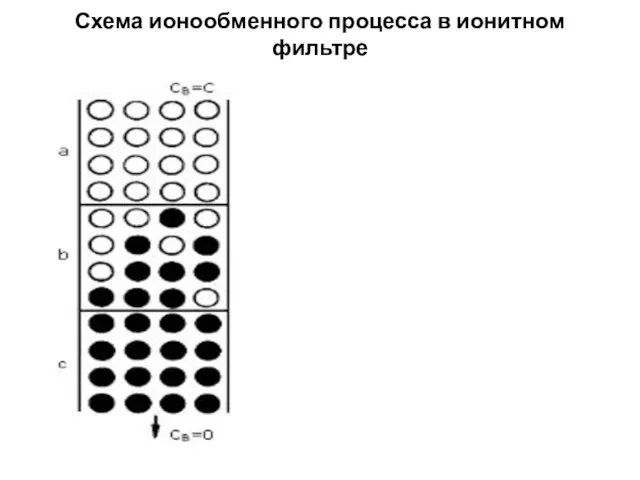
- 11. Схема ионообменного процесса в ионитном фильтре
- 12. При пропуске раствора, содержащего ионы B, через ионит, первоначально насыщенный ионами A, протекая, раствор будет постоянно
- 13. Технологические характеристики ионитов К физическим свойствам ионитов относятся: грануметрический состав (размер зерен), насыпная масса, механическая прочность,
- 14. Крупность зерен промышленных ионитов находится в пределах от 0.3 до 1.5 мм, при этом по данным
- 15. Механическая прочность и осмотическая стабильность зерен ионита влияет на потери материала в течение его эксплуатации. Годовой
- 16. При работе ионитных фильтров фильтрование прекращается обычно в момент, когда концентрация поглощаемого иона в обработанном растворе
- 17. Регенерация 8 – 10% р-ром NaCl ( max =26%) KCa + NaCl = KNa + CaCl
- 20. Скачать презентацию














 С Новым Годом!
С Новым Годом! Занятие №84 - Пространственные рисунки танца
Занятие №84 - Пространственные рисунки танца TUOM
TUOM О ком говорится в стихотворении?
О ком говорится в стихотворении? Planificarea liniei tehnologice de producere a articolelor din tricot pentru bărbaţi, conform produsului etalon
Planificarea liniei tehnologice de producere a articolelor din tricot pentru bărbaţi, conform produsului etalon доклад за первое полугодие1 2022
доклад за первое полугодие1 2022 fd-663ec72e
fd-663ec72e Технология замораживания рыбы
Технология замораживания рыбы Перзентация Свадьба 2019
Перзентация Свадьба 2019 Промышленность Свердловской области
Промышленность Свердловской области Письменные буквы русского алфавита
Письменные буквы русского алфавита Токопроводящие пластмассы
Токопроводящие пластмассы Наша планета Земля
Наша планета Земля Альтернатива живой ёлки, как символа нового года
Альтернатива живой ёлки, как символа нового года Гигиена жилища
Гигиена жилища Виды печати в рекламном деле
Виды печати в рекламном деле Проект команды ОДИН. Кофейные автоматы
Проект команды ОДИН. Кофейные автоматы Определение долевой нити
Определение долевой нити Что такое красота
Что такое красота Разработка мероприятий по ремонту вспомогательного тормоза условный №254 электровоза ВЛ10 в объеме КР
Разработка мероприятий по ремонту вспомогательного тормоза условный №254 электровоза ВЛ10 в объеме КР Полупроводниковые диоды
Полупроводниковые диоды О-07-НИПИ-2021-ОТР v15
О-07-НИПИ-2021-ОТР v15 Великая Пасха
Великая Пасха Планирование буровых работ
Планирование буровых работ Монтажные и обмоточные провода
Монтажные и обмоточные провода 20150120_prezentatsii_k_gia
20150120_prezentatsii_k_gia Искусственный интеллект и ЭВМ
Искусственный интеллект и ЭВМ Победа ковалась в тылу
Победа ковалась в тылу