Содержание
- 2. Энергия является консервативной величиной, которая не может создаваться или уничтожаться. Поэтому энергетический анализ может выявить лишь
- 3. Эксергия (Е) – это энергия, которая при участии окружающей среды может быть преобразована в любую другую
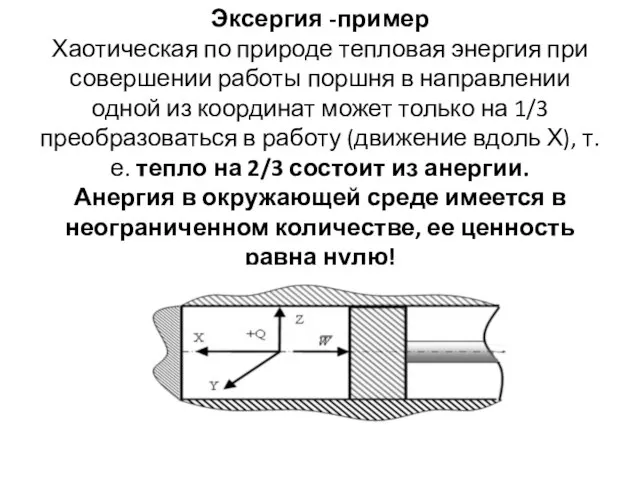
- 4. Эксергия -пример Хаотическая по природе тепловая энергия при совершении работы поршня в направлении одной из координат
- 5. На этом примере видно, что тепловая энергия согласно второму началу термодинамики не может быть полностью преобразована
- 6. Например, за окружающую среду может быть принята средняя годовая температура и давление, элементарные химические соединения -
- 7. В зависимости от природы элемента ХТС потери эксергии вычисляют по различным формулам. Например, потери эксергии (работоспособности)
- 8. Из этой формулы также следует, что Эксергия выражается тех же единицах, что и количество энергии. Общая
- 10. Скачать презентацию






 Горячее сердце
Горячее сердце С праздником 8 марта. Наши девочки
С праздником 8 марта. Наши девочки 28сад Реклама англ.яз
28сад Реклама англ.яз зож
зож Коммутаторы. Характеристики, влияющие на производительность коммутаторов
Коммутаторы. Характеристики, влияющие на производительность коммутаторов Компоненты принтера
Компоненты принтера Психология
Психология М.С. Башилов. Три поколения
М.С. Башилов. Три поколения Оборудование лесопильного производства
Оборудование лесопильного производства Дистанционное занятие Попади в цель
Дистанционное занятие Попади в цель Команда%20ЯДС%20слёт%20молодёжи%20ЦСС%202022
Команда%20ЯДС%20слёт%20молодёжи%20ЦСС%202022 Профессия писатель
Профессия писатель org
org Volgamed_Sravnitelnaya_kharakteristika_svobodnoradikalnogo_statusa_______pri_opukholyakh_na_raznykh
Volgamed_Sravnitelnaya_kharakteristika_svobodnoradikalnogo_statusa_______pri_opukholyakh_na_raznykh Кинематика
Кинематика Объявление для ТВ (образец)
Объявление для ТВ (образец) Псалом 1
Псалом 1 昆仑通态 Hi培训 初级教程 V3.2
昆仑通态 Hi培训 初级教程 V3.2 Управление и организация монтажа холодильного оборудования в супермаркете
Управление и организация монтажа холодильного оборудования в супермаркете ЧтоГдеКогда 1 апреля начальная школа
ЧтоГдеКогда 1 апреля начальная школа Организация движения поездов на железнодорожном транспорте. Порядок включения тормозов в поезде
Организация движения поездов на железнодорожном транспорте. Порядок включения тормозов в поезде Псалом 48. Слушайте меня все народы, внимайте мне все языки, все обитатели вселенной
Псалом 48. Слушайте меня все народы, внимайте мне все языки, все обитатели вселенной Устранение рисков ошибочного подключения вилки типа ШК 4х60 к розетке ШЩ 4х60
Устранение рисков ошибочного подключения вилки типа ШК 4х60 к розетке ШЩ 4х60 Sport ist mein Hobby
Sport ist mein Hobby хаксли
хаксли Минеральные вяжущие материалы и изделия
Минеральные вяжущие материалы и изделия Численное моделирование стержневых систем (лекция 1)
Численное моделирование стержневых систем (лекция 1) Волокна и ткани растительного происхождения
Волокна и ткани растительного происхождения