Содержание
- 2. БЕЛКИ = ПРОТЕИНЫ (от греч. protos – первый, главный)
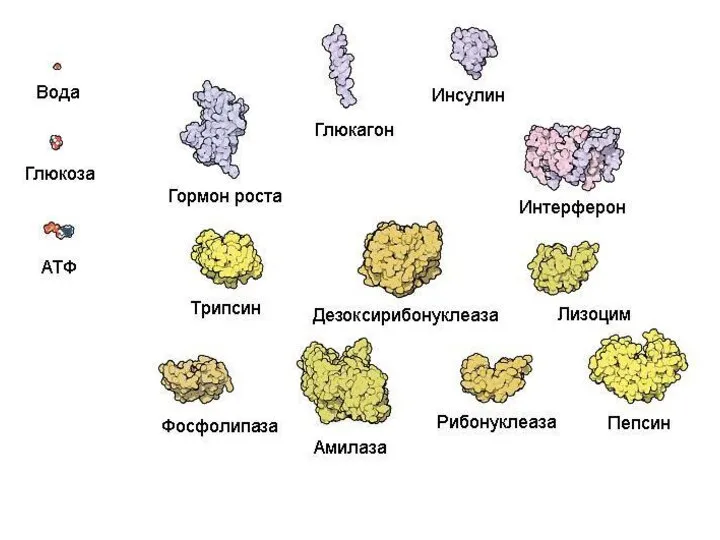
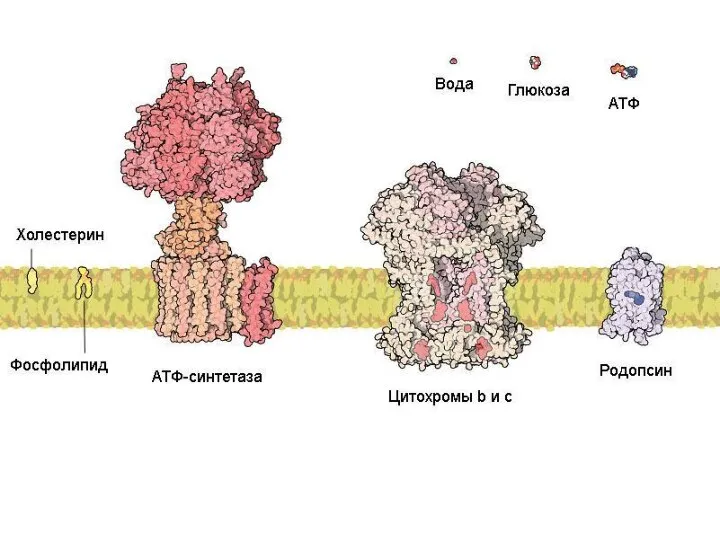
- 6. Животная клетка содержит около 10 миллиардов молекул белков (1010) примерно 10 тысяч видов
- 7. Белки – нерегулярные полимеры, мономерами которых являются аминокислоты Мономеры – 20 аминокислот неразветвленные
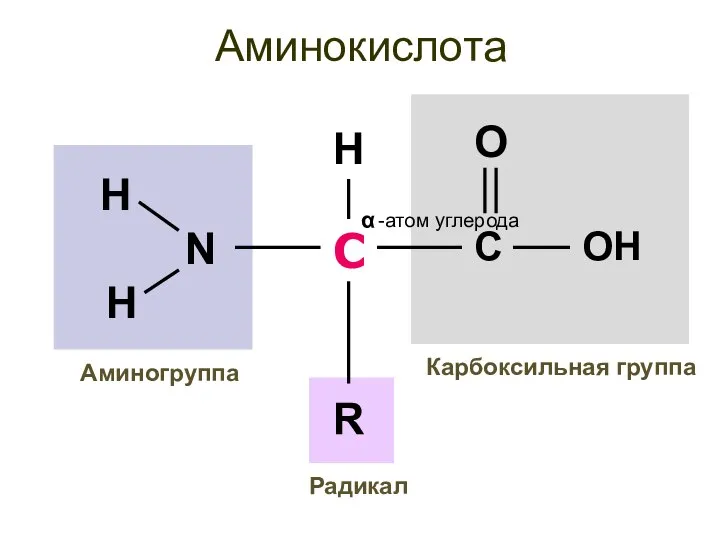
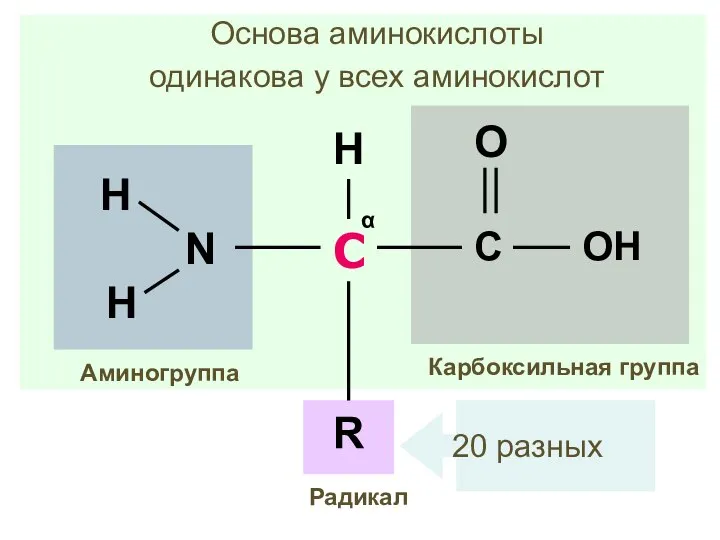
- 8. Аминокислота С -атом углерода α Карбоксильная группа Аминогруппа R H Радикал
- 9. С α Карбоксильная группа Аминогруппа R H Радикал Основа аминокислоты одинакова у всех аминокислот 20 разных
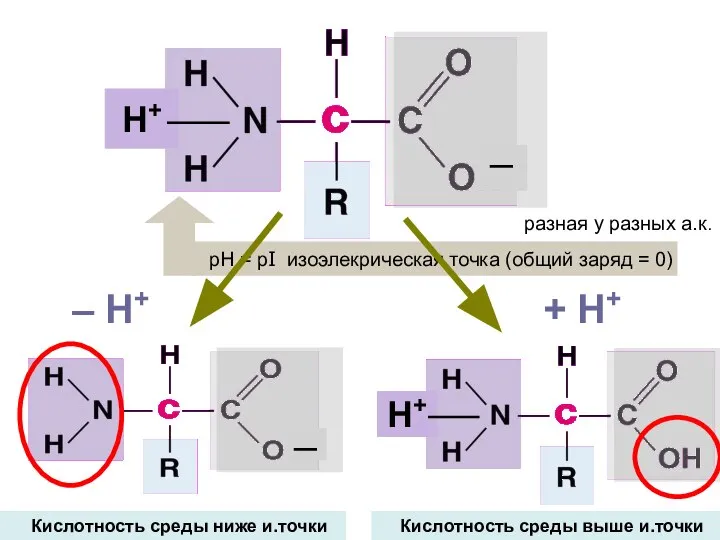
- 10. ─ Н+ разная у разных а.к. + H+ – H+ Кислотность среды выше и.точки Кислотность среды
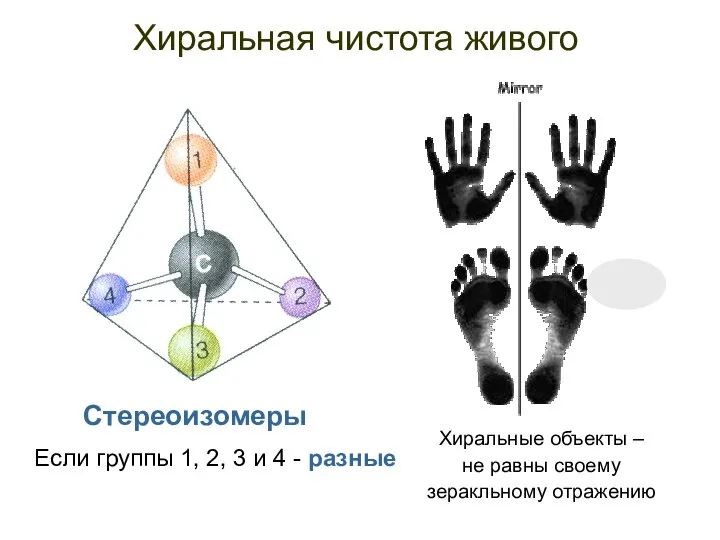
- 11. Хиральная чистота живого Если группы 1, 2, 3 и 4 - разные Хиральные объекты – не
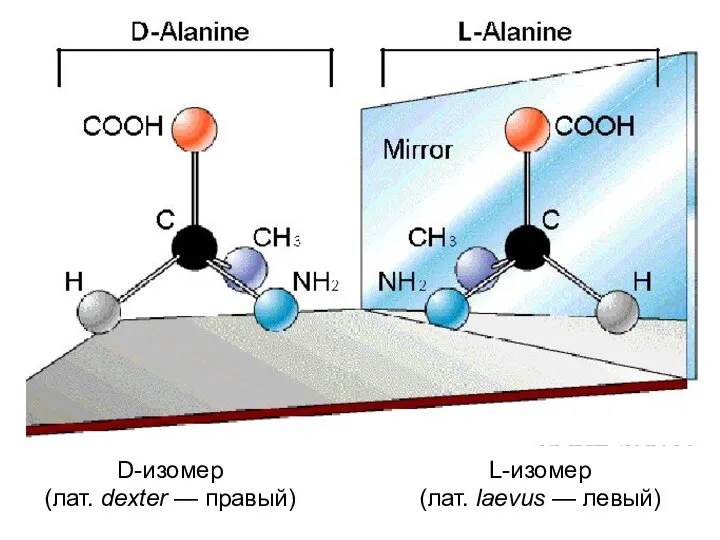
- 12. D-изомер (лат. dexter — правый) L-изомер (лат. laevus — левый)
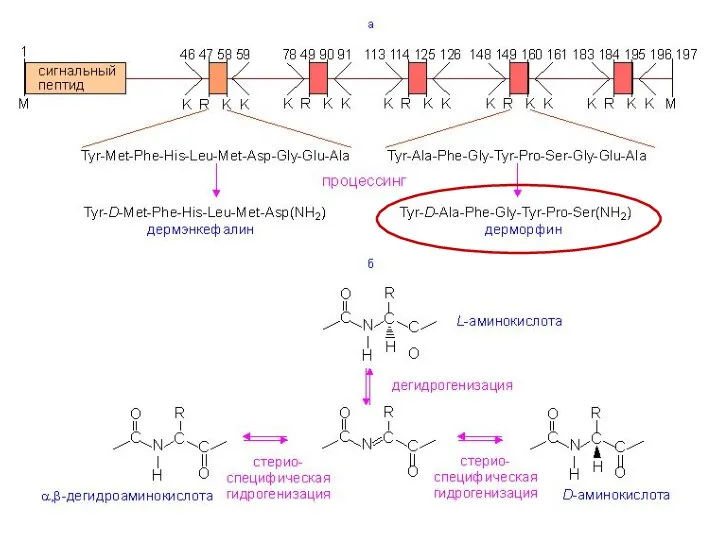
- 13. D-аминокислоты могут входить в состав некоторых коротких пептидов (особенно у бактерий) Эти пептиды синтезируются не на
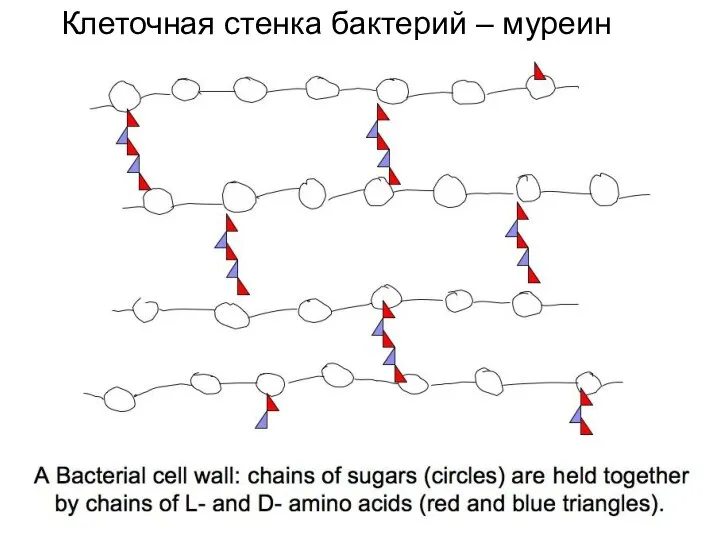
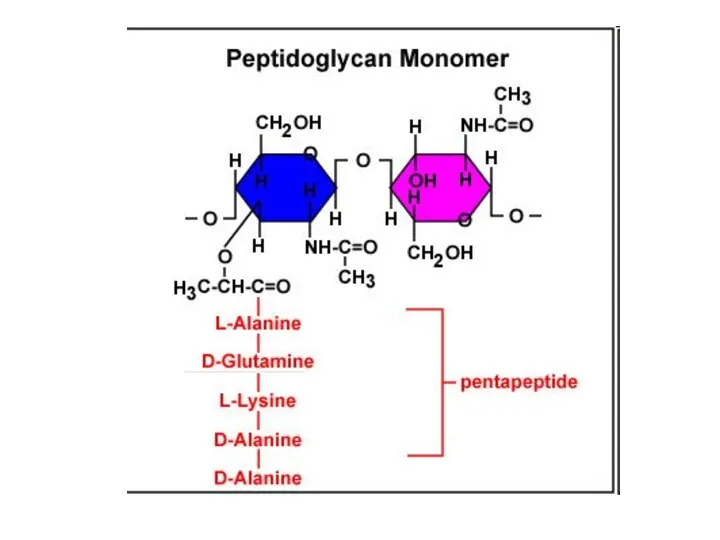
- 14. Клеточная стенка бактерий – муреин
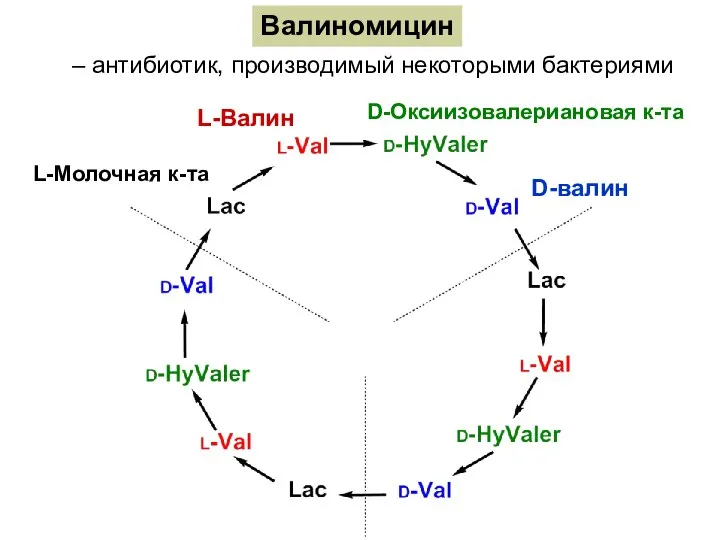
- 16. Валиномицин – антибиотик, производимый некоторыми бактериями
- 17. Tyr – D-Ala – Phe – Gly – Tyr – Pro – Ser-NH2 Дерморфин Пептид из
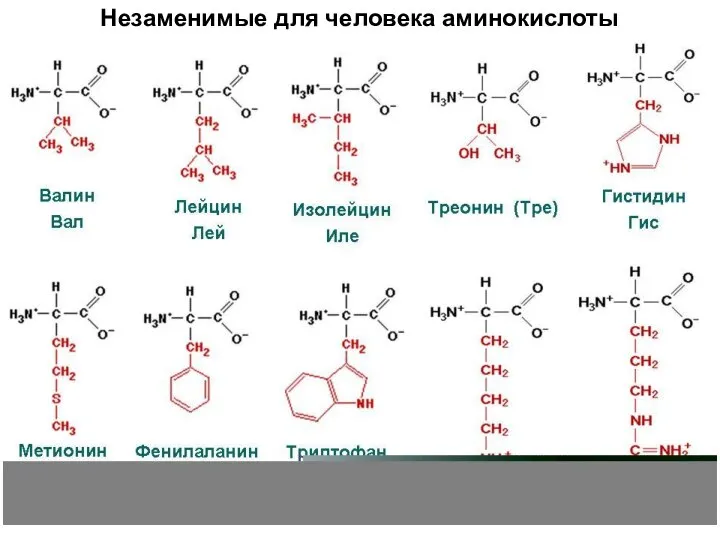
- 20. Незаменимые аминокислоты Организм не может синтезировать сам → должны поступать с пищей. Для человека это 10
- 21. Незаменимые для человека аминокислоты
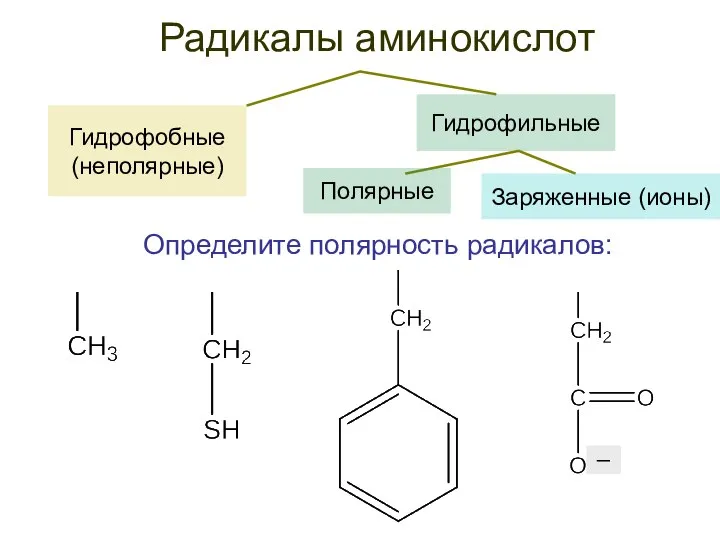
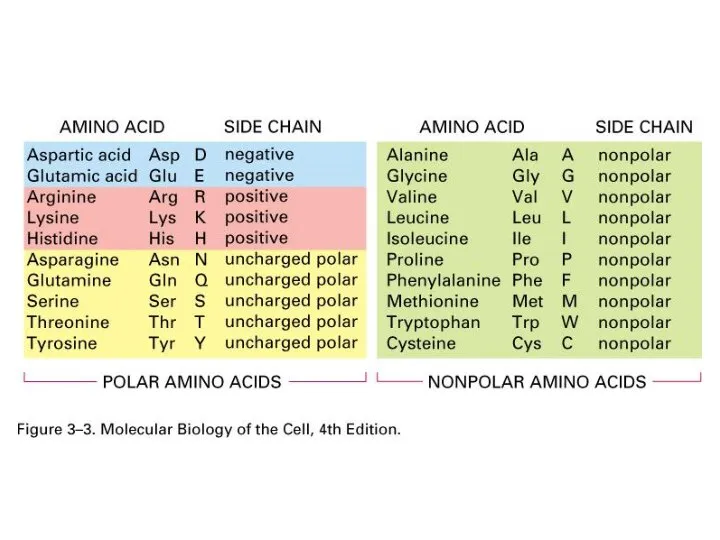
- 22. Гидрофобные (неполярные) Радикалы аминокислот Гидрофильные Определите полярность радикалов:
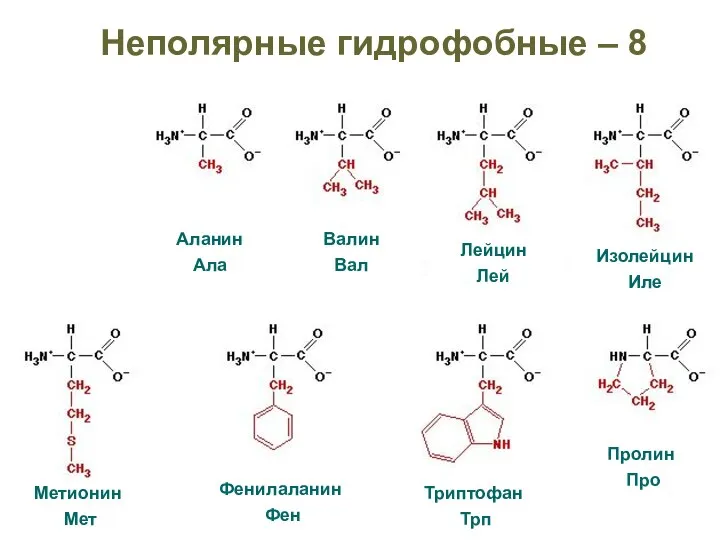
- 23. Неполярные гидрофобные – 8
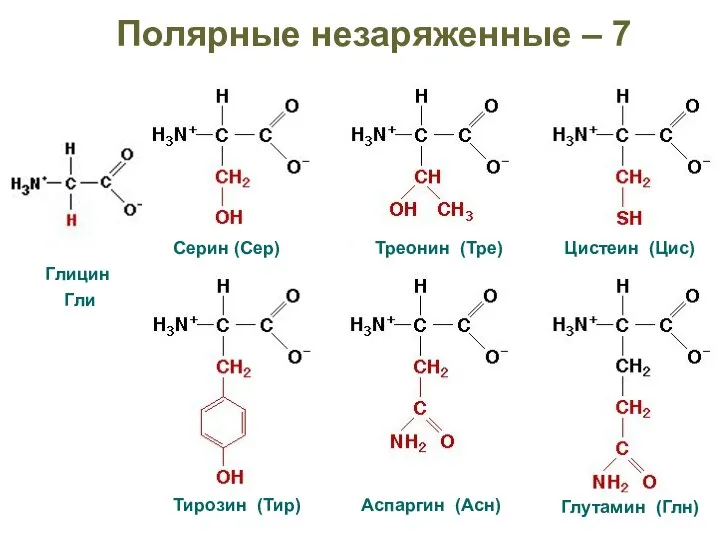
- 24. Полярные незаряженные – 7 Глицин Гли
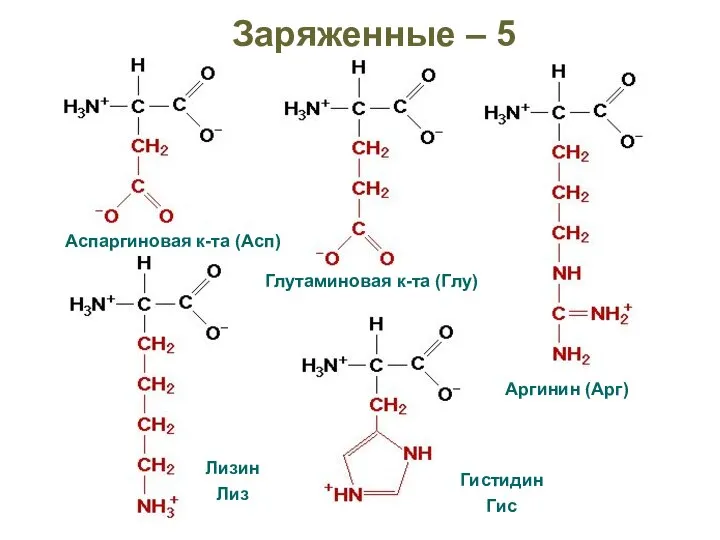
- 25. Заряженные – 5
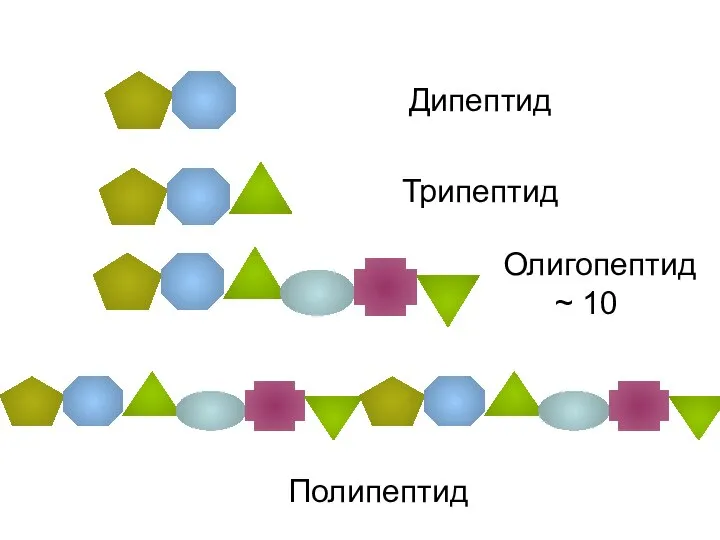
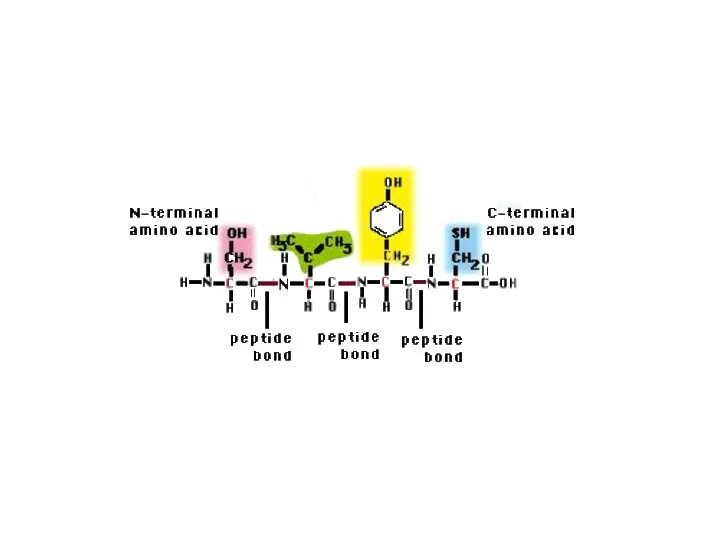
- 28. Дипептид Трипептид Олигопептид ~ 10 Полипептид
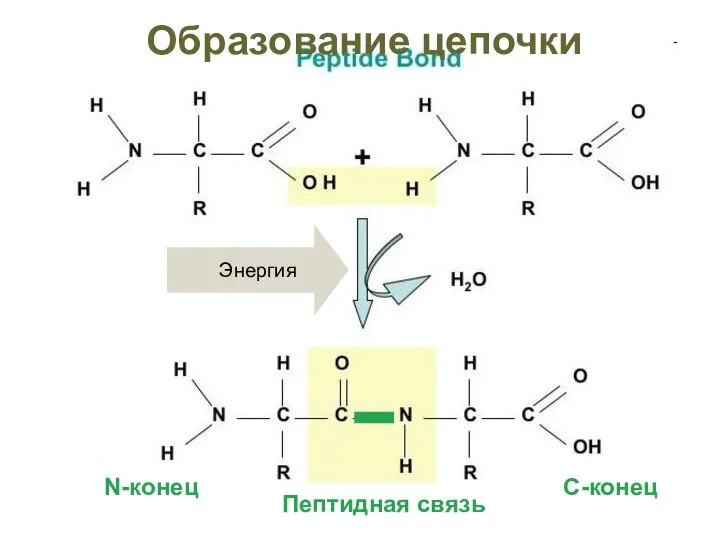
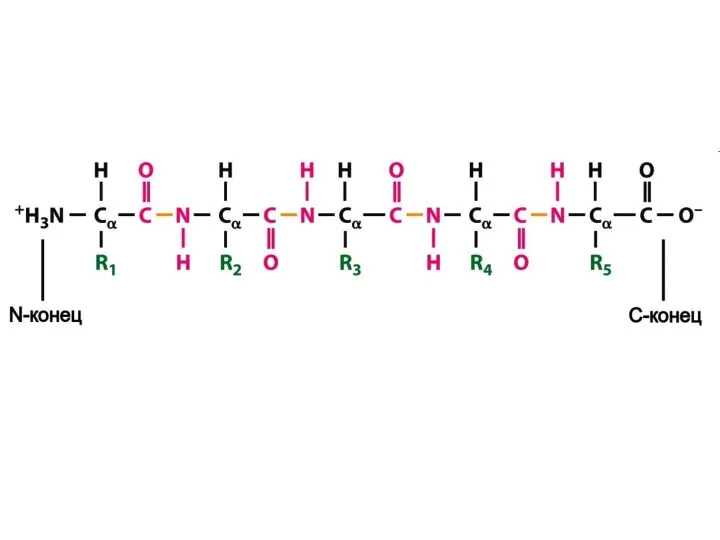
- 29. Первичная структура белка – это последовательность аминокислот в полипептидной цепочке, записанная в порядке N……..C. (соответствует направлению
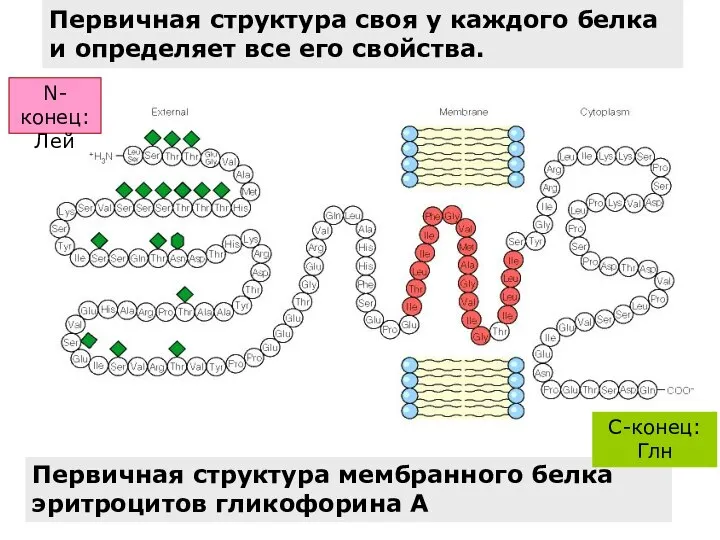
- 31. Первичная структура мембранного белка эритроцитов гликофорина А C-конец: Глн Первичная структура своя у каждого белка и
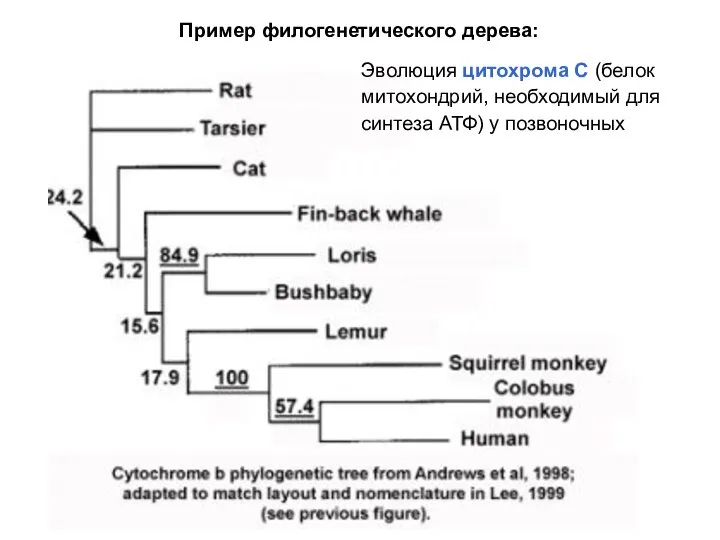
- 32. Белки с одной функцией у родственных видов имеют сходную I структуру Количество отличий отражает время их
- 33. Эволюция цитохрома С (белок митохондрий, необходимый для синтеза АТФ) у позвоночных Пример филогенетического дерева:
- 34. Эволюция шаперонина-60 за ~1.5 млрд.лет Растения и грибы Животные Простейшие Бактерии Найдите участки белка, эволюционирующие быстро
- 35. Сколько разных белков длиной в n мономеров можно построить из 20 а.к.? 20n Средний белок: 300
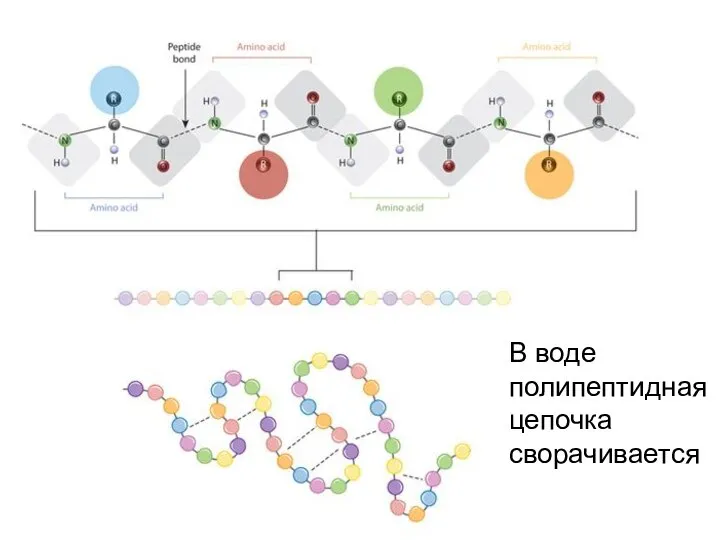
- 36. В воде полипептидная цепочка сворачивается
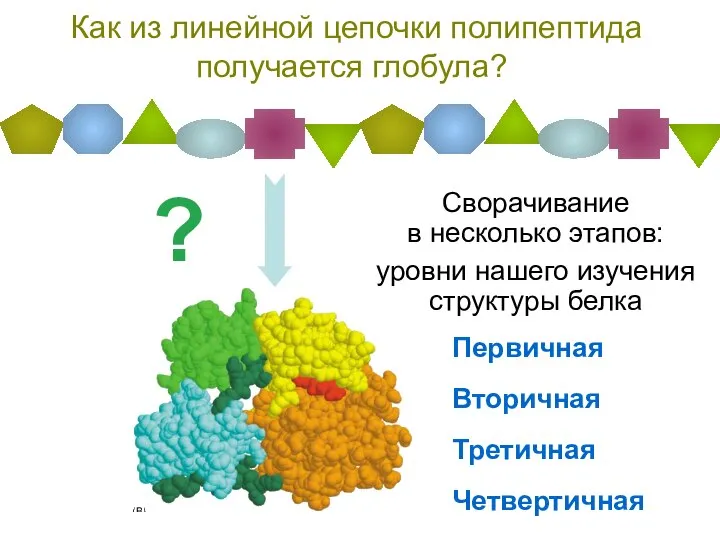
- 37. Как из линейной цепочки полипептида получается глобула? Сворачивание в несколько этапов: уровни нашего изучения структуры белка
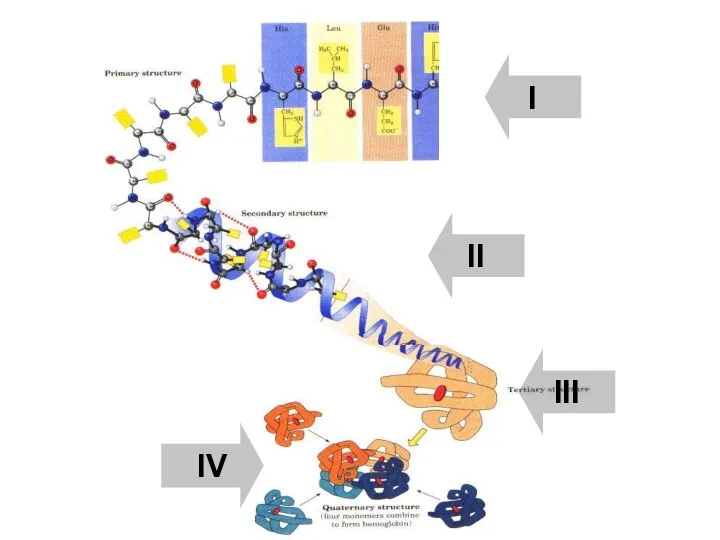
- 38. I II III IV
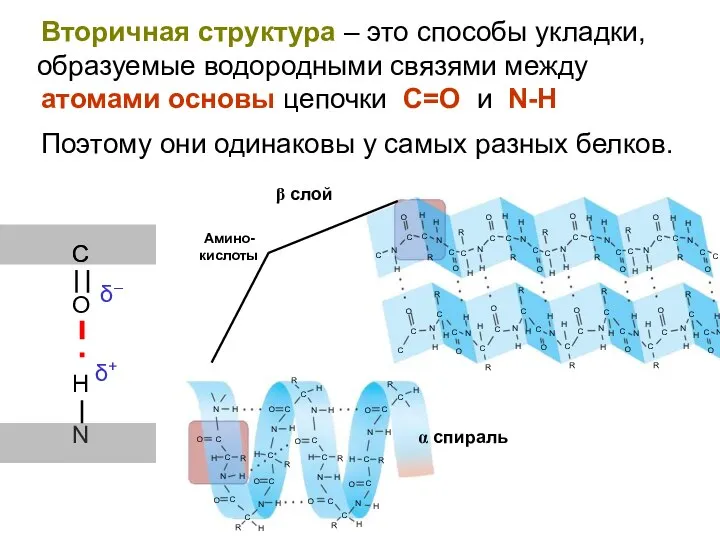
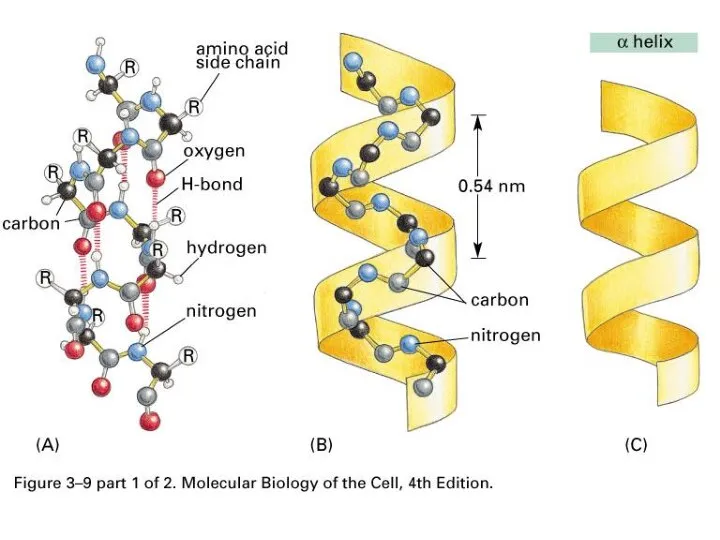
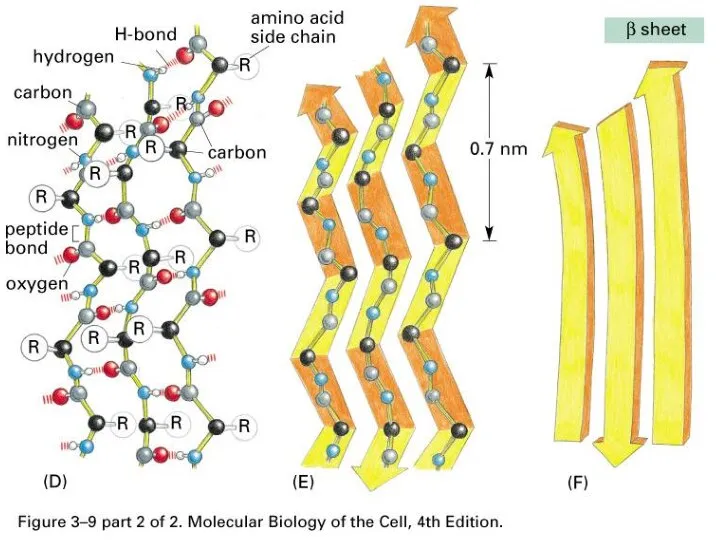
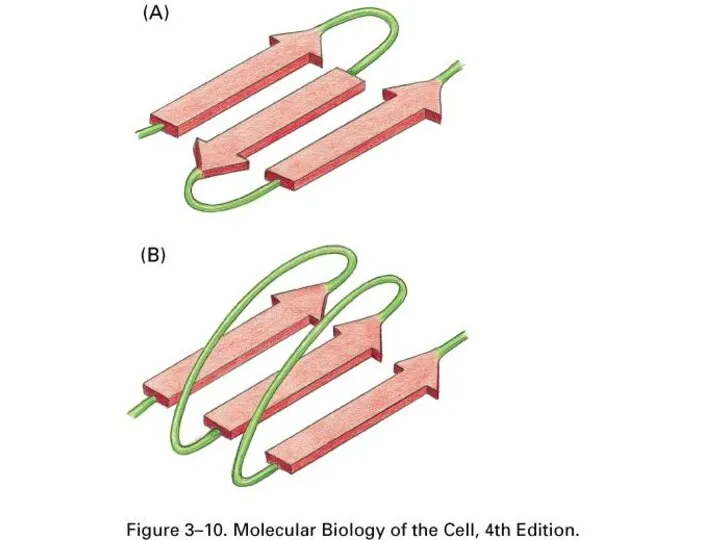
- 39. Вторичная структура – это способы укладки, образуемые водородными связями между атомами основы цепочки С=O и N-H
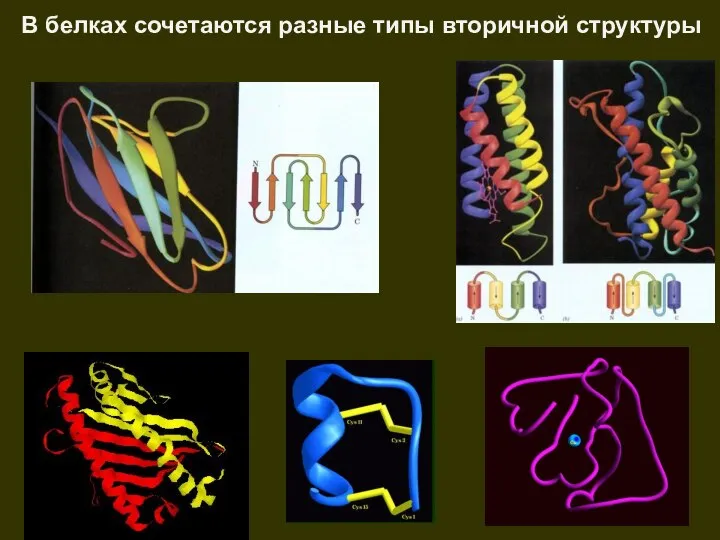
- 43. В белках сочетаются разные типы вторичной структуры
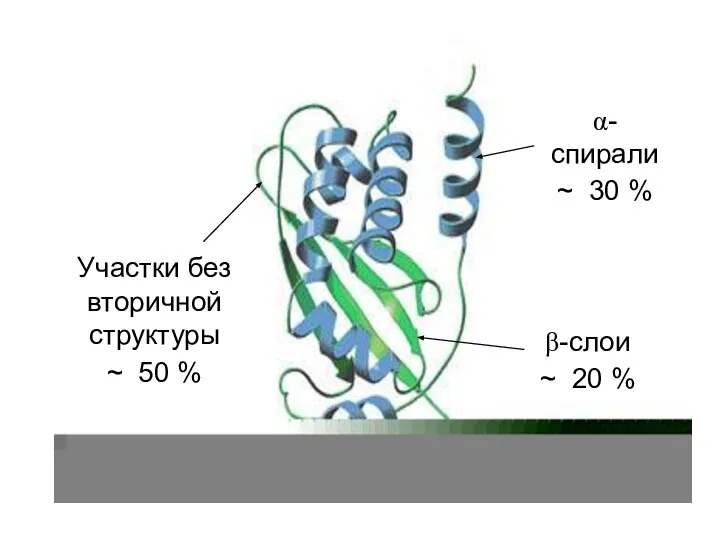
- 44. Встречаемость в белках разных вторичных структур 28% – 35% 18% – 26% 40% – 50% Нет
- 45. α-спирали ~ 30 % β-слои ~ 20 % Участки без вторичной структуры ~ 50 %
- 46. Лайнус Полинг Открытие α-спирали в 1951
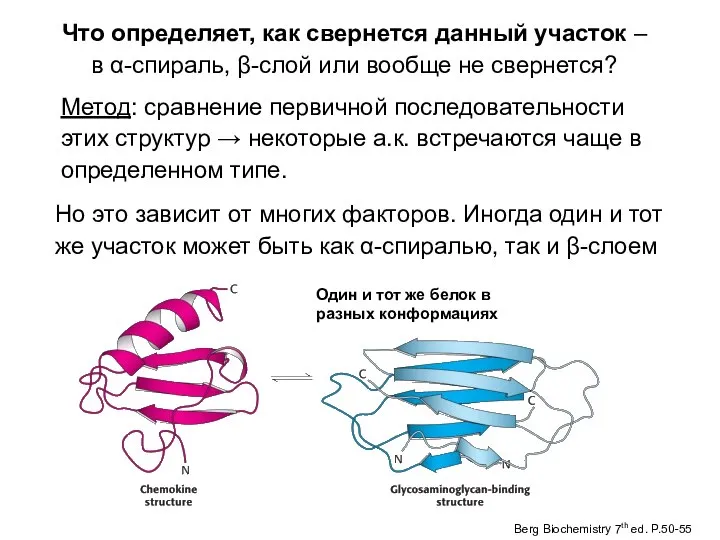
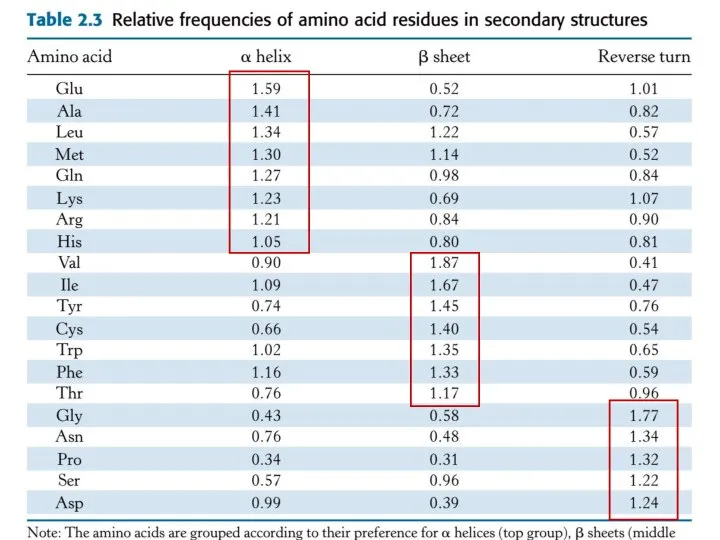
- 47. Что определяет, как свернется данный участок – в α-спираль, β-слой или вообще не свернется? Метод: сравнение
- 49. Итак, у нас есть цепочка с элементами II структуры
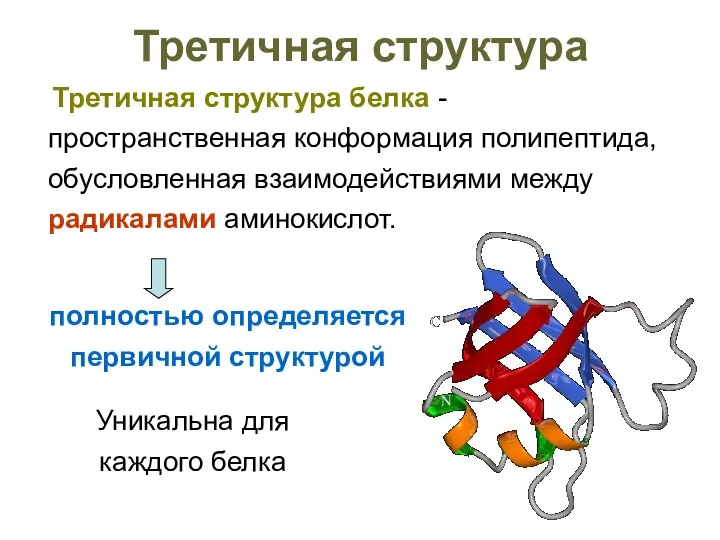
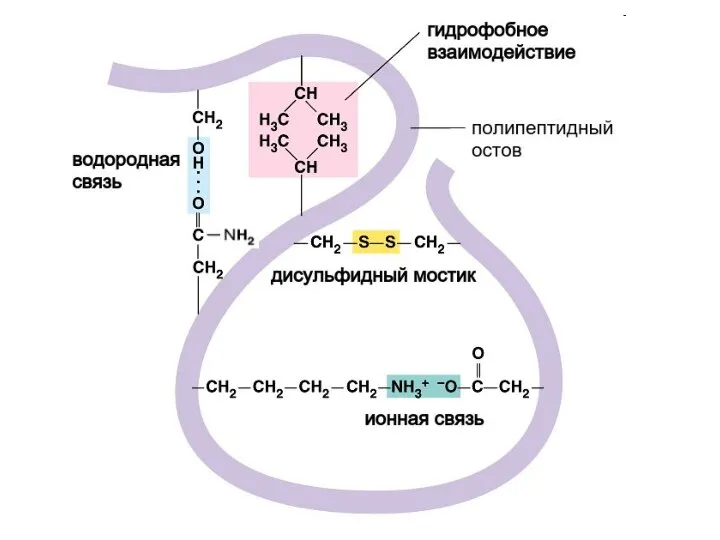
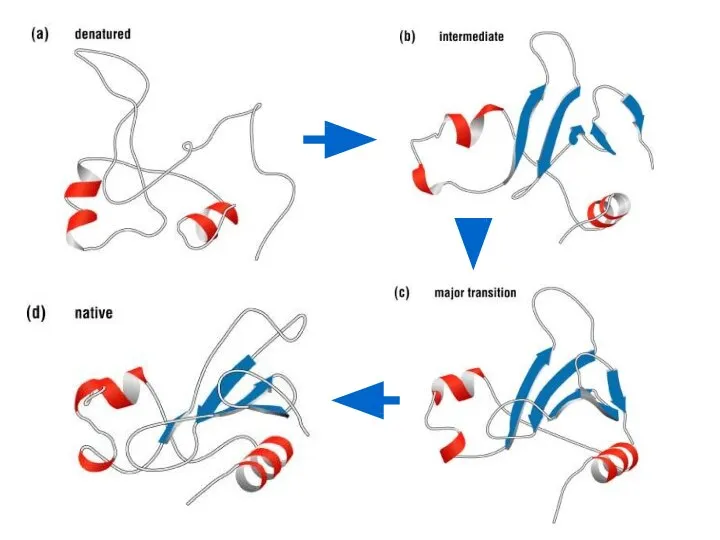
- 50. Третичная структура Третичная структура белка - пространственная конформация полипептида, обусловленная взаимодействиями между радикалами аминокислот. Уникальна для
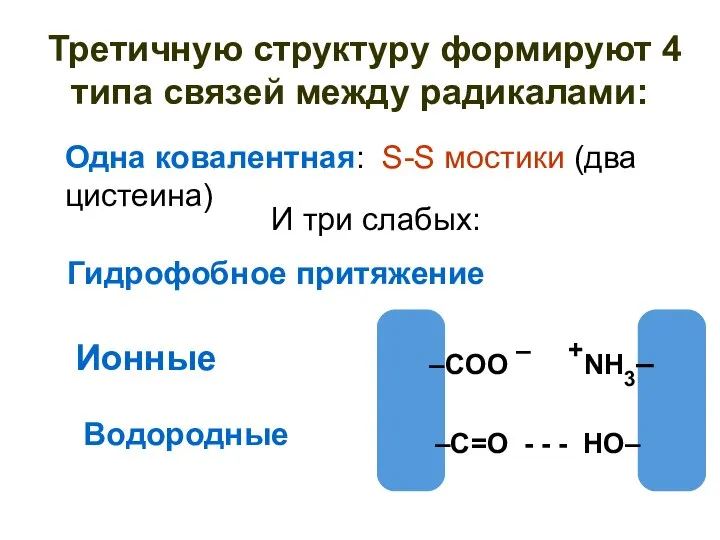
- 51. Третичную структуру формируют 4 типа связей между радикалами: Ионные –COO – +NH3– –C=O - - -
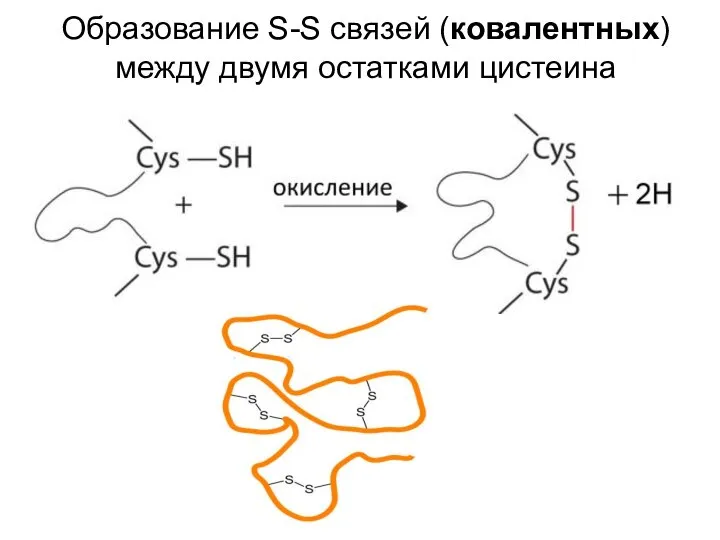
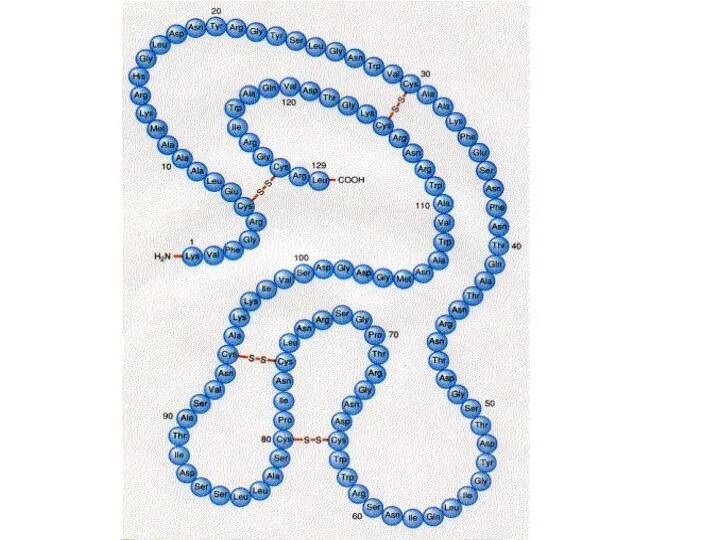
- 52. Образование S-S связей (ковалентных) между двумя остатками цистеина
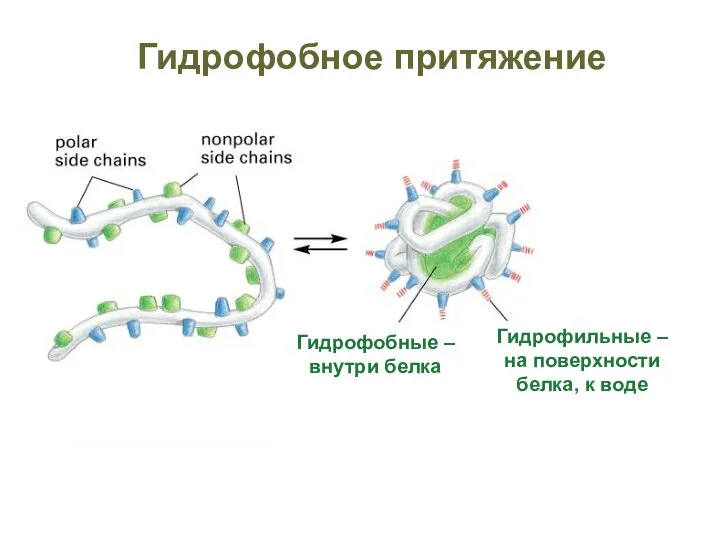
- 54. Гидрофобное притяжение
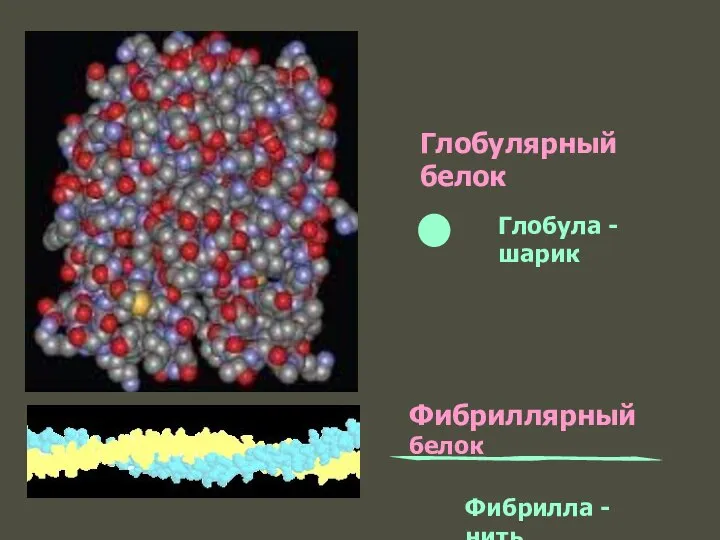
- 57. Глобулярный белок Фибриллярный белок Глобула - шарик Фибрилла - нить
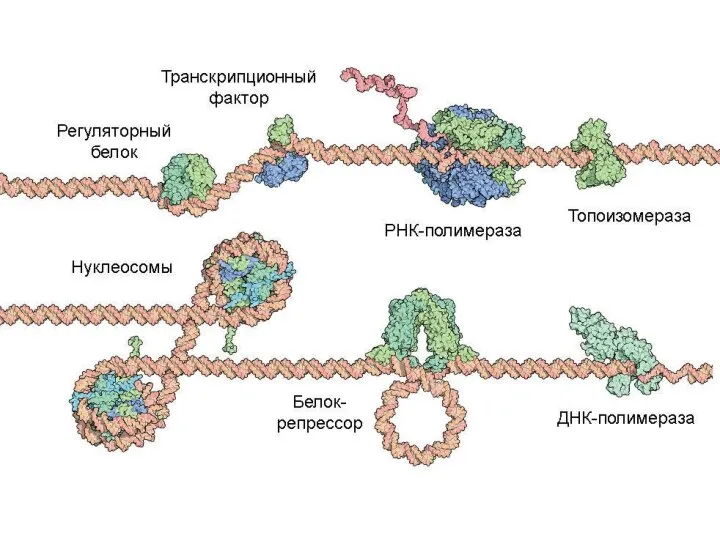
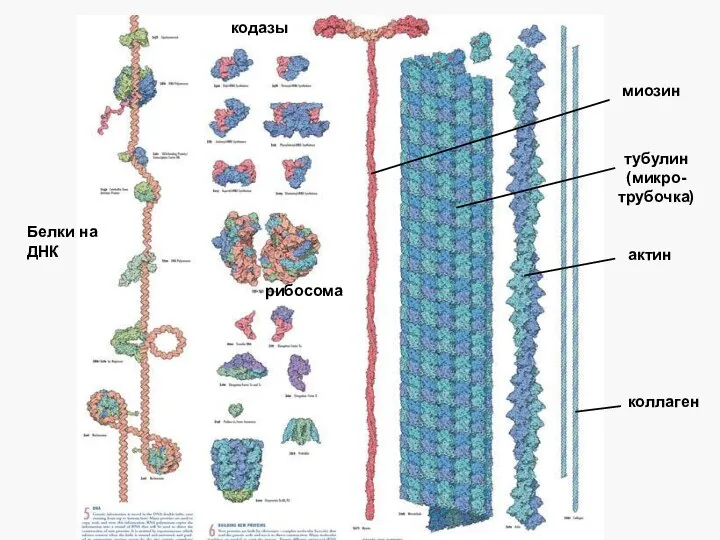
- 58. коллаген актин миозин тубулин (микро-трубочка) кодазы Белки на ДНК рибосома
- 59. Четвертичная структура Объединение двух и более (до 20) полипептидных цепочек в один белок. Одна цепочка =
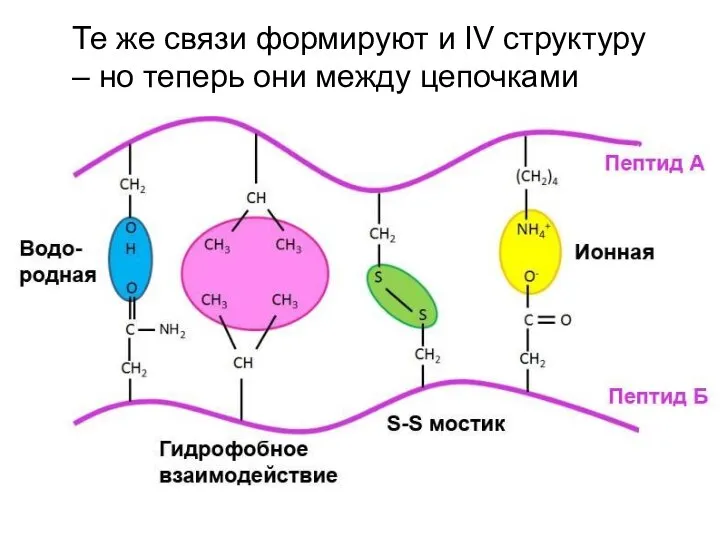
- 60. Те же связи формируют и IV структуру – но теперь они между цепочками
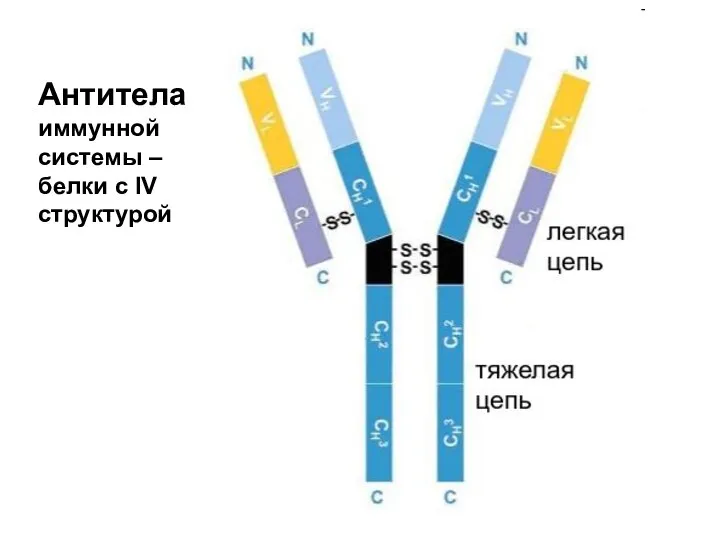
- 61. Антитела иммунной системы – белки с IV структурой
- 62. Четвертичная структура IV Разные цепочки – разным цветом
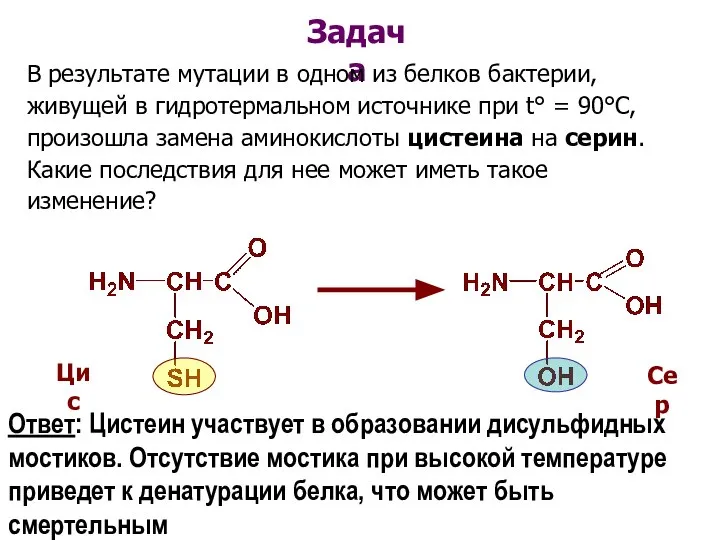
- 63. Задача В результате мутации в одном из белков бактерии, живущей в гидротермальном источнике при t° =
- 64. Белковые домены
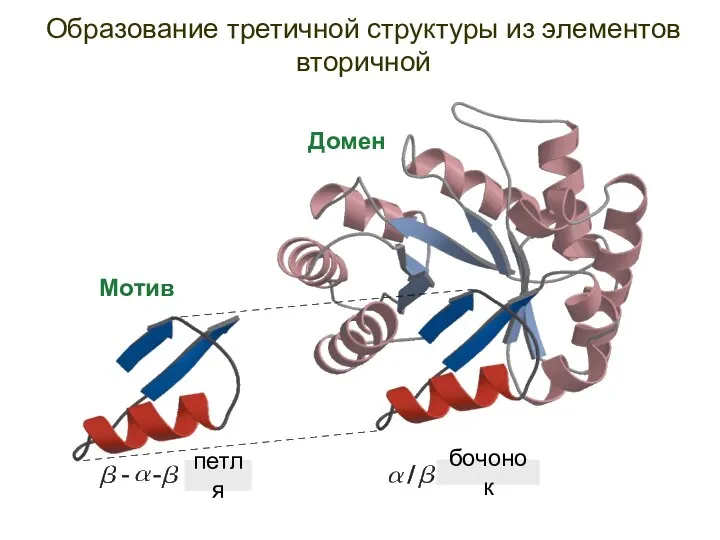
- 65. Образование третичной структуры из элементов вторичной Мотив Домен
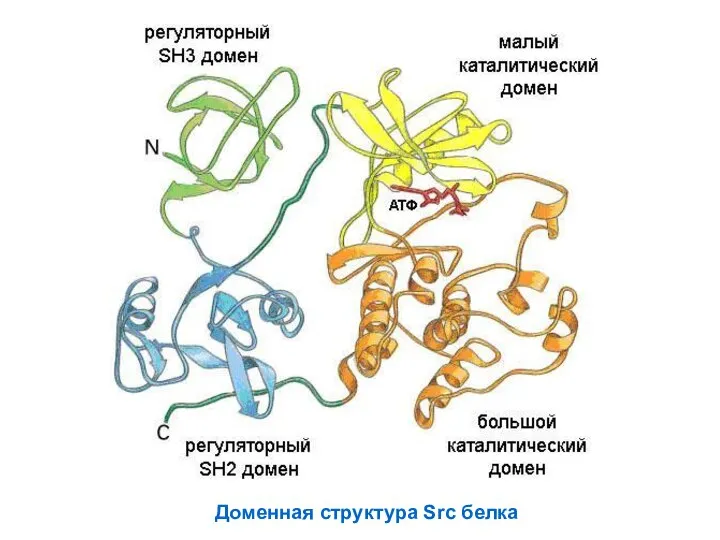
- 67. Доменная структура Src белка
- 68. Домен – часть белка выделенная структурно (сворачивается почти независимо) выполняет одну функцию В эволюции домены –
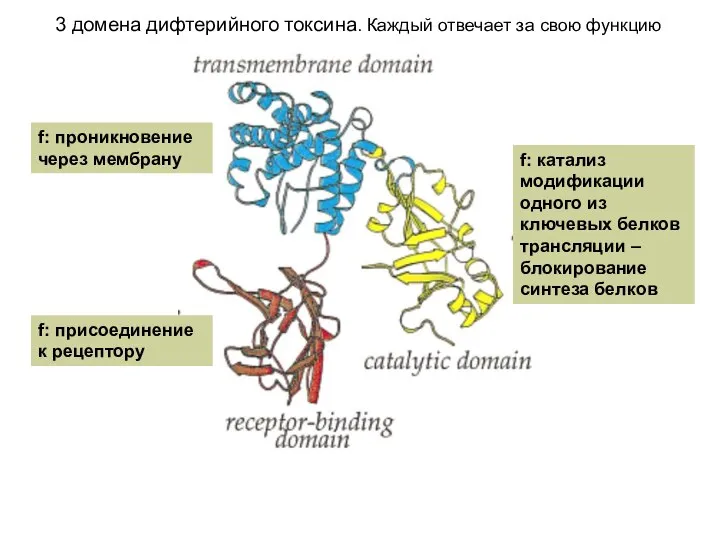
- 69. 3 домена дифтерийного токсина. Каждый отвечает за свою функцию f: присоединение к рецептору f: проникновение через
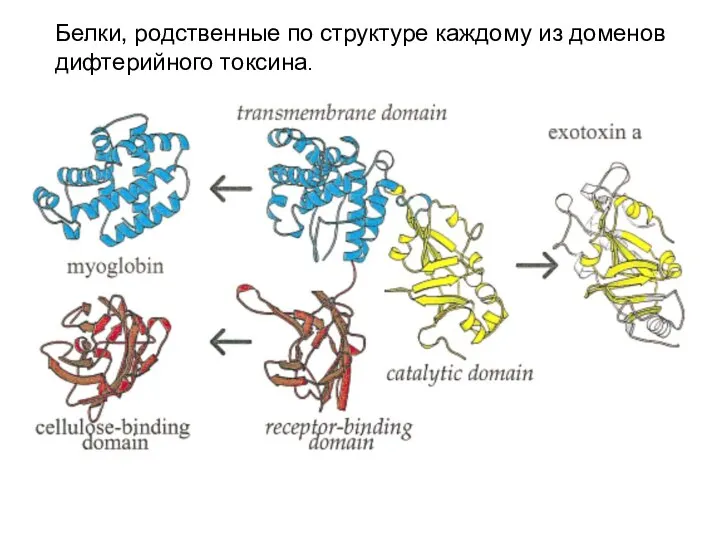
- 70. Белки, родственные по структуре каждому из доменов дифтерийного токсина.
- 71. Транспортный белок для липидов из двух доменов. Замена всего одной аминокислоты в этом белке влечет изменение
- 72. Базовых типов доменов мало – не более 1 000 Holm and Sander. PROTEINS: Structure, Function, and
- 73. Белки разных биологических видов с одной функцией – похожи по пространственной форме Хотя первичная последователь-ность может
- 74. Транспортный белок железа – ферритин человека (зеленый) и лошади (голубой)
- 75. Домашнее задание Уметь нарисовать аминокислоту и пептидную связь. Знать, что такое I, II, III и IV
- 76. Лишние слайды
- 79. Для биологических молекул важны не только химическая формула, но и форма Узнавание «ключ к замку»
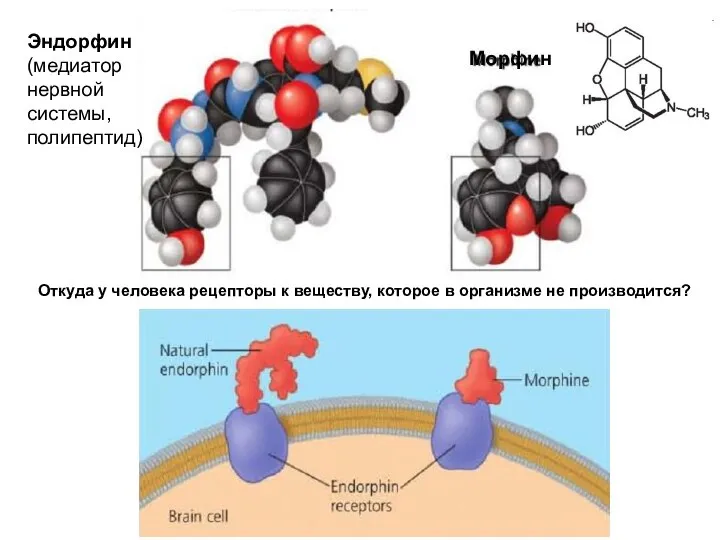
- 80. Эндорфин (медиатор нервной системы, полипептид) Морфин Откуда у человека рецепторы к веществу, которое в организме не
- 82. Скачать презентацию























 Воздушные вяжущие материалы
Воздушные вяжущие материалы Использование техники объемной лепки в изготовлении традиционной русской новогодней игрушки из ваты
Использование техники объемной лепки в изготовлении традиционной русской новогодней игрушки из ваты Interdependence between migration and terrorism within the EU borders
Interdependence between migration and terrorism within the EU borders Модернизация стран Востока, перспективы процесса
Модернизация стран Востока, перспективы процесса Кто такой инвестор и как с ним договариваться Мария Саулина Директор портала biznesbomba.ru. - презентация
Кто такой инвестор и как с ним договариваться Мария Саулина Директор портала biznesbomba.ru. - презентация Религия во время Великой Отечественной войны
Религия во время Великой Отечественной войны Аттестационная работа. Памятники религиозной культуры города Нижнекамск
Аттестационная работа. Памятники религиозной культуры города Нижнекамск Школьный портфель Мир верх ногами
Школьный портфель Мир верх ногами Презентация на тему "Использование современных образовательных технологий в начальной школе" - скачать презентации по Педаг
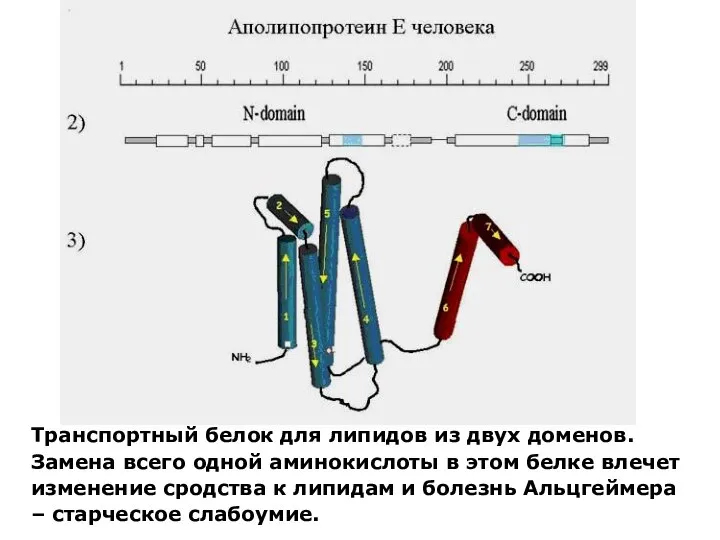
Презентация на тему "Использование современных образовательных технологий в начальной школе" - скачать презентации по Педаг Автор: Банникова Алёна, 6 класс, Объединение «Волшебный краснотал» Педагог Н.В.Бородина
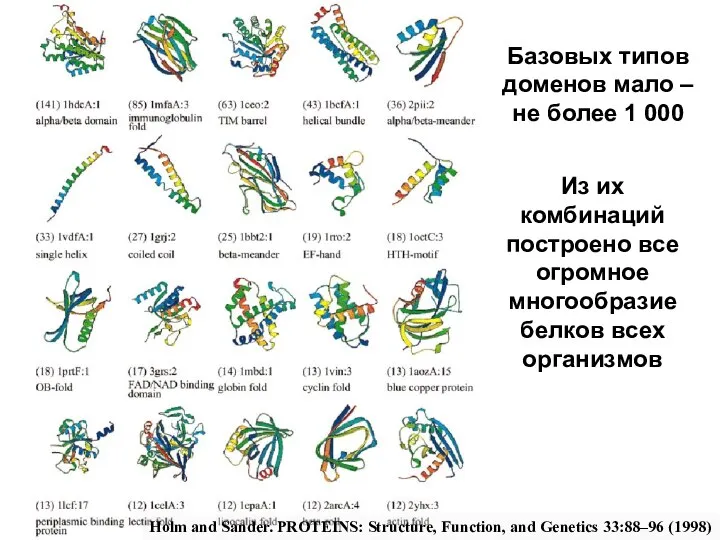
Автор: Банникова Алёна, 6 класс, Объединение «Волшебный краснотал» Педагог Н.В.Бородина Оригами из модулей
Оригами из модулей Типы автоматических коробок передач
Типы автоматических коробок передач Директорские часы ГБОУ лицей №623 30.11.2014 года Актовый зал
Директорские часы ГБОУ лицей №623 30.11.2014 года Актовый зал ЗАДАНИЕ ПО ФУНКЦИЯМ МЕНЕДЖМЕНТА
ЗАДАНИЕ ПО ФУНКЦИЯМ МЕНЕДЖМЕНТА Пеппи в стране Веселии - презентация для начальной школы
Пеппи в стране Веселии - презентация для начальной школы Лекарственные средства, влияющие на систему крови
Лекарственные средства, влияющие на систему крови  Обработка одномерных массивов
Обработка одномерных массивов Берлитион
Берлитион  Репка - презентация для начальной школы
Репка - презентация для начальной школы День матери
День матери Орындаған: Құмарбекова Н.Е Қабылдаған: Қожекенова Ж.А. Топ: 10-011-02қ Факультет: жалпы медицина
Орындаған: Құмарбекова Н.Е Қабылдаған: Қожекенова Ж.А. Топ: 10-011-02қ Факультет: жалпы медицина Достопримечательности США
Достопримечательности США Технологические процессы в строительстве
Технологические процессы в строительстве Спринг-эластика. Начни себя в гимнастике
Спринг-эластика. Начни себя в гимнастике Дитяча експлуатація
Дитяча експлуатація Великие гуманисты Европы
Великие гуманисты Европы Дауысты дыбыстар
Дауысты дыбыстар Основы проектирования и оснащения производства
Основы проектирования и оснащения производства