Содержание
- 2. Начало XXI века связано с внедрением в молекулярную медицину развитых стран новых бурно развивающихся технологий. Среди
- 3. применения методов генотерапии, на успех которых возлагались большие надежды. Однако, при работе с гаметами и зародышевыми
- 4. В дальнейшем такие попытки коснулись больных с глиобластомой, семейной гиперхолестеринемией, гемофилией В, муковисцидозом, миодистрофией Дюшенна-Бекера и
- 5. целевого белка, воздействие генетическими вакцинами и патоген-специфическими лимфоцитами; генотерапия на основе свойств молекул нуклеиновых кислот. Целью
- 6. Генетическая вакцина - это самая маленькая структурная единица, сохранившая свойства и специфичность исходного антитела за счет
- 7. Основные направления генотерапии: 1. Генные технологии в иммунотерапии. Основаны на ДНК-вакцинах, обеспечивающих высокий уровень защиты, длительно
- 8. способности вируса к тканевому тропизму, например, вирус простого герпеса избирательно проникает в нейроны и латентно в
- 9. антиген-презентирующие клетки можно применять как трансфецированные векторами клетки для борьбы с метастазами при несформировавшихся узлах и
- 10. трансплантата (гены клеточной адгезии 1, ген синтазы 2, ген с-myb). Клеточные технологии Использование для лечения клеток,
- 11. Эта терапия базируется на введении в клетку нормального гена или удалении из нее дефектного гена. В
- 12. Эти клетки легко идентифицируются и хорошо сохраняются. Их 2 типа: эмбриональные стволовые (ЭСК) и собственно стволовые
- 13. Вторые клетки , с одной стороны, это пластичность и способность поддерживать дифференцировку клеток в тканях взрослого
- 14. направления иммунных реакций при опухолях, инфекциях и аутоиммунной патологии. Они служат векторами и мишенями для изменения
- 15. Формы опухолей: меланома, В-клеточная лимфома, раки простаты, молочной железы, яичника, толстой кишки, легких, поджелудочной железы, почечно-клеточный
- 16. особенности межклеточных и клеточно-матриксных взаимодействий и их роль в поддержании гомеостаза клеток и целостности тканей. Все
- 17. хорошо интегрируется в организм, осуществляя в нем постоянное лечение. Например, так осуществляется пересадка компонентов кожи при
- 18. Вторая модель - это имплантация клеток, содержащих вещества, индуцирующие репарацию и восстановление функции поврежденной ткани. Модель
- 19. Нанотехнологии и нанообъекты Нанотехнологии оперируют с объектами нанометрового размера («нано» - происходит от греческого «гном», или
- 20. материалы, мицеллярные системы и микроэмульсии, тонкие пленки и поверхностные слои, биологические мембраны, жидкие кристаллы, фотонные кристаллы,
- 21. микрочастицы и составляющие их молекулы и атомы большего размера. Нанобиотехнологии - это слежение, исправление, конструирование и
- 22. Наномедицина - это разработка и внедрение нанобиотехнологий в медицину для диагностики и лечения болезней. При этом
- 23. • использование наночастиц как лекарств; • синтетический геном на основе молекулы ДНК как самовоспроизводящейся системы; •
- 24. Дальнейшее развитие протеомики определяется разработкой и внедрением методов в диапазоне концентраций от 10-3 до 10-20, т.е.
- 25. смеси на 20 белков с массой 10-100 кДа проводится всего за 15 секунд против нескольких часов
- 26. даже отдельные молекулы и их комплексы. Среди них: атомносиловые и другие сканирующие микроскопы, криомасс-детекторы, нанопроводные и
- 27. Например, применение широкопольной микроскопии с полным внутренним отражением позволило наблюдать реакцию каталитического расщепления АТР одиночной молекулой
- 28. Они способны преодолевать гематоэнцефалический барьер, что позволяет использовать их для лечения тяжелых нейро-дегенеративных заболеваний, например, болезни
- 30. Скачать презентацию



























 Травма позвоночника
Травма позвоночника  Молодёжная мода и стиль
Молодёжная мода и стиль Чертежный шрифт
Чертежный шрифт Основы ассемблера: регистры, операнды, пересылки. Компьютерные основы программирования. Представление программ, часть 1
Основы ассемблера: регистры, операнды, пересылки. Компьютерные основы программирования. Представление программ, часть 1 Магистерская программа «Учет, аудит и финансовый консалтинг»
Магистерская программа «Учет, аудит и финансовый консалтинг» Тест Административные правонарушения
Тест Административные правонарушения Методы обследования больных в клинике ортопедической стоматологии
Методы обследования больных в клинике ортопедической стоматологии Вживання алкоголю та куріння у громадських місцях
Вживання алкоголю та куріння у громадських місцях Святые Вера, Надежда, Любовь и мать их София
Святые Вера, Надежда, Любовь и мать их София Образование русских и английских фамилий
Образование русских и английских фамилий Оголошення класів
Оголошення класів Турнир по мини – футболу, посвященный 70-летию битвы под Москвой
Турнир по мини – футболу, посвященный 70-летию битвы под Москвой Презентация на тему: экономическая мысль древней греции. Подготовил студент 1-ого курса Героев Матвей
Презентация на тему: экономическая мысль древней греции. Подготовил студент 1-ого курса Героев Матвей Peter Drucker
Peter Drucker Мораль: структура и функции
Мораль: структура и функции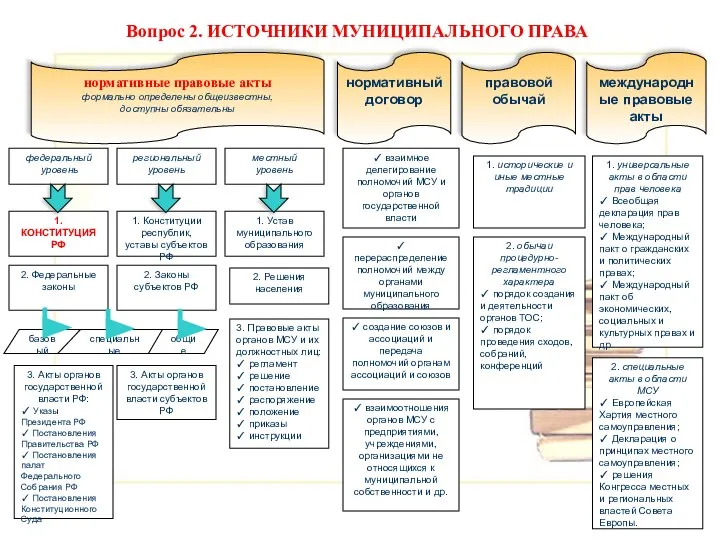 Источники муниципального права
Источники муниципального права ОСЕНЬ
ОСЕНЬ Франкфуртська школа
Франкфуртська школа Восстановление изношенных стрел культиватора
Восстановление изношенных стрел культиватора Графика в Turbo Pascal
Графика в Turbo Pascal География транспорта мира
География транспорта мира Формы предпринимательской деятельности.
Формы предпринимательской деятельности.  Политические партии
Политические партии Формирование гражданского общества в России
Формирование гражданского общества в России 6 класс математика тема урока Решение задач на составление уравнений
6 класс математика тема урока Решение задач на составление уравнений  Алгоритмы с ветвлением. Тест
Алгоритмы с ветвлением. Тест Поверхности. Определитель поверхности
Поверхности. Определитель поверхности Финансовый менеджмент в банке
Финансовый менеджмент в банке