Содержание
- 3. Благодаря биохимическим исследованиям можно: выявить причину болезни предложить пути лечения разработать методики для массового обследования населения
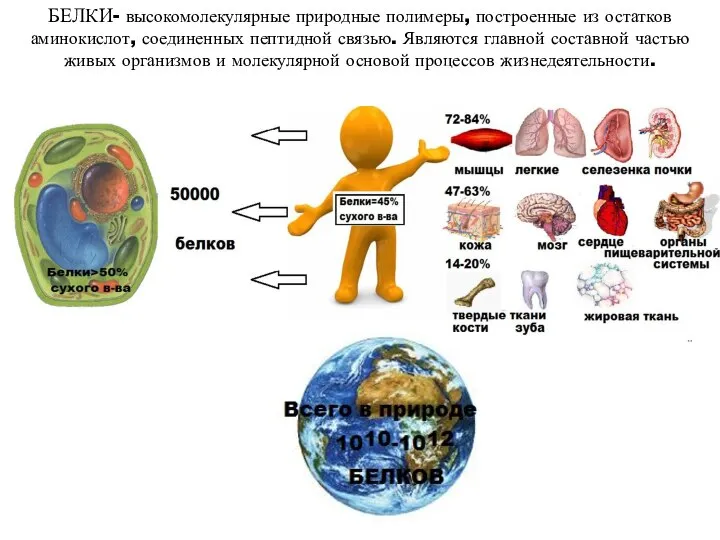
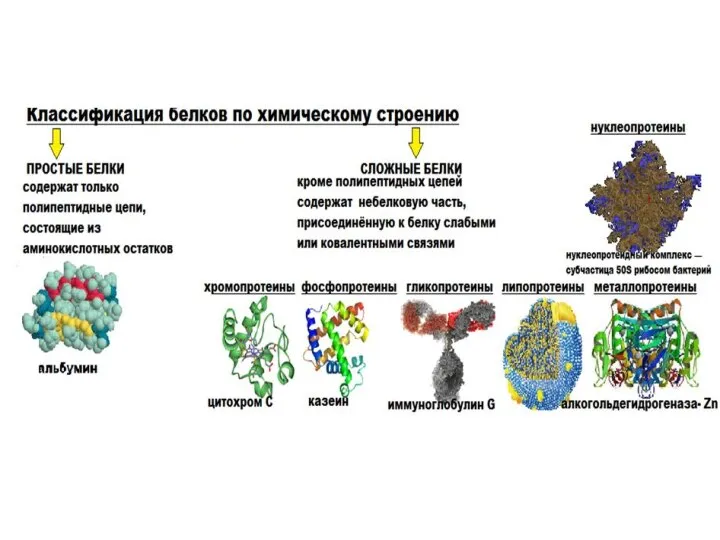
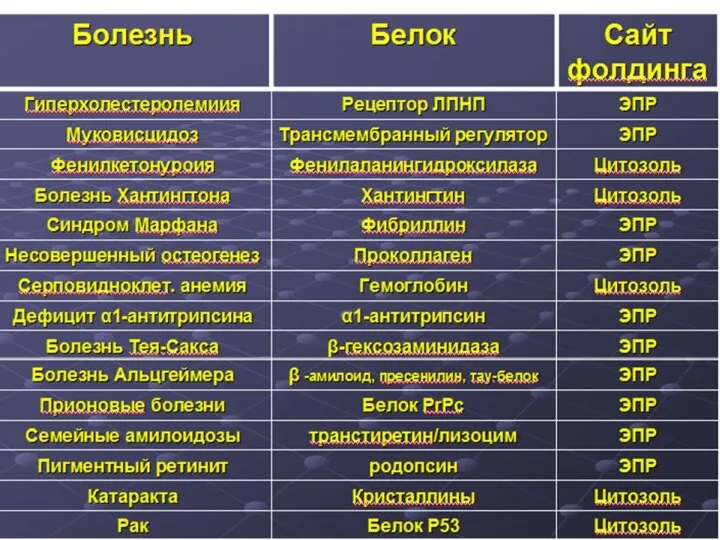
- 6. БЕЛКИ- высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных пептидной связью. Являются главной составной частью живых
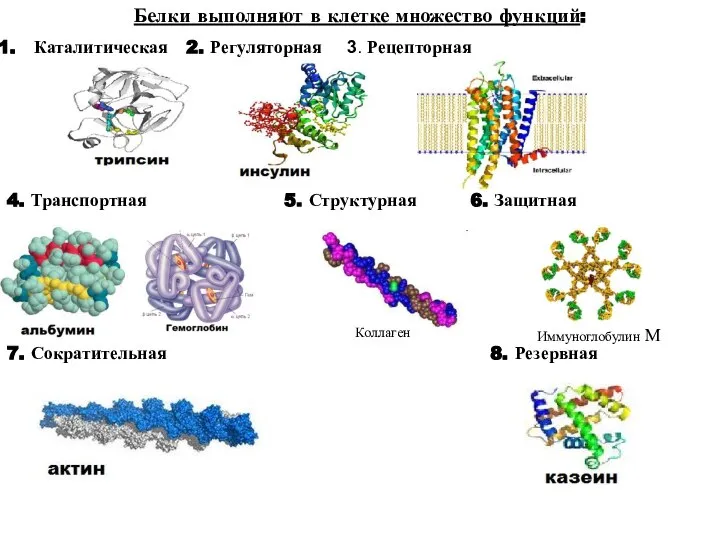
- 7. Белки выполняют в клетке множество функций: Каталитическая 2. Регуляторная 3. Рецепторная 4. Транспортная 5. Структурная 6.
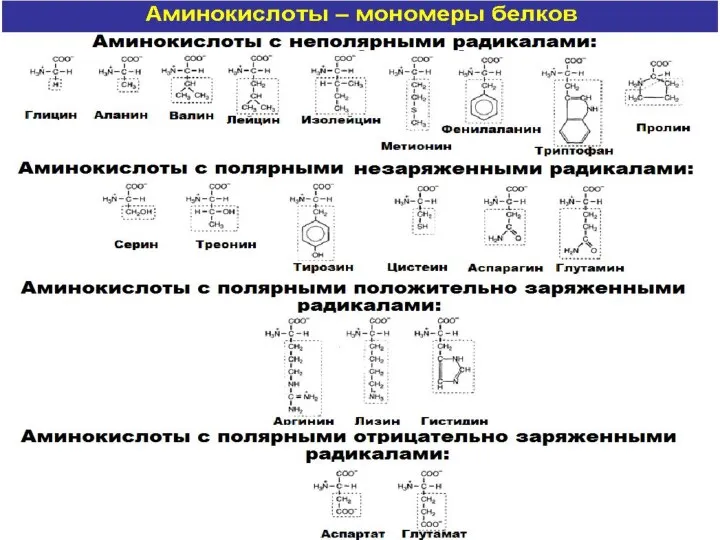
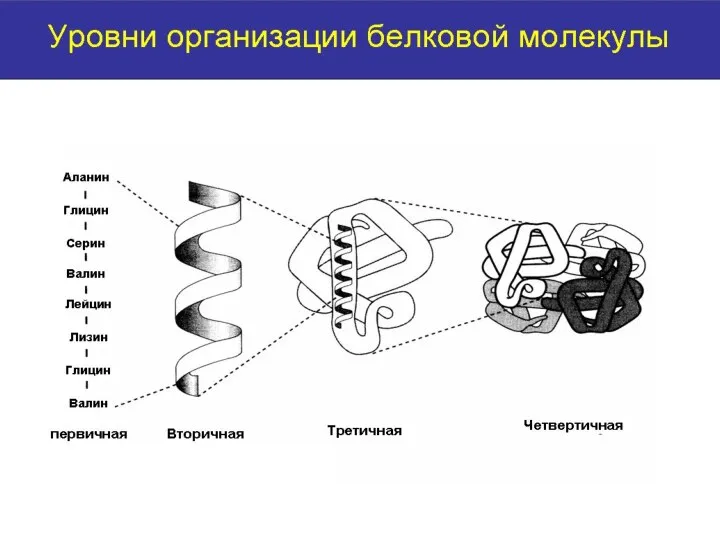
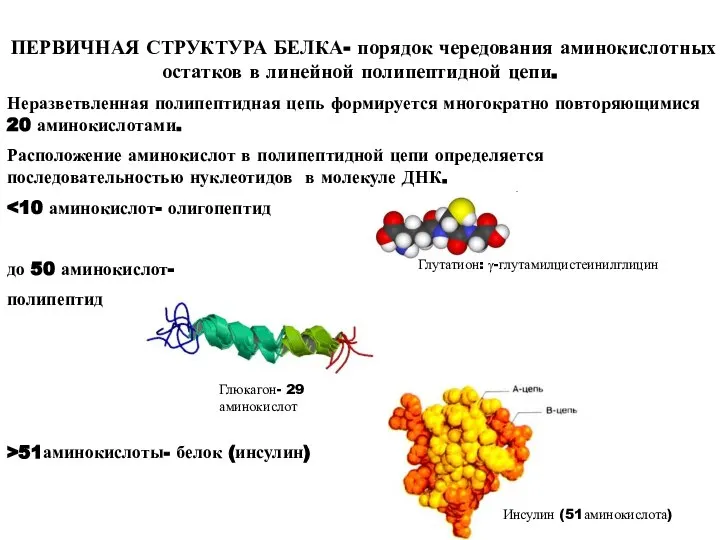
- 12. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА- порядок чередования аминокислотных остатков в линейной полипептидной цепи. Неразветвленная полипептидная цепь формируется многократно
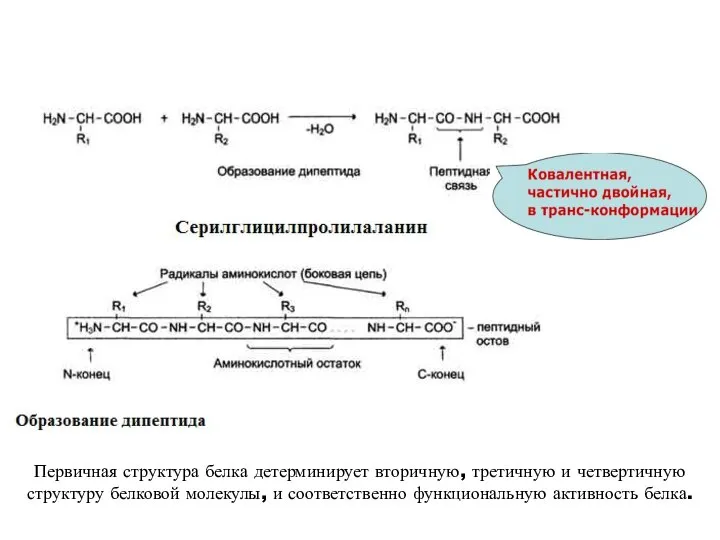
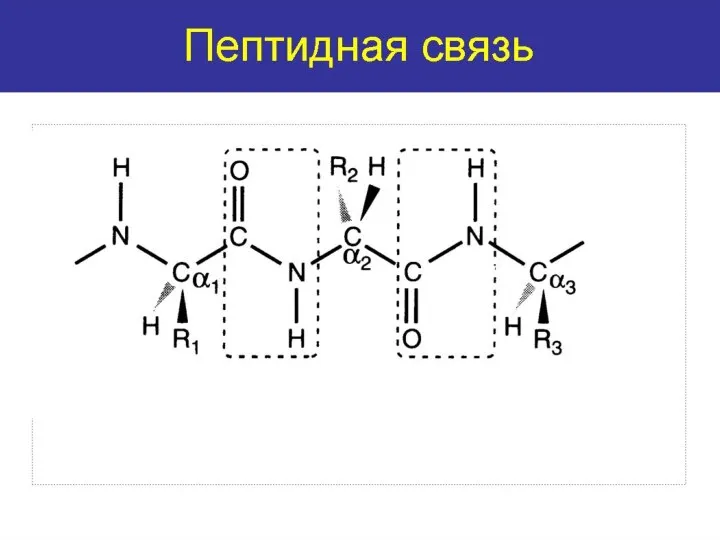
- 13. Первичная структура белка детерминирует вторичную, третичную и четвертичную структуру белковой молекулы, и соответственно функциональную активность белка.
- 15. Лайнус Карл Полинг Роберт Кори
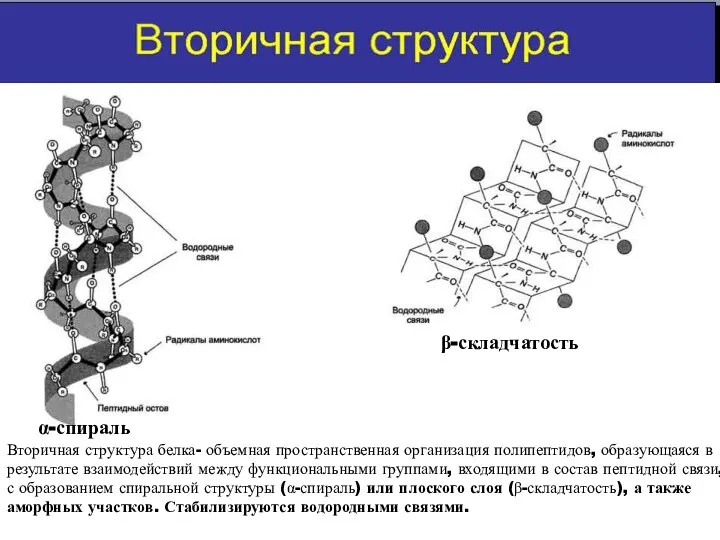
- 16. α-спираль β-складчатость Вторичная структура белка- объемная пространственная организация полипептидов, образующаяся в результате взаимодействий между функциональными группами,
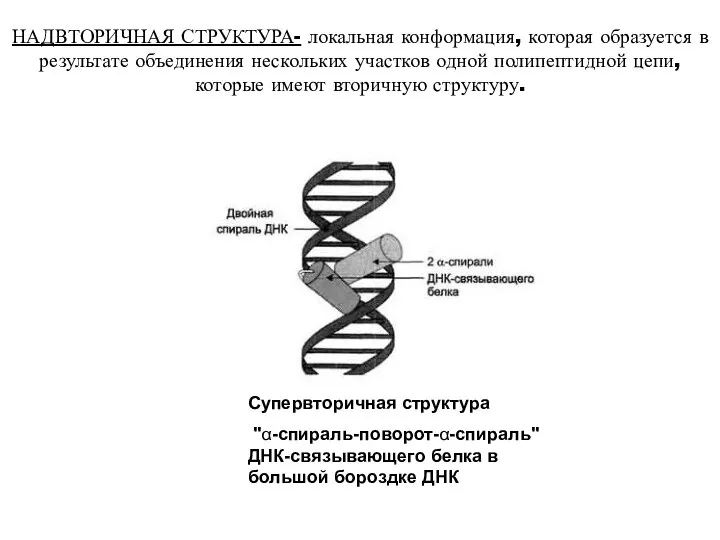
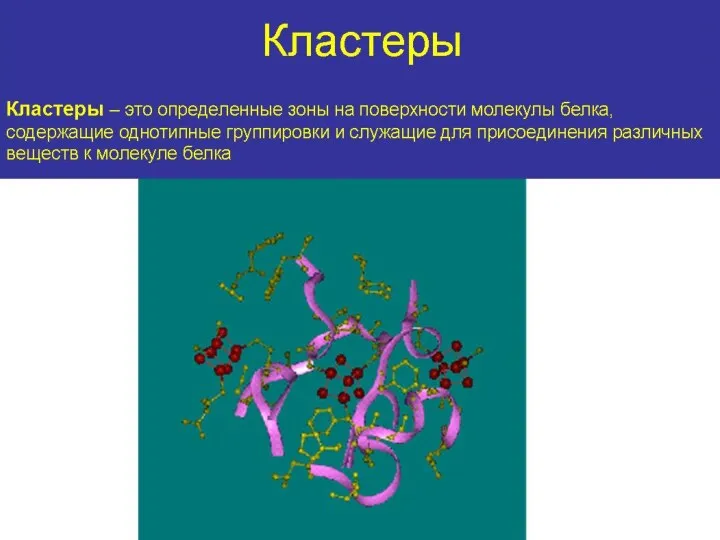
- 17. НАДВТОРИЧНАЯ СТРУКТУРА- локальная конформация, которая образуется в результате объединения нескольких участков одной полипептидной цепи, которые имеют
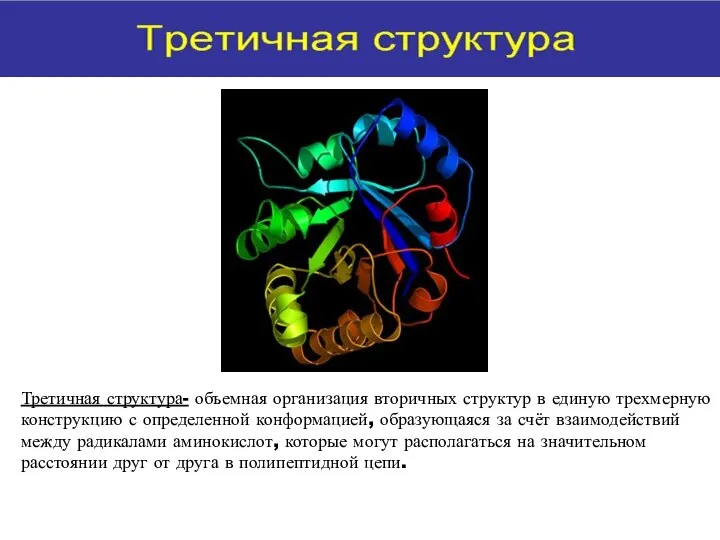
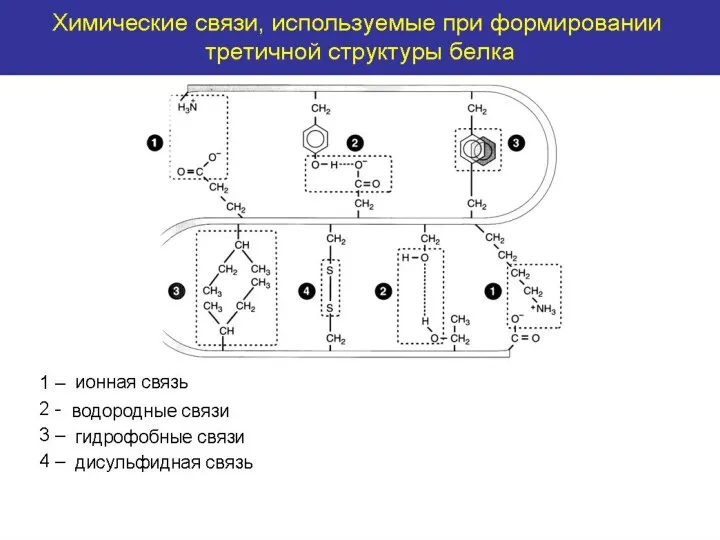
- 18. Третичная структура- объемная организация вторичных структур в единую трехмерную конструкцию с определенной конформацией, образующаяся за счёт
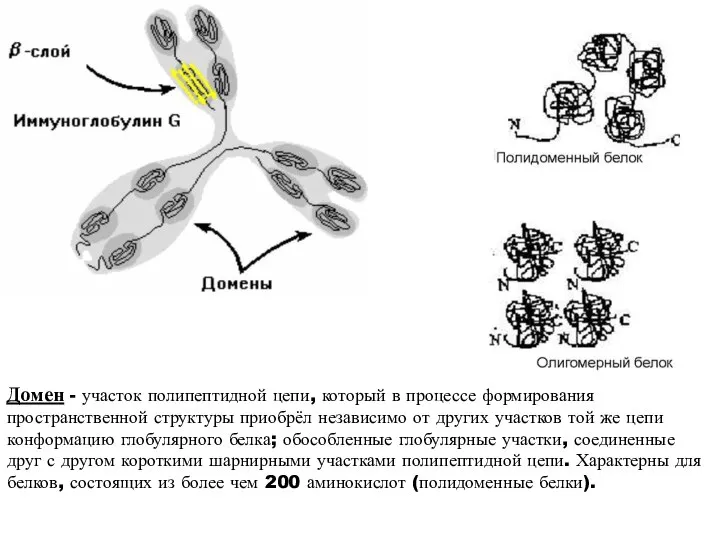
- 20. Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков
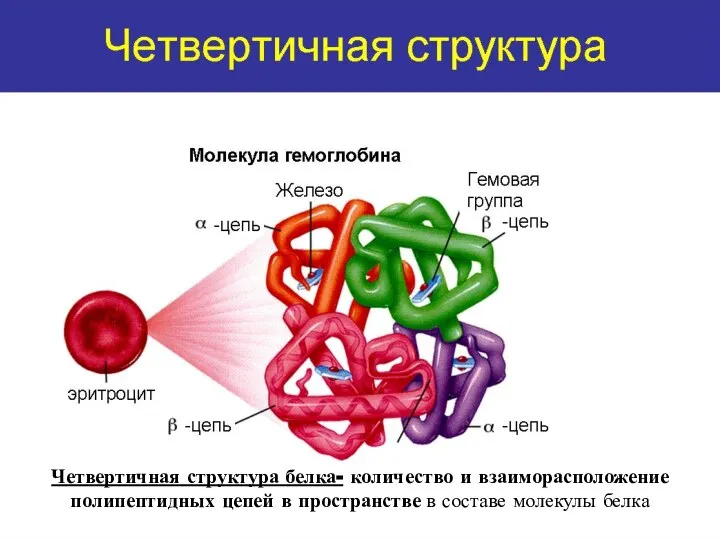
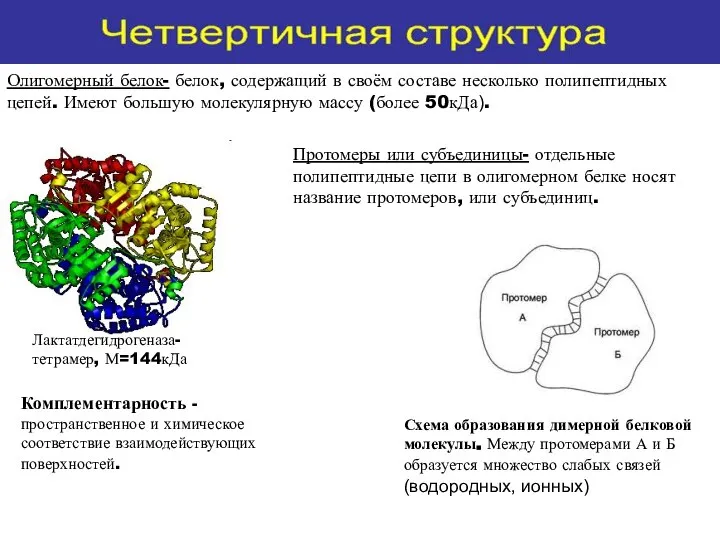
- 22. Четвертичная структура белка- количество и взаиморасположение полипептидных цепей в пространстве в составе молекулы белка
- 23. Схема образования димерной белковой молекулы. Между протомерами А и Б образуется множество слабых связей (водородных, ионных)
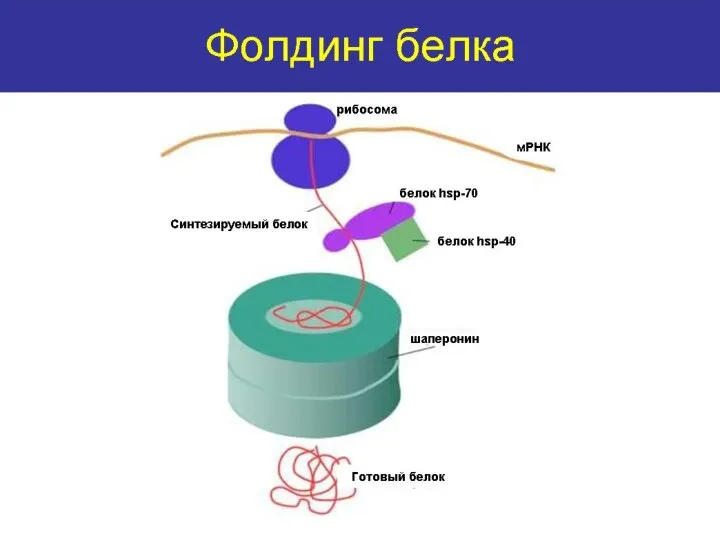
- 26. Нативная структура- функционально активная конформацию белка определяющая его специфическую функцию. ФОЛДИНГ- процесс сворачивания полипептидной цепи в
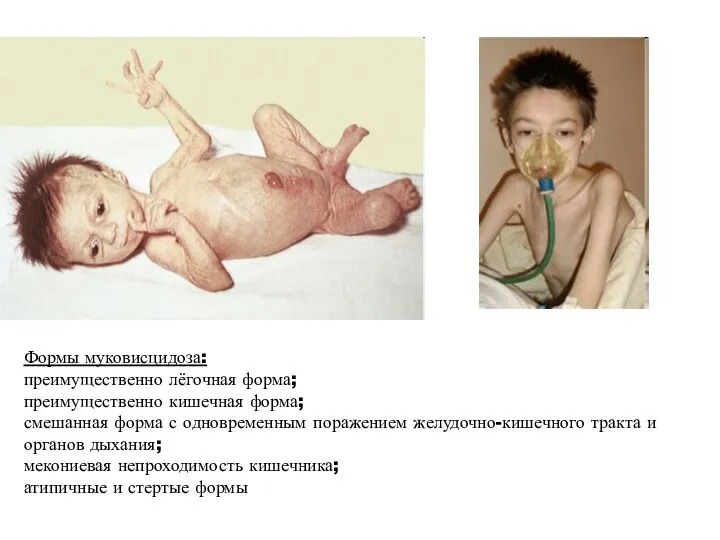
- 31. Формы муковисцидоза: преимущественно лёгочная форма; преимущественно кишечная форма; смешанная форма с одновременным поражением желудочно-кишечного тракта и
- 34. Скачать презентацию












 Региональная политика КНР
Региональная политика КНР Секуляризация. Принятие независимости от религии
Секуляризация. Принятие независимости от религии Основные угрозы безопасности и социально-политической стабильности на Юге России
Основные угрозы безопасности и социально-политической стабильности на Юге России Презентация Структура фтс россии Тест
Презентация Структура фтс россии Тест  Презентация "О все видавшем" - скачать презентации по МХК
Презентация "О все видавшем" - скачать презентации по МХК Станки с ЧПУ. Технологическое оборудование
Станки с ЧПУ. Технологическое оборудование Черлидинг
Черлидинг Бесконтактная система зажигания автомобилей
Бесконтактная система зажигания автомобилей Презентация на тему "Система работы с одарёнными детьми" - скачать презентации по Педагогике
Презентация на тему "Система работы с одарёнными детьми" - скачать презентации по Педагогике Изучение Гетерогенности
Изучение Гетерогенности  Автоматические трансмиссии
Автоматические трансмиссии Каталитические нейтрализаторы отработавших газов бензиновых двигателей внутреннего сгорания
Каталитические нейтрализаторы отработавших газов бензиновых двигателей внутреннего сгорания Синдром «психологического выгорания» педагогов ДНЗ «Светя другим, сгораю сам…» Латинская поговорка
Синдром «психологического выгорания» педагогов ДНЗ «Светя другим, сгораю сам…» Латинская поговорка История доктрины церкви
История доктрины церкви Пам'ятки Канади
Пам'ятки Канади Монитор и клавиатура
Монитор и клавиатура  Поздние гестозы
Поздние гестозы Вентильный электродвигатель
Вентильный электродвигатель Презентация "Нефтяная промышленность Казахстана" - скачать презентации по Экономике
Презентация "Нефтяная промышленность Казахстана" - скачать презентации по Экономике Обучение выбору разделительного знака
Обучение выбору разделительного знака Поверхности в машиностроении. Основы теории режущих инструментов
Поверхности в машиностроении. Основы теории режущих инструментов Послание к Филиппийцам
Послание к Филиппийцам Система таможенных органов в системе гос.управления в 15-16 веках Подготовили студенты группы ФТД-111, Васильев Станислав, Мухина Мар
Система таможенных органов в системе гос.управления в 15-16 веках Подготовили студенты группы ФТД-111, Васильев Станислав, Мухина Мар Аттестационная работа. Создание творческого проекта «Кукла-мотанка»
Аттестационная работа. Создание творческого проекта «Кукла-мотанка» Священномученик Михаил Гусев
Священномученик Михаил Гусев ВОСПИТАТЕЛЬНАЯ СИСТЕМА КЛАССА КАК ПЕДАГОГИЧЕСКОЕ ЯВЛЕНИЕ И ПОНЯТИЕ
ВОСПИТАТЕЛЬНАЯ СИСТЕМА КЛАССА КАК ПЕДАГОГИЧЕСКОЕ ЯВЛЕНИЕ И ПОНЯТИЕ Система спинного мозга
Система спинного мозга Родительское собрание по теме « Роль родителей в трудовом воспитании подростка»
Родительское собрание по теме « Роль родителей в трудовом воспитании подростка»