Содержание
- 2. 09/02/2023 Коваль А. Н., 2006 (C) Содержание Свойства ферментов (термолабильность, специфичность и др.). Механизм действия ферментов.
- 3. 09/02/2023 Коваль А. Н., 2006 (C) Свойства ферментов Термолабильность – скорость ферментативных реакций зависит от температуры.
- 4. 09/02/2023 Коваль А. Н., 2006 (C) Действие большинства ферментов высокоспецифично Специфичность к типам каталитических реакций (реакционная
- 5. 09/02/2023 Коваль А. Н., 2006 (C) Механизм действия ферментов. Теории «ключ-замок», «рука-перчатка» Э. Фишер предложил предложил
- 6. 09/02/2023 Коваль А. Н., 2006 (C) Механизм действия ферментов. Концепции «дыбы» и «лилипутов» В 1954 году
- 7. 09/02/2023 Коваль А. Н., 2006 (C) Механизм действия ферментов. Современные взгляды Современные концепции на механизм ферментативного
- 8. 09/02/2023 Коваль А. Н., 2006 (C) Теория промежуточных соединений Выдвинутая в 1913 году Л. Михаэлисом и
- 9. 09/02/2023 Коваль А. Н., 2006 (C) Теория промежуточных соединений. Этапы взаимодействия фермента и субстрата 1 этап:
- 10. 09/02/2023 Коваль А. Н., 2006 (C) Теория промежуточных соединений. Имеется реакция: S → P + Q
- 11. 09/02/2023 Коваль А. Н., 2006 (C) Основы термодинамики катализа Из недостаточности чисто статических взаимоотношений в духе
- 12. 09/02/2023 Коваль А. Н., 2006 (C) Энергия активации. Энергия активации - энергия, необходимая для перевода всех
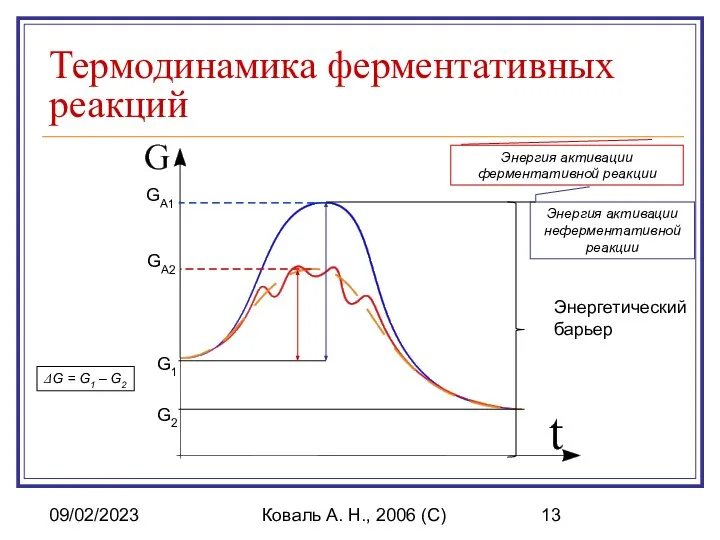
- 13. 09/02/2023 Коваль А. Н., 2006 (C) Термодинамика ферментативных реакций Энергетический барьер G2 G1 ΔG = G1
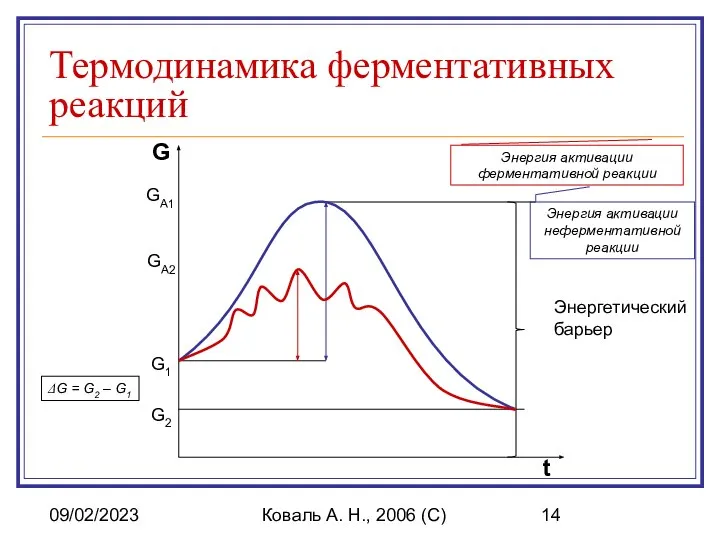
- 14. 09/02/2023 Коваль А. Н., 2006 (C) Термодинамика ферментативных реакций Энергетический барьер G2 G1 ΔG = G2
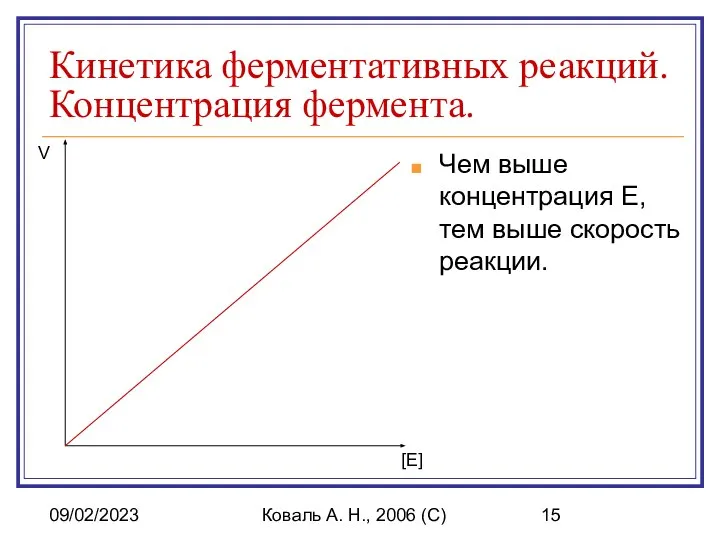
- 15. 09/02/2023 Коваль А. Н., 2006 (C) Кинетика ферментативных реакций. Концентрация фермента. Чем выше концентрация E, тем
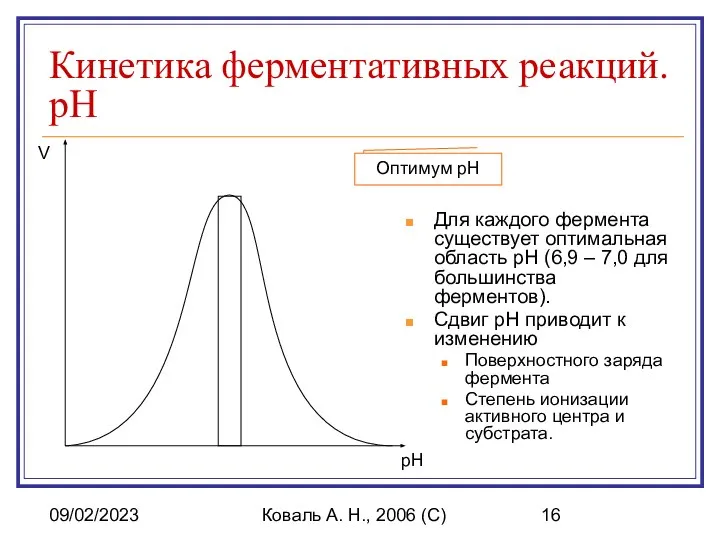
- 16. 09/02/2023 Коваль А. Н., 2006 (C) Кинетика ферментативных реакций. pH Для каждого фермента существует оптимальная область
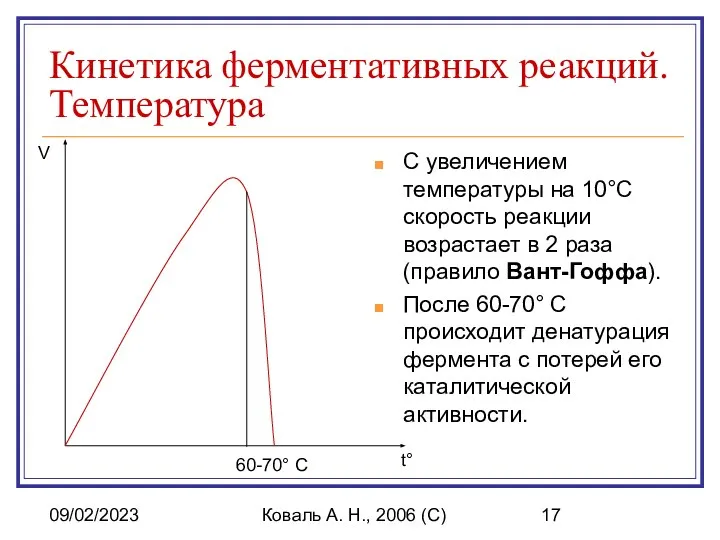
- 17. 09/02/2023 Коваль А. Н., 2006 (C) Кинетика ферментативных реакций. Температура С увеличением температуры на 10°C скорость
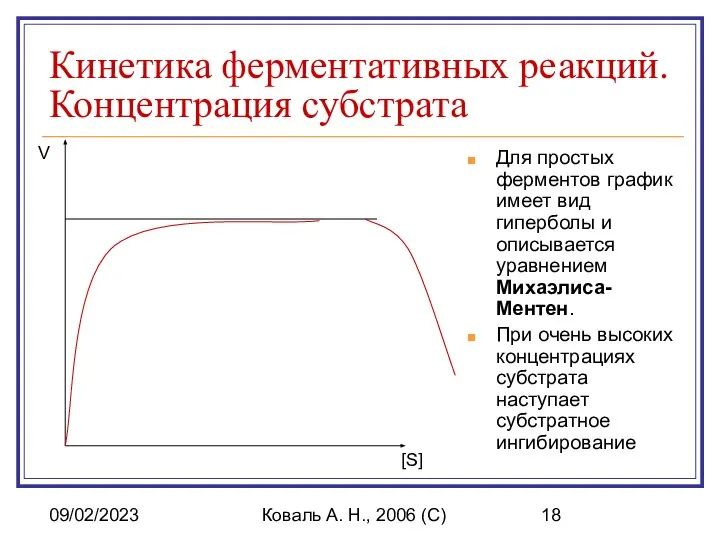
- 18. 09/02/2023 Коваль А. Н., 2006 (C) Кинетика ферментативных реакций. Концентрация субстрата Для простых ферментов график имеет
- 19. 09/02/2023 Коваль А. Н., 2006 (C) Кинетика ферментативных реакций Исследование зависимости скорости ферментативных реакций от концентрации
- 21. Скачать презентацию












 машинное обучение
машинное обучение  Институты развития и их роль в реализации проектов
Институты развития и их роль в реализации проектов Закаливание детей
Закаливание детей Задание В4.
Задание В4. Презентация "Информационни системи в помощ на стартиращия бизнес" - скачать презентации по Экономике
Презентация "Информационни системи в помощ на стартиращия бизнес" - скачать презентации по Экономике Конституційний лад України
Конституційний лад України Статистическая форма учета перемещения товаров
Статистическая форма учета перемещения товаров  Світильник. Принципова схема
Світильник. Принципова схема СТРУКТУРА УМК УЧЕБНИК ТЕТРАДЬ УЧЕНИКА ХРЕСТОМАТИЯ ДИДАКТИЧЕСКИЕ МАТЕРИАЛЫ МЕТОДИЧЕСКОЕ ПОСОБИЕ ДЛЯ
СТРУКТУРА УМК УЧЕБНИК ТЕТРАДЬ УЧЕНИКА ХРЕСТОМАТИЯ ДИДАКТИЧЕСКИЕ МАТЕРИАЛЫ МЕТОДИЧЕСКОЕ ПОСОБИЕ ДЛЯ  Комуністична партія України
Комуністична партія України Құқық шығармашылық және нормативтік құқықтық актілерді жүйелеу. Заң техникасы
Құқық шығармашылық және нормативтік құқықтық актілерді жүйелеу. Заң техникасы Сетевая экономика
Сетевая экономика Педагогическая инноватика Составитель: Галеева И.Ш., методист ГИДЦ
Педагогическая инноватика Составитель: Галеева И.Ш., методист ГИДЦ Юридические лица: понятие и признаки. Коммерческие и некоммерческие организации
Юридические лица: понятие и признаки. Коммерческие и некоммерческие организации Пневматическая подвеска HINO 500
Пневматическая подвеска HINO 500 Семлев Т-082
Семлев Т-082  Кабельный пробник
Кабельный пробник Татьянин день
Татьянин день Малый театр
Малый театр  Презентация "Балет, танцоры и хореографы" - скачать презентации по МХК
Презентация "Балет, танцоры и хореографы" - скачать презентации по МХК Учение о генотипе
Учение о генотипе  Педагогические приемы создания ситуации успеха ученика
Педагогические приемы создания ситуации успеха ученика Взнос на капитальный ремонт общего имущества многоквартирного дома. Реквизиты
Взнос на капитальный ремонт общего имущества многоквартирного дома. Реквизиты Родительское собрание ( круглый стол) Развитие внимания у младшего школьника Выявление признаков дефицита вним
Родительское собрание ( круглый стол) Развитие внимания у младшего школьника Выявление признаков дефицита вним КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ в исследовании околоносовых пазух ОТДЕЛЕНИЕ РКТ, ПОЛИКЛИНИКА ОАО «ГАЗПРОМ» К.М.Н. АЛЕКСАХИНА Т.Ю.
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ в исследовании околоносовых пазух ОТДЕЛЕНИЕ РКТ, ПОЛИКЛИНИКА ОАО «ГАЗПРОМ» К.М.Н. АЛЕКСАХИНА Т.Ю.  Товариство з обмеженою відповідальністю «АРТ-БУД-ПЛЮС»
Товариство з обмеженою відповідальністю «АРТ-БУД-ПЛЮС» Назначение и виды строительных генеральных планов
Назначение и виды строительных генеральных планов  EVENT-менеджмент. Технологические аспекты
EVENT-менеджмент. Технологические аспекты